大强度间歇运动对肥胖大鼠骨骼肌AMPK/PGC-1α通路的影响
房华玉 徐建方 王晓静 李良 孔喜良 路瑛丽 冯连世
1 国家体育总局体育科学研究所(北京100061)
2 曲阜师范大学(山东曲阜 273165)
由于体力活动的减少和/或不科学的饮食行为引起的肥胖及肥胖并发症发生率急剧增加。大量研究已经证明,长期有氧运动能够改善健康和肥胖人群的体成分、心肺功能以及其它与健康相关的指标[1,2]。但长期单纯有氧运动存在运动时间过长、运动过程单调等不足,导致运动的积极性下降,效果下降。随着探讨大强度间歇运动(high-intensity interval training,HIIT)对超重青少年[3]、老年人[4]以及慢病人员[5,6]的减脂效果及对健康影响研究的深入,越来越多的证据表明,HIIT能提高机体有氧能力[7,8]、减少腹部脂肪含量[9-11]、改善胰岛素敏感性[6,12]以及久坐老年人的心血管功能和代谢能力[4]。HIIT能激活骨骼肌细胞自噬[13],抵抗增龄大鼠肌肉质量丢失;影响骨骼肌超氧化物歧化酶2(superoxide dismutase2,SOD2)活性水平,防止骨骼肌氧化损伤[14];促进衰老小鼠腓肠肌蛋白质合成,引起肌力增长[15]。
5'单磷酸腺苷激活蛋白激酶(adenosine 5'-monophosphate-activated protein kinase,AMPK)是细胞内能量变化的感受器[16],可通过启动脂肪酸氧化和糖酵解等分解代谢途径来增加ATP(adenosine triphosphate,三磷酸腺苷)的产生,同时亦可以降低脂肪酸和蛋白合成来减少ATP的消耗,其激活程度与运动强度和时间成正相关,且受运动强度的影响较大[17]。骨骼肌中AMPK的活化能促进葡萄糖的摄取和脂肪酸的氧化[18]。过氧化物酶体增殖受体γ辅助激活因子α(peroxisome proliferators-activated receptor γ co-activator 1 alpha,PGC-1α)作为AMPK的调控因子可通过调节机体适应性产热、糖脂代谢、血糖平衡[19],参与线粒体生物合成,提高线粒体的呼吸与氧化能力[20,21],调节脂肪酸氧化,达到减肥目的。
本研究通过建立肥胖大鼠模型,观察HIIT和有氧运动2种不同运动方式对肥胖大鼠体重、肾周和附睾脂肪重量、脂体比、血脂,以及腓肠肌AMPK/PGC-1α mRNA和蛋白表达的影响,探讨不同方式运动时AMPK/PGC-1α通路在减脂过程中的骨骼肌适应机制。
1 材料与方法
1.1 实验对象、分组与训练安排
出生3 周的离乳雄性SD 大鼠,每笼5只,室温21℃~23℃,湿度40%~60%,自然光照,自由饮食,高脂饲料喂养10周后,验证肥胖模型。肥胖模型验证标准[22]:①高脂饮食组大鼠体重超过普通饮食组20%以上;②高脂饮食组大鼠的Lee's指数显著升高,Lee's指数=体重(g)1/3×1000/体长(cm)。
肥胖模型验证成功后,继续高脂饲料分笼饲养,选取30只肥胖大鼠随机分3 组:安静对照组(OC 组)、有氧运动组(OA 组)、大强度间歇运动组(HIIT 组),每组10只,1周跑台适应性训练。运动前测试VO2max,根据VO2max 确定相应跑速,第4 周结束后调整一次跑速。VO2max 测试采用动物气体代谢分析仪(Oxymax Deluxe System,哥伦布斯,美国)进行;运动方案根据Leandro 等[23]的研究进行改良。高脂饲料喂养,自由饮食。OC 组大鼠不运动;OA 组和HIIT 组均进行0 坡度跑台训练,干预总时间为8 周,5次/周。OA 组每天以60%~70%VO2max 速度运动60 min。HIIT 组先以70% VO2max 速度热身后,再以90% VO2max、50%VO2max 速度交替训练[24],最后以70% VO2max 速度进行恢复;跑速根据VO2max的测试结果确定,运动时间以与OA 组运动距离一致计算。训练期间每周固定时间测量体重。
1.2 取材
最后一次运动后恢复24 h,按0.4 ml/100 g 体重腹腔注射10%水合三氯乙醛溶液麻醉,腹主动脉取血,离心取血清用于检测血脂指标;取肾周和附睾脂肪称重,计算脂体比=(肾周脂肪重量+附睾脂肪重量)/体重*100%;取右侧腓肠肌迅速放入液氮中骤冷后-80℃超低温冰箱保存,待测。
1.3 试剂与仪器
主要试剂:引物(BPI),DEPC(Sigma),氯仿、异丙醇、无水乙醇(上海化学试剂公司),RT 试剂(TAKARA),荧光定量PCR 试剂(TAKARA),SYBR Green I(TAKARA),蛋白裂解液(北京普利莱),BCA蛋白定量试剂盒(Thermo),5XSDS 上样缓冲液(上海生工),PVDF膜(Millipore公司),滤纸(Whatman公司),预染蛋白marker(Fermentas),HRP 二抗(Jackson),内参一抗(GenScript),ECL 化学发光试剂(Perce),TC、TG、HDLC和LDL-C试剂盒。
主要仪器:MULTISKAN MK3 全自动多功能酶标仪(Thermo,USA),FTC2000荧光定量PCR仪(Canada),高速离心机(上海安亭),玻璃匀浆器(宁波新芝DY89-1),分光光度仪(上海欣茂UV-7504),垂直板电泳转移装置(上海天能),电泳仪(北京君意JY300C),多用脱色摇床(苏州捷美SYC-2101)。
1.4 血脂指标测试方法
血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白胆固醇(high density liptein cholesterol,HDL-C)和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)指标采用全自动生化分析仪进行测试,具体操作过程依说明书进行。
1.4.1 RT-PCR检测腓肠肌AMPK和PGC-1α mRNA表达量
引物序列β-actin F:CCCATCTATGAGGGTTACGC,R:TTTAATGTCACGCACGATTTC,产物长度150 bp;AMPK F:CAACCGTTCTATTGCCACTCTG,R:TTAGCATCATAGGAGGGGTCTTC,产物长度147 bp;PGC-1α F:CAAGTATCTGACCACAAACGATG,R:ACTGCGGTTGTGTATGGGAC,产物长度110 bp。
采用SYBR Green I 荧光染料RT-PCR 对腓肠肌AMPK和PGC-1α mRNA 表达量进行检测,主要步骤如下:参照说明书提取RNA,1%琼脂糖凝胶电泳检测结果。反转录过程按试剂盒说明书进行。反转录总反应体系为20 μl,10 μl 2×RT buffer,1 μl 反转录引物(100 pmol/μl),1 μl RT-mix,5 μl 模板(RNA),3 μl DEPC水;混匀后25℃10 min,加入反转录酶2 μl,42℃50 min,85℃15 min。反应条件:94℃4 min、94℃20 s、60℃20 s、72℃20 s,循环35次、72℃检测。每个样本重复三次取均值,相对表达量=2-△△Ct。
1.4.2 Western Blot 检测腓肠肌AMPK和PGC-1α 蛋白表达
取50 mg 腓肠肌组织液氮研磨,匀浆裂解,4°C 12000 r/min 离心5 min,取上清,用考马斯亮蓝法测定总蛋白含量。采用BCA法测定蛋白浓度。SDS-PAGE电泳,抗体稀释比例见表1。ECL 发光液(Millipore,美国)显影后用Image J软件进行图像灰度值分析。
1.5 统计学分析
所有数据通过SPSS19.0 统计软件进行统计学处理。所有数据符合正态分布,结果用平均值±标准差表示,采用单因素方差分析比较各组均值的差异是否具有统计学意义,以P<0.05 为差异具有统计学意义。
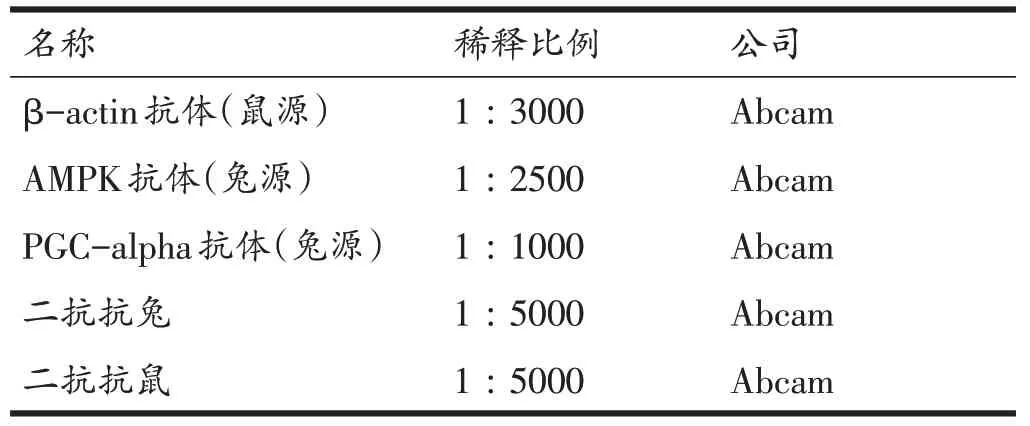
表1 抗体稀释比例及来源
2 结果
2.1 体重及肾周、附睾脂肪重量
2.1.1 训练期间大鼠体重变化情况
由表2可以看出,在8周的训练期间,第1周时,OA组的体重低于OC 组(P<0.05);从第2 周到训练结束,OA组和HIIT组的体重均低于OC组(P<0.01),但OA组与HIIT组之间无显著性差异。
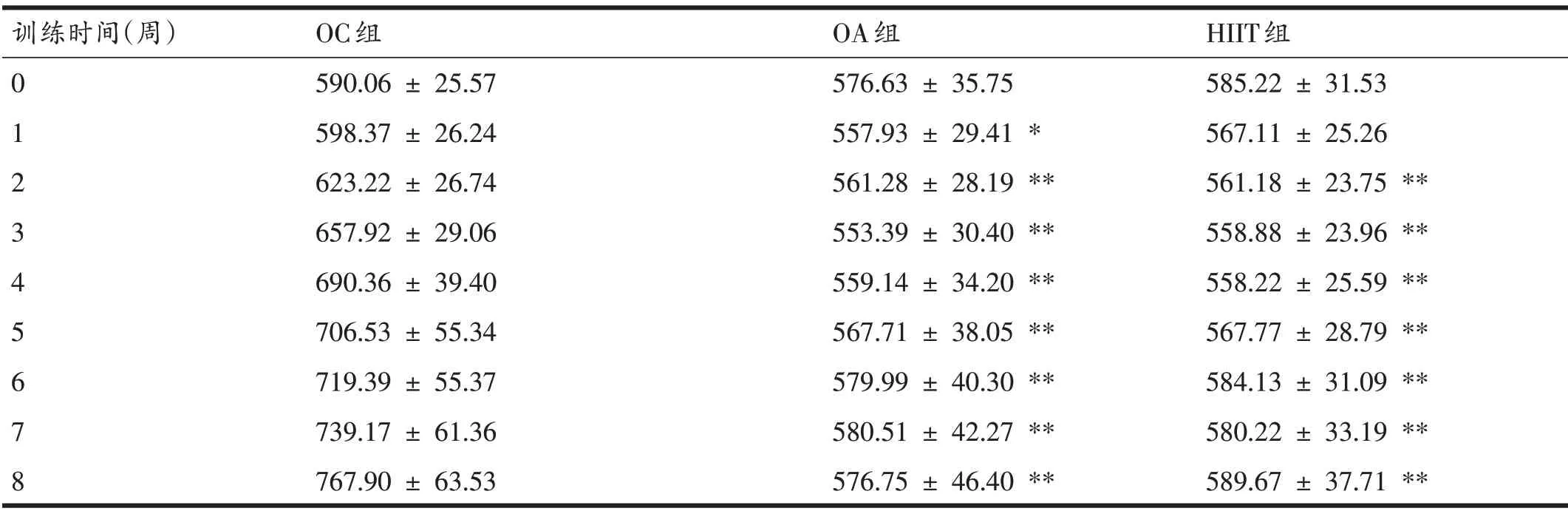
表2 训练期间大鼠体重变化
2.1.2 干预后大鼠肾周、附睾脂肪重量
从图1 可以看出,与OC 组相比,HIIT 组肾周和附睾脂肪重量均下降(P<0.01);OA组肾周和附睾脂肪重量均下降(P<0.05,P<0.01)。HIIT 组肾周和附睾脂肪重量较OA组分别低21.3%和22.4%,但无显著性差异。
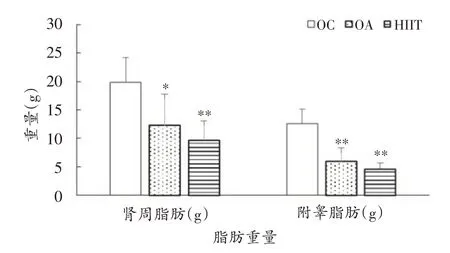
图1 各组大鼠肾周脂肪重量及附睾脂肪重量
从图2 可以看出,OA和HIIT 组的脂体比低于OC组,但只有HIIT组有显著性差异(P<0.05)。OA组脂体比较OC 组低了24.1%,HIIT 组脂体比较OA 组低了22.2%,但均无显著性差异。

图2 各组大鼠脂体比图
2.2 血脂结果
图3 显示,与OC 组相比,HIIT 组TC、TG和LDL-C均降低,有显著性差异(P<0.01,P<0.05,P<0.05);与OC组相比,OA组TC降低,有显著性差异(P<0.01),而TG、LDL-C也有不同程度的下降,但不具显著性差异。HIIT 组TC、TG和LDL-C 虽然较OA 组均下降,但不具显著性差异。三组间HDL-C无显著性差异。

图3 各组大鼠血脂水平
2.3 腓肠肌AMPK和PGC-1α mRNA及蛋白表达情况
2.3.1 腓肠肌AMPK mRNA及蛋白表达情况
图4 显示,与OC 组相比,HIIT 组AMPK mRNA 表达量上调9.6%,有显著性差异(P<0.05);与OA组相比,高出104%,有显著性差异(P<0.01)。而OA 组AMPK mRNA 表达量与OC 组相比出现下调,有显著性差异(P<0.01)。
图5显示,与OC组相比,HIIT组和OA组AMPK 蛋白相对表达量分别上调11%和10%(P<0.05)。HIIT组AMPK 蛋白相对表达量与OA组无显著性差异。
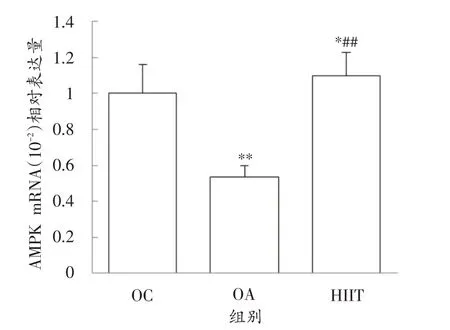
图4 各组AMPK mRNA表达
2.3.2 腓肠肌PGC-1α mRNA及蛋白表达情况
由图6 可以看出,与OC 组相比,HIIT 组和OA 组PGC-1α mRNA 表达量分别上调520%和860%,有显著性差异(P<0.01)。与OA 组相比,HIIT 组PGC-1α mRNA下调35.4%,有显著性差异(P<0.01)。
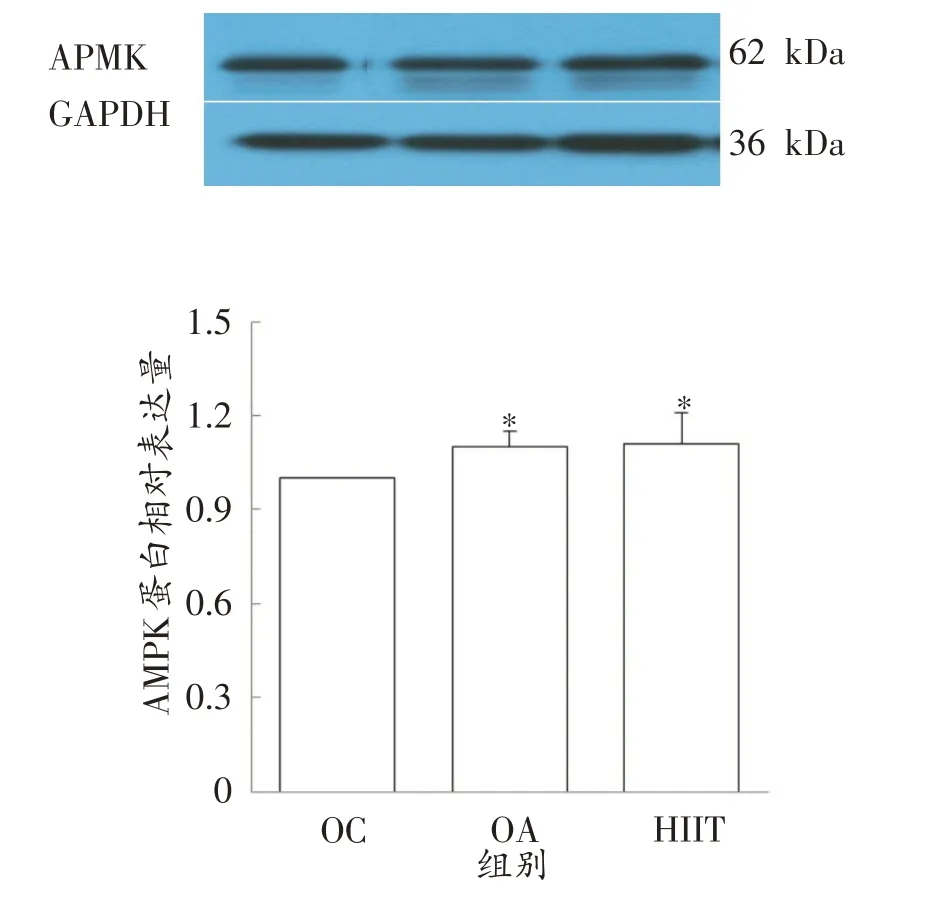
图5 各组AMPK蛋白表达
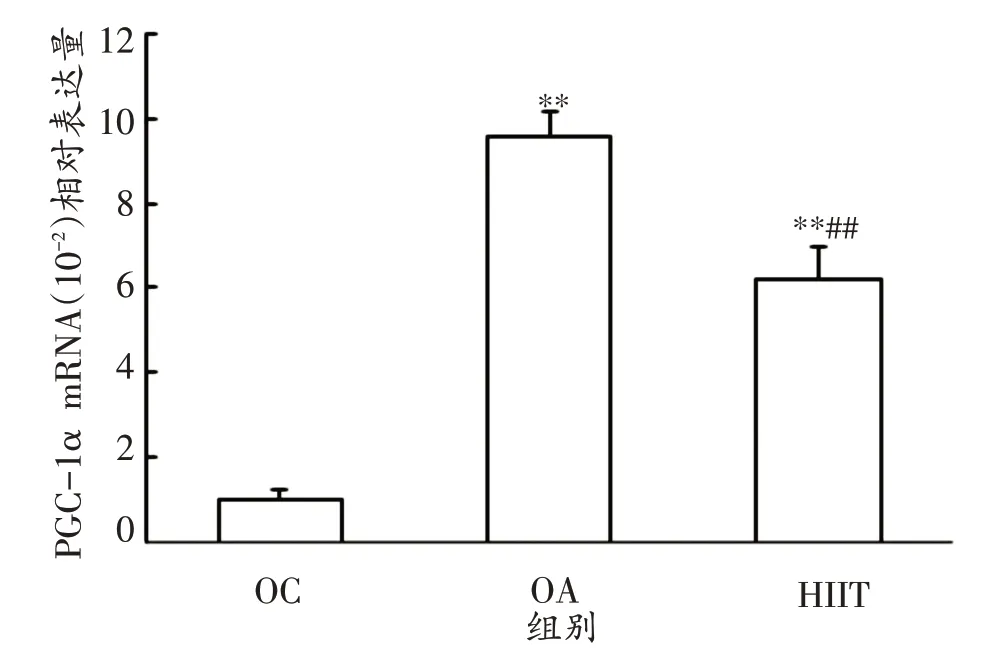
图6 各组PGC-1α mRNA表达
由图7 可以看出,与OC 组相比,HIIT 组和OA 组PGC-1α蛋白表达量分别上调9%和18%,但无显著性差异;OA组虽然高于HIIT组7%,但无显著性差异。
3 讨论
3.1 HIIT对体重、肾周及附睾脂肪重量的影响
研究表明,单纯有氧运动干预可以减轻体重[25,26],且男性下降幅度大于女性[27]。本研究中,8周有氧运动干预期间,OA组大鼠体重基本稳定,而OC组体重以每周大约20 g 左右的速度增长,且干预后肾周脂肪和附睾脂肪重量分别低于OC 组38.0%和53.3%,说明有氧运动对抑制体重增长有明显作用。
长期有氧运动具有不错的减肥效果,但是在日常实施过程中难在坚持。已有研究证明,在受试者身体条件允许的前提下,大强度间歇运动能达到更好的减肥效果[9,28]。对于减脂肪来说,运动中和运动后总能量消耗比单纯运动中的能量消耗更重要。本研究中,8周运动干预后,HIIT组体重与干预前相比变化很小,肾周和附睾脂肪均显著低于OC 组,且脂体比相对OC 组有显著性差异,这表明HIIT 具有良好的降低体重的效果。一般认为HIIT 以肌糖原供能为主,但有研究证明HIIT干预过程中主要以有氧氧化供能为主[6,9]。在HIIT干预后观察到生长激素、甲状腺素分泌增加[29],导致机体静息代谢率提高,引起脂肪消耗增加。另外,HIIT使瘦体重增加[30,31],而肌肉质量增加能提高基础代谢水平,进而使得脂肪消耗增多。
比较HIIT和OA 组体重、肾周和附睾脂肪重量变化可以发现,虽然HIIT组体重略高于OA组,但HIIT组肾周和附睾脂肪重量以及脂体比均低于OA组,这说明HIIT组在降低体脂的同时能有效提高瘦体重,提示HIIT在减少肾周和附睾脂肪方面较有氧运动效果好。究其原因可能是,HIIT由于强度较高,对机体产生的刺激程度要大于有氧运动,增加了运动中的能量消耗;而且有研究显示,HIIT 干预后,脂肪氧化率显著提高[32],使得HIIT运动过程中和运动后恢复期的总消耗量大于单纯有氧运动,因此导致HIIT 组肾周和附睾脂肪重量低于OA组。运动在引起脂肪下降的同时促进肌肉生长,使瘦体重增加[30,31,33]。因此,本研究认为,HIIT和有氧运动均可显著降低肥胖大鼠的体重、肾周和附睾脂肪重量,且HIIT 降低肾周和附睾脂肪重量以及改善瘦体重的效果优于有氧运动。
3.2 HIIT对血脂的影响
研究已经证实,运动对改善肥胖机体的脂代谢紊乱有较好的效果[2,19]。运动对TC、HDL-C、LDL-C的影响与运动方式、运动时间以及运动者自身的健康状态有关,长时间中、小强度有氧运动会引起TC和LDL-C的降低[34],而对HDL-C的影响结论不一致。有研究发现,有氧运动2个小时以上或能量消耗超过900 kcal时,HDL-C才会出现显著下降,认为运动时间和运动强度是影响HDL-C 水平的主要因素[35];大部分的研究认为有氧运动可以提高HDL-C[2,19]。本研究中,OA 组的TC低于OC组;与OC组相比,OA组HDL-C无显著性差异,可能与运动时间有关;与OC 组相比,OA 组LDL-C虽然无显著性差异,但降低了15%。HIIT 组的TC和LDL-C均显著低于OC组,HDL-C与OC组相比无显著性差异。HIIT组的TC、LDL-C均低于OA组,但两组之间无显著性差异。
本研究中,OA 组TG 与OC 组之间无显著性差异;HIIT 组TG 显著低于OC 组(P<0.05)。已有研究证明,耐力训练可以显著提高长跑运动员的血浆脂蛋白脂肪酶活性,提高TG 清除率;中低强度的耐力运动有利于血浆TG的降低和肝脏TG的转运。而HIIT 对TG的影响尚未有统一结论,有研究认为HIIT 可以显著降低TG[2,34],也有研究证明HIIT 对TG 不会产生明显影响[19]。本研究认为HIIT和有氧运动均能通过降低肥胖大鼠血清TC、TG和LDL-C 水平,改善血脂状况,且HIIT对TG和LDL-C的改善效果优于有氧运动。
3.3 HIIT对AMPK、PGC-1α的影响
3.3.1 HIIT对AMPK的影响
AMPK 是异源三聚体蛋白,包括催化亚基α1、α 2,支架亚基β1、β2,以及核苷酸结合亚基γ1、γ2、γ3[36]。AMPK是细胞的能量变化感受器[16,36],可通过启动脂肪酸氧化和糖酵解等分解代谢途径来增加ATP的产生,同时又可以关闭脂肪酸和蛋白合成等合成代谢途径来减少ATP的消耗。运动时AMP/ATP 发生变化,进而激活AMPK。梁春瑜等[7]在观察HIIT 运动对AMPK 影响时发现,第2 周时HIIT 组的AMPK 蛋白表达量显著高于安静对照组和中等强度运动组;而第4周、6周、10周时其表达水平无显著性差异。本研究中8 周干预后,HIIT 组AMPK mRNA的表达量显著高于OC 组和OA组,而OA组表达量显著低于OC组和HIIT组。有研究显示,以雄性SD 大鼠为研究对象,与安静组相比,AMPK 活性在小强度运动时不变,中到大强度运动时分别增加50%和180%,表明AMPK的激活程度与运动强度成正相关[17]。OA 组的表达量为什么会低于OC组?可能是长时间的低强度运动干预,机体的适应性改变导致其表达量降低[7,37]。
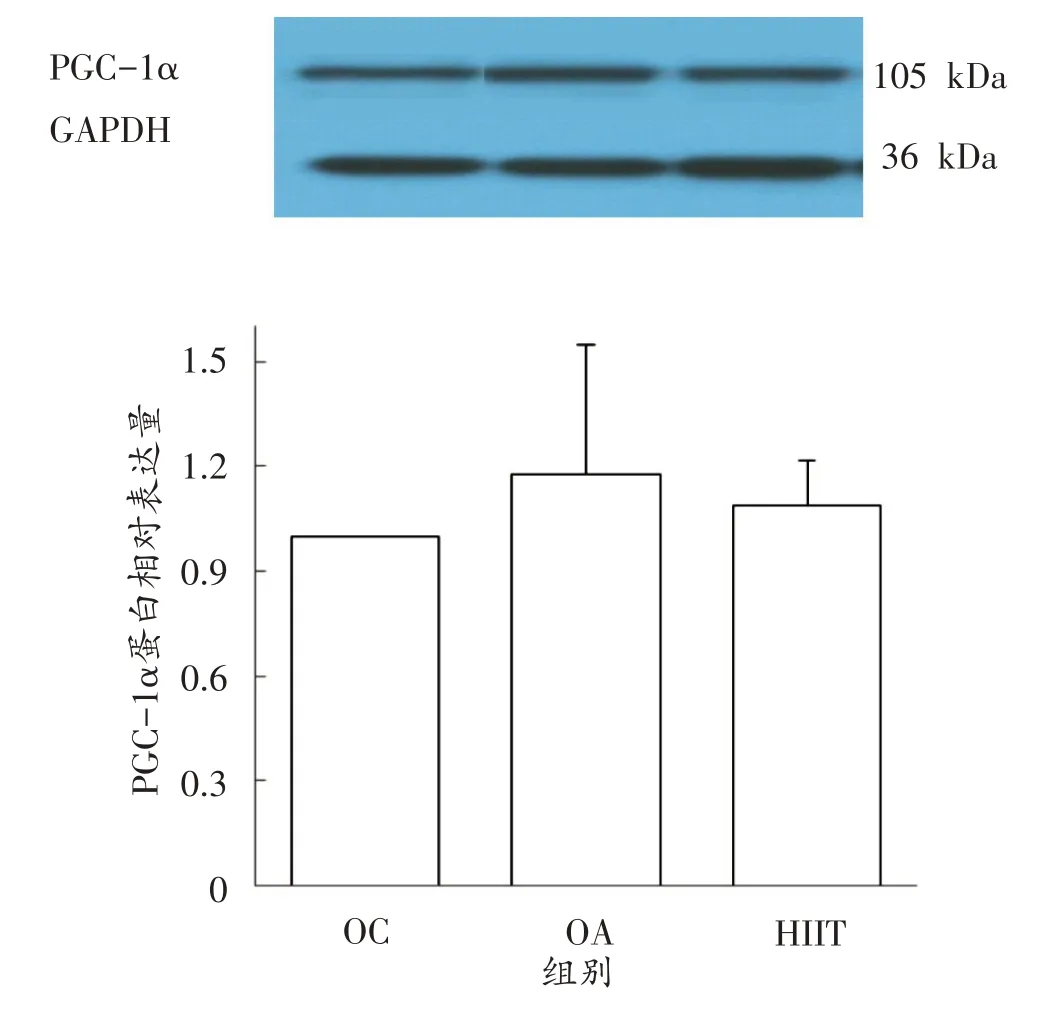
图7 各组PGC-1α蛋白表达
从AMPK蛋白表达量的结果来看,HIIT组和OA组分别高于OC 组11%和10%。这与AMPK mRNA的表达并不一致,OA 组AMPK mRNA 表达量显著低于OC组,而OA 组蛋白表达则显著高于OC 组,但HIIT的AMPK mRNA和蛋白表达基本一致。从结果可以看出,8周的HIIT能显著提高大鼠骨骼肌AMPK的mRNA和蛋白表达量。有氧运动后大鼠腓肠肌AMPK mRNA表达水平显著性下降,但AMPK 蛋白表达量有显著升高,结合本研究运动干预方案分析,可能是有氧运动适应后随着AMPK 蛋白表达量的升高,引起AMPK mRNA表达水平适应性下调。
3.3.2 HIIT对PGC-1α的影响
脂肪是安静状态和运动过程中重要的供能物质,长链脂肪酸需在线粒体内经β氧化才能被分解,而长链脂肪酸不能直接进入线粒体,需在肌细胞浆内活化为脂酰CoA 后才能通过载体运输,跨过线粒体膜进而被分解。肉毒碱棕榈酰转移酶1(CPT-1)和中链酰基辅酶A脱氢酶(MCAD)是脂酰CoA进入线粒体的重要酶,在脂肪酸氧化中起着重要作用。解偶联蛋白3(UCP3)可通过氧化磷酸化促进ATP 合成,促进脂肪酸β氧化,其表达增加表明骨骼肌脂肪酸氧化增强[21],而PGC-1α可以上调UCP3 在骨骼肌的表达来提高骨骼肌中脂肪酸的氧化速率[38]。已有研究证明,PGC-1α能够调节机体适应性产热、糖脂代谢和血糖平衡[19],参与线粒体生物合成,提高线粒体的呼吸与氧化能力[20,21],通过调节CPT-1、UCP3和MCAD[39]功能进而影响脂肪的氧化。因此,PGC- 1α被认为是影响肥胖的一个重要因素。
研究证实,急性和长期运动均能增加骨骼肌PGC-1α的表达[40-42],本研究中,HIIT 组和OA 组PGC-1α mRNA 表达量都显著高于OC 组,这与之前的研究一致。还有研究发现,不同强度的一次性跑台运动后,大鼠骨骼肌PGC-1α mRNA表达量与运动强度成正相关[43],但本研究中OA 组却显著高于HIIT 组(P<0.01),这可能与运动强度、运动干预时间以及实验对象为肥胖大鼠有关。HIIT 组和OA 组PGC-1α蛋白表达量分别高于OC组9%和18%,但无显著性差异,且两者之间亦无显著性差异。这与之前的研究结果基本一致,但本研究中HIIT组PGC-1α蛋白表达低于OA组,其原因可能是在HIIT干预后,PGC-1α的蛋白表达会有一个先上升后下降再小幅上升的趋势,8周的训练时间可能正处于其表达的下降期,有研究证明10 周HIIT 对PGC-1α的蛋白表达有显著促进作用[7]。
3.3.3 HIIT对AMPK-PGC-1α通路的影响
环境、能量、Ca2+浓度以及激素的变化均可以引起PGC-1α蛋白表达量的变化,但运动引起的PGC-1α蛋白表达量的变化主要与AMPK参与的能量变化过程有关[41,44]。有研究表明,有氧耐力运动[40]和HIIT[7,45]均可引起PGC-1α表达量的增加,AMPK的激活能诱导PGC-1α 表达的增 加,以 上 研 究 显 示PGC-1α 是AMPK的下游靶点之一。PGC-1α一方面可以直接对骨骼肌脂代谢进行调控,另一方面也可以通过促进线粒体生物合成加快脂肪酸的氧化来达到减肥的目的。
本研究结果显示,有氧运动后肥胖大鼠腓肠肌AMPK mRNA 表达水平显著性下降,但AMPK 蛋白表达量有显著升高;而PGC-1α mRNA和蛋白表达均有所升高。结合本研究运动干预方案分析,有氧运动适应后随着AMPK 蛋白表达量的升高,AMPK mRNA 表达水平适应性下调,而PGC-1α mRNA 则随着AMPK蛋白的调节呈现表达上调趋势,这提示有氧运动可能通过调节AMPK-PGC-1α通路,改善脂代谢。
HIIT可以显著提高肥胖大鼠腓肠肌AMPK mRNA和蛋白以及PGC-1α mRNA和蛋白表达量。比较有氧运动发现,HIIT随着运动强度的增加,作用于机体的负荷强度增强,使得肥胖大鼠腓肠肌AMPK mRNA 表达上升,持续高强度运动干预使得AMPK和PGC-1α蛋白表达水平升高,这表明HIIT 作用方式和影响程度有别于有氧运动,提示HIIT 可以通过激活AMPK/PGC-1α通路,加快脂肪酸氧化达到减肥目的。另外,HIIT组和有氧运动组AMPK和PGC-1α蛋白表达量均高于安静对照组,说明运动可以激活AMPK/PGC-1α通路,并且HIIT激活作用大于有氧运动。HIIT组AMPK蛋白表达稍微高于OA 组,而PGC-1α蛋白表达低于OA 组,AMPK和PGC-1α蛋白表达变化趋势不一致,提示AMPK 可能不是诱导PGC-1α表达增加的唯一因素。有研究显示,P38MAPK-ATF-PGC-1α 信号通路在PGC-1α的表达中有重要作用,Ca2+和CaMKⅡ也是影响PGC-1α表达的重要因子[46]。
4 结论
(1)8 周HIIT和有氧运动均能显著减少肥胖大鼠的体重、肾周和附睾脂肪重量、脂体比,降低血清TC、TG和LDLC水平,改善血脂情况,且HIIT效果优于有氧运动。
(2)HIIT和有氧运动两种运动方式均能通过影响AMPK/PGC- 1α通路调节机体脂代谢,但两种作用产生的机制可能存在差异,且HIIT效果更明显。

