MCU在高糖诱导心肌H9c2细胞凋亡中的作用机制*
郑文学, 荆 哲, 郭文昀, 张 涛, 陈 霞, 吴兆琦, 崔恒强, 杨红宁, 张玉秀, 惠 玲, 陈永清△
(中国人民解放军联勤保障部队第九四〇医院 1心血管内科, 2医学实验科, 甘肃 兰州 730000)
糖尿病高血糖可导致心血管系统多种病理性改变,但有关高血糖对心肌细胞凋亡作用的机制研究仍然有限。近年来有研究发现线粒体钙离子单向转运体(mitochondrial calcium uniporter, MCU)通过依靠线粒体膜电位(mitochondrial membrane potential, Δψm)高选择性地摄取Ca2+调节线粒体内游离钙离子浓度(mitochondrial free Ca2+concentration, [Ca2+]m)稳态[1-2]。[Ca2+]m可以作用于线粒体三羧酸循环中丙酮酸脱氢酶(pyruvate dehydrogenase, PDH)进而影响线粒体能量代谢及功能[3-4],而线粒体功能障碍和线粒体氧化应激增强引起心肌细胞凋亡是糖尿病心肌病发病的主要病理生理机制[5-7]。精胺(spermine, Sp)是MCU的激动剂,可能通过变构激活作用增加MCU对Ca2+的跨膜转运[8-11],在心肌细胞中精胺可通过激动MCU增加Ca2+向线粒体内转运[12-13]。有研究表明高糖(high glucose,HG)培养的心肌细胞[Ca2+]m降低[14-15],但是关于高糖培养的心肌细胞中MCU表达变化及[Ca2+]m稳态与心肌细胞凋亡之间的具体机制尚不清楚。
本研究采用高糖培养的大鼠心肌H9c2细胞模拟糖尿病高糖对心肌细胞损伤的病理过程,探讨高糖通过降低MCU表达导致的活性下降促进心肌H9c2细胞凋亡的机制,以期为糖尿病心肌病的防治研究提供理论依据。
材 料 和 方 法
1 细胞
心肌H9c2细胞购自中国科学院典型培养物保藏委员会细胞库。
2 主要试剂
DMEM细胞培养基和胰蛋白酶(HyClone);胎牛血清(杭州四季青生物工程材料有限公司);精胺、RIPA细胞裂解液、BCA蛋白含量测定试剂、PMSF、Ⅰ抗、ATP检测试剂盒、JC-1检测试剂盒、活性氧簇(reactive oxygen species, ROS)检测试剂盒、β-actin抗体和Ⅱ抗(上海碧云天生物技术有限公司);Rhod-2 AM、MCU、caspase-9和caspase-3抗体(Abcam);PDH活性检测试剂盒(上海索宝生物科技有限公司);TRIzol、引物合成、反转录试剂盒和荧光定量PCR检测试剂盒(TaKaRa)。
3 主要方法
3.1细胞分组 细胞随机分为3组:正常对照(control)组(5.5 mmol/L葡萄糖+19.5 mmol/L甘露醇处理细胞)、HG组(25 mmol/L 葡萄糖处理细胞)和HG+Sp组(25 mmol/L葡萄糖+5 μmol/L精胺处理细胞)。各组细胞均在处理后于37 ℃、5% CO2细胞培养箱培养72 h。
3.2Western blot检测细胞蛋白表达 RIPA裂解细胞,BCA法测定蛋白浓度并将其调整一致。各蛋白样本取20 μg进行12%SDS-PAGE,然后转至PVDF膜,5%脱脂牛奶室温封闭1 h,分别用MCU(1∶500)、caspase-9(1∶500)、caspase-3(1∶500)和β-actin(1∶500)Ⅰ抗4 ℃孵育过夜。洗膜后,用辣根过氧化物酶标记的山羊抗兔IgGⅡ抗(1∶3 000)室温孵育膜1 h。洗膜后,超敏ECL化学发光法显色。采用目的蛋白与内参照β-actin灰度值的比值反映蛋白的表达水平。
3.3RT-qPCR 检测mRNA表达 TRIzol法提取细胞总RNA并反转录为cDNA后进行qPCR。MCU的上游引物序列为5’-GAGACTGAGAGACCCGCTACA-3’,下游引物序列为5’-AAGGCGTGAGTTACAAACAGG-3’;β-actin的上游引物序列为5’-AGCCATGTACGTAGCCATCCA-3’,下游引物序列为5’-TCTCCGGAGTCCATCACAATG-3’。反应条件为:94 ℃ 3 min; 94 ℃ 30 s,60 ℃ 45 s,72 ℃ 45 s,40个循环;72 ℃ 5 min,转为4 ℃保存。反应在Rotor-Gene 300 Real-time PCR仪上进行;用Rotor-Gene 6.1 software分析数据。
3.4线粒体Ca2+浓度检测 Rhod-2 AM工作液(2 μmol/L)覆盖细胞,37 ℃细胞培养箱中孵育60 min,洗涤后,HBSS 溶液覆盖细胞,37 ℃培养箱中孵育约30 min,荧光显微镜检测细胞(激发波长545 nm),荧光强度代表线粒体内Ca2+浓度。
3.5PDH活性检测 按照PDH活性检测试剂盒说明书进行操作,每200万细胞加入400 μL提取液,超声波破碎细胞(功率200 W,工作3 s,间歇10 s,工作35次),12 000×g、 4 ℃离心30 min,取上清。PDH催化丙酮酸脱羧生成乙醛,添加乙醇脱氢酶进一步催化NADH还原乙醛生成乙醇和NAD+,NADH在340 nm有吸收峰,通过测定340 nm光吸收下降速率,来计算PDH活性。
3.6ATP浓度的检测 按照ATP检测试剂盒说明书进行操作,6孔板每孔加入200 μL裂解液完全裂解细胞,12 000×g、4 ℃离心5 min,取上清。当萤光素酶和萤光素过量时,在一定范围内荧光产生和ATP浓度成正比,根据标准曲线计算样品中ATP浓度。
3.7线粒体膜电位的检测 用PBS洗涤6孔板中的细胞1次,每孔分别加入1 mL细胞培养液和1 mL JC-1染色工作液,充分混匀。37 ℃细胞培养箱中孵育20 min。弃上清,用1×染色缓冲液洗涤2次,加入2 mL细胞培养液,荧光显微镜下观察。当Δψm较高时,JC-1荧光探针聚集在线粒体的基质中形成聚合物(aggregates),可以产生红色荧光;当Δψm处于较低水平时,JC-1不能聚集在线粒体的基质中,JC-1单体(monomers)产生绿色荧光。用红绿荧光相对比例的增减来反映Δψm的变化。
3.8活性氧簇检测 MitoSOXTM染色法检测心肌细胞线粒体ROS水平。按照1∶1 000用HBSS/ Ca2+/Mg2+稀释MitoSOXTM,终浓度为5 μmol/L工作液。6孔板1孔中加入500 μL工作液,充分覆盖细胞,另一个孔中加500 μL HBSS/Ca2+/Mg2+作为阴性对照,37 ℃避光孵育10 min。去除MitoSOXTM工作液,使用温HBSS/Ca2+/Mg2+轻微清洗3遍。使用激光共聚焦显微镜观察并拍照,用红色荧光强度的相对比例来反映ROS水平。
4 统计学处理
数据采用SPSS 19.0软件进行统计分析,用均数±标准差(mean±SD)表示各组数据,两组之间的比较采用非配对t检验,多组之间的比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 高糖培养的心肌H9c2细胞中MCU表达降低
Western blot结果显示,与对照组比较,HG组和HG+Sp组H9c2细胞中MCU蛋白表达降低(P<0.05),见图1A; RT-qPCR 检测检测结果显示,与对照组比较,HG组及HG+Sp组MCU 的mRNA表达减低(P<0.05),见图1B。
2 激活MCU改善高糖诱导的线粒体钙稳态失衡和代谢
Rhod-2 AM探针检测[Ca2+]m结果显示,HG组[Ca2+]m较对照组明显降低(P<0.05);与HG组相比,HG+Sp组[Ca2+]m升高(P<0.05),见图2。PDH活性检测结果显示,HG组H9c2细胞中PDH的活性显著低于对照组(P<0.05);与HG组相比,HG+SP组的H9c2细胞中PDH活性则显著升高(P<0.05),见图3A。ATP检测试剂盒检测结果显示,HG组H9c2细胞的ATP浓度显著低于对照组(P<0.05);与HG组的相比,HG+SP组的ATP浓度显著增加(P<0.05),见图3B。
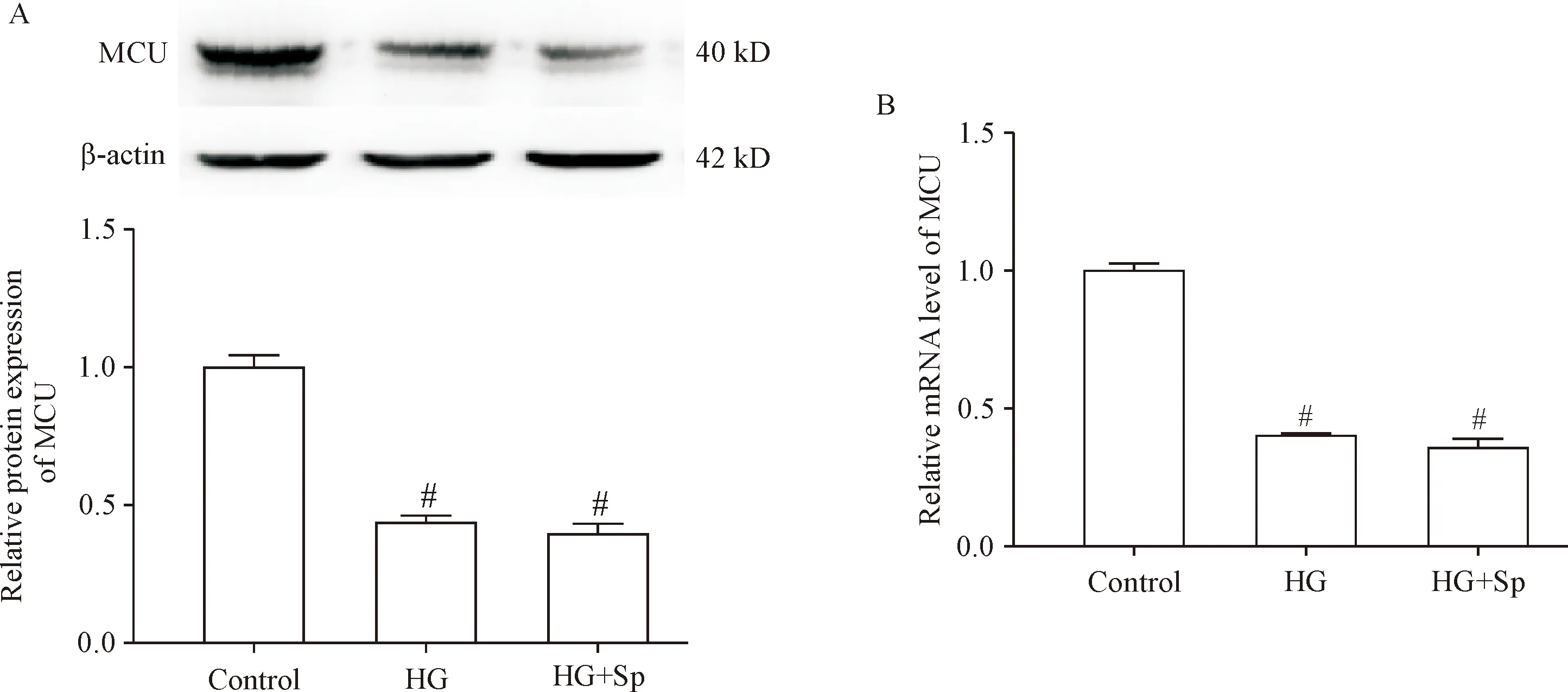
Figure 1.Comparisons of the protein (A) and mRNA (B) expression of MCU among control group, HG group, and HG+Sp group. Mean±SD.n=6.#P<0.05vscontrol group.
图1 各组心肌细胞中MCU蛋白及mRNA表达比较

Figure 2.Comparisons of [Ca2+]mamong control group, HG group, and HG+Sp group. Mean±SD.n=8.#P<0.05vscontrol group;*P<0.05vsHG group.
图2 各组H9c2细胞线粒体中[Ca2+]m的比较
3 激活MCU减低高糖诱导的线粒体功能损伤
JC-1活性检测结果显示,HG组H9c2细胞的Δψm显著低于对照组,JC-1 monomers/aggregates比值升高(P<0.05);与HG组相比,HG+Sp组的Δψm则显著增加,JC-1 monomers/aggregates比值降低(P<0.05),见图4。MitoSOXTM染色法检测心肌细胞线粒体的ROS水平,结果显示HG组的ROS水平显著高于对照组(P<0.05);与HG组相比,HG+Sp组的ROS水平则显著减低(P<0.05),见图5。
4 激活MCU减低高糖诱导的线粒体内源性细胞凋亡
Western blot结果显示,与对照组相比,HG组H9c2细胞中caspase-9和caspase-3蛋白表达显著增加(P<0.05);与HG组相比,HG+Sp组的H9c2细胞中caspase-9和caspase-3蛋白表达显著减少(P<0.05),见图6。
讨 论
目前有关高血糖引起心肌细胞凋亡的作用机制还未明确。我们采用高糖条件下培养的大鼠心肌H9c2细胞模拟糖尿病高糖对心肌细胞损伤的病理过程。
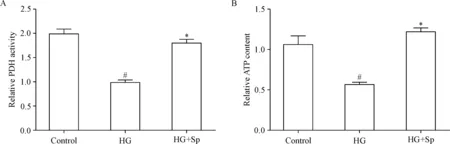
Figure 3.Comparisons of pyruvate dehydrogenase (PDH) activity (A) and ATP content (B) among control group, HG group, and HG+Sp group. Mean±SD.n=8.#P<0.05vscontrol group;*P<0.05vsHG group.
图3 各组心肌细胞中PDH活性和ATP浓度比较

Figure 4.Comparisons of mitochondrial membrane potential among control group, HG group, and HG+Sp group. Mean±SD.n=8.#P<0.05vscontrol group;*P<0.05vsHG group.
图4 各组H9c2细胞Δψm水平的比较
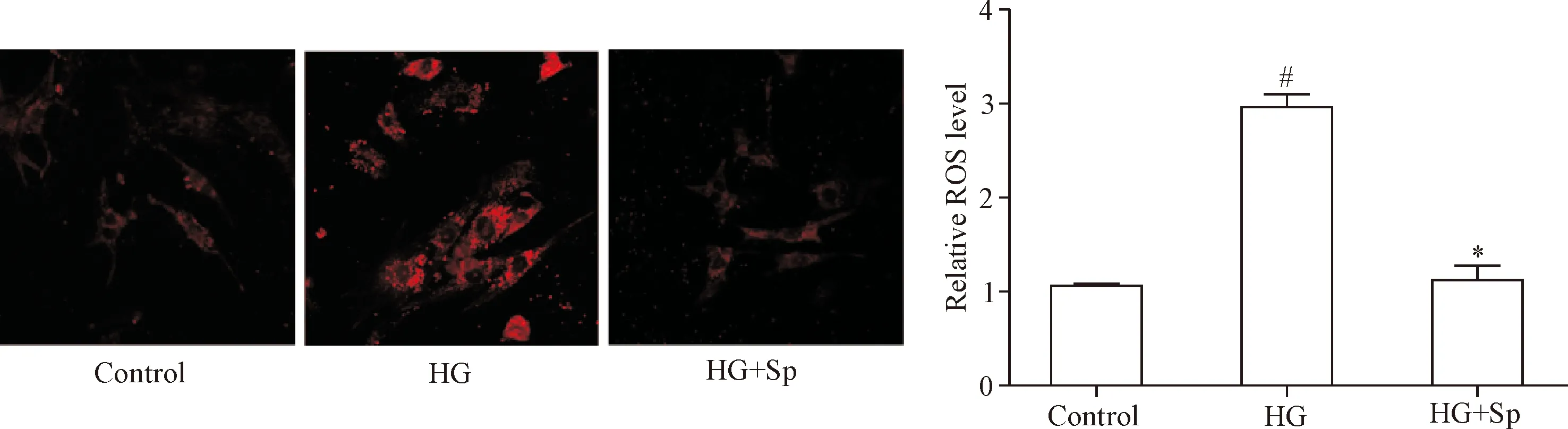
Figure 5.Comparisons of mitochondrial ROS levels among control group, HG group, and HG+Sp group. Mean±SD.n=8.#P<0.05vscontrol group;*P<0.05vsHG group.
图5 各组H9c2细胞线粒体ROS水平的比较

Figure 6.Comparisons of caspase-3 and caspase-9 protein levels among control group, HG group, and HG+Sp group. Mean±SD.n=6.#P<0.05vscontrol group;*P<0.05vsHG group.
图6 各组H9c2细胞中caspase-3和caspase-9表达的比较
线粒体Ca2+摄取主要通过线粒体Ca2+单向转运蛋白复合物(mitochondrial Ca2+uniporter complex, MCUC)实现,蛋白质MCU组成该复合物Ca2+跨膜转运的孔道[1-2]。MCU通过依靠Δψm高选择性地摄取Ca2+来调节[Ca2+]m稳态[1-2]。我们的研究表明高糖通过MCU表达降低导致的活性下降使[Ca2+]m减低,这与前期研究结果一致[16-17]。但是高糖通过MCU表达降低导致的活性下降使[Ca2+]m降低与高糖促使心肌细胞凋亡之间的机制还不清楚。
我们的研究结果显示MCU表达降低导致的活性下降,促使线粒体PDH活性、细胞ATP浓度和Δψm降低,而线粒体ROS水平升高。精胺没有影响MCU蛋白和基因的表达,精胺可能通过变构激活作用增加MCU对Ca2+的跨膜转运[8-11]。同样,心肌细胞中精胺可激动MCU增加线粒体[Ca2+]m[12-13]。[Ca2+]m可以激活线粒体基质中的几种三羧酸循环中脱氢酶(包括PDH),从而调节线粒体能量代谢及功能[3-4]。线粒体功能障碍和线粒体氧化应激增强引起心肌细胞凋亡是糖尿病心肌病发病的主要病理机制[5-7]。在高糖培养的心肌细胞中加入精胺后,我们观察到线粒体[Ca2+]m、线粒体PDH活性、细胞ATP浓度和Δψm都显著升高,而ROS水平降低,caspase-9和caspase-3凋亡蛋白表达减少。因此,我们的研究结果表明在高糖培养的H9c2细胞中恢复线粒体[Ca2+]m对依赖Ca2+的线粒体功能产生正向影响。恢复高糖培养的的H9c2细胞中[Ca2+]m稳态使线粒体PDH活性增加,细胞ATP浓度增加,线粒体膜电位升高,而ROS水平降低,可能是我们观察到H9c2细胞凋亡减少的原因。
综上所述,高糖通过降低MCU表达导致其活性下降可促进心肌H9c2细胞凋亡,其机制可能与线粒体的钙离子稳态失衡、三羧酸循环障碍和线粒体功能损伤有关。

