贝利司他抑制骨肉瘤细胞活力的分子机制*
彭 斌, 何 敏, 李正茂, 符 勇, 谭文甫
(南华大学附属第二医院创伤骨科, 湖南 衡阳 421002)
骨肉瘤是运动系统常见的原发性恶性骨肿瘤,好发于青少年。骨肉瘤恶性程度高,早期即可发生转移,即便对于非转移性骨肉瘤患者,其5年生存率也仅为60%~70%[1-2]。辅助化疗也不能有效提高生存率[3]。因此仍需开发新的治疗药物来改善骨肉瘤的预后[4]。
组蛋白乙酰化是转录调控的重要机制,它主要通过改变染色质的结构而发挥转录调控作用。组蛋白的乙酰化受组蛋白乙酰转移酶(histone acetyl transferases,HATs)和组蛋白脱乙酰酶(histone deacetylases, HDACs)的调节[5]。HAT催化乙酰基转移到组蛋白的N端赖氨酸残基,导致染色质构象疏松而利于靶基因的转录,而HDAC恰好相反[6]。某些抑癌基因若发生HDAC复合物的异常募集,则可引起其表达异常而参与肿瘤的发生,因此,HATs和HDACs是肿瘤治疗的重要靶标,其相关药物在骨肉瘤中的疗效也得到了证实[7-8]。
贝利司他(Belinostat)是Topotarget和Spectrum公司联合开发的一种羟肟酸类HDAC抑制剂(histone deacetylase inhibitor,HDACi),化学结构上和伏立诺他以及帕比司他属同类化合物[9]。贝利司他的药理学作用和罗米地辛以及普拉曲沙接近,其治疗外周T细胞淋巴瘤的客观应答率(objective response rate, ORR)约为20%[10]。但贝利司他的安全性相对较高,更适合联合用药。贝利司他在治疗外周T细胞淋巴瘤、皮肤T细胞淋巴瘤、肝癌和胸腺癌等方面具有较好的疗效[11]。但目前尚未有关于贝利司他在骨肉瘤细胞增殖方面的研究。本项工作旨在探讨贝利司他在骨肉瘤细胞生长增殖中的影响,并观察其对多柔比星(doxorubicin; 又称阿霉素)是否具有协同效应,初步探讨其作用机制。
材 料 和 方 法
1 主要试剂
贝利司他购自Selleck;磷酸化Akt(Ser473)及Akt、糖原合成酶激酶(glycogen synthetase kinase 3β, GSK-3β)、caspase-3、 Bcl-xL及PTEN抗体购自Cell Signaling;乙酰化组蛋白H3和H4 (Lys5/8/12/16) 多克隆抗体购自Millipore;鼠抗人β-actin抗体购自Santa Cruz。
2 方法
2.1细胞培养与活性检测 人骨肉瘤细胞系SAOS-2、SJSA和U2OS购自ATCC。细胞用含有10%胎牛血清、1.0×105U/L青霉素,0.1 mg/L链霉素的RPMI-1640培养基,于37 ℃、5% CO2的恒温培养箱中培养。根据参考文献提供的方法,采用MTT法检测贝利司他对骨肉瘤细胞活力的影响[12]。即,将细胞以每孔约2 500个接种在96孔板中(培养液含10%胎牛血清)。 24 h后,细胞用0.5、1、2.5和5 μmol/L的贝利司他处理48 h。药物处理后,将22 μL 5%的MTT试剂加入到每个孔中,并将细胞在37 ℃温育2~4 h。在酶标仪上(UV Spectromax M2,Molecular Devices)上测定570 nm处的吸光度(A)值,并使用CompuSyn软件计算贝利司他的IC50值。
2.2细胞凋亡检测 按照Roche提供的In Situ Cell Death Detection试剂盒测定凋亡后DNA的片段化水平,即用不同浓度的贝利司他处理细胞48 h后。 获取约100 000个细胞,获取其裂解上清,酶标仪上于490 nm波长下获取其吸光度。
2.3caspase-3/-7活性测定 根据AnaSpec提供的SensolyteTMHomogeneous AMC caspase-3/-7试剂盒测定caspase-3/-7的活性。即接种在6孔板中的细胞(约每孔1×105个)用不同浓度贝利司他处理48 h。 孵育结束后,加入裂解缓冲液至终体积为每孔150 μL,然后将50 μL caspase-3/-7底物试剂加入孔中,并在37 ℃下振荡温育30~60 s。最后在荧光酶标仪上获取吸光值,其中Ex/Em=354 nm/442 nm。
2.4Western blot检测蛋白表达及磷酸化水平 收集药物处理48 h后的细胞,用PBS漂洗后,加入M-PER蛋白提取试剂(Pierce)充分裂解细胞。以9 000 ×g离心15 min后,经SDS-PAGE分离总蛋白,并转移至硝酸纤维素膜上。用含有5%脱脂奶粉的TBST封闭1 h后,将膜与相应的Ⅰ抗4 ℃温育过夜,然后用TBST洗涤3次后,用辣根过氧化物酶标记的Ⅱ抗在室温下孵育1 h。最后通过化学发光(Perkin-Elmer)、显影,并进行灰度扫描。
2.5药物联合分析 使用固定比率法评估不同贝利司他与阿霉素浓度组合对骨肉瘤细胞活力的影响。即,将药物以4∶1的浓度比(贝利司他:阿霉素)组合并进行2倍系列稀释。分别将其与细胞孵育后后,按照2.3中的方法测定细胞活力。根据参考文献提供的方法[13],使用CompuSyn软件分析各药物及其组合的剂量-效应协同效应,并计算联合指数(combination index, CI)值:CI=1,叠加;CI<1,协同作用;CI>1,拮抗作用。同时也计算了剂量减少指数(dose reduction index, DRI),即协同组合中药物的剂量与单独的相同药物的剂量相比降低的程度的量度,以实现给定的效果水平。
3 统计学处理
所有数据重复测量3次,以均数±标准差(mean±SD)表示,采用SPSS 19.0统计软件分析数据。组间比较采用单因素方差分析 (one-way ANOVA)。以P<0.05为差异具有统计学意义。
结 果
1 贝利司他抑制骨肉瘤细胞活力
MTT结果显示,0.5、1、2.5和5 μmol/L贝利司他处理U2OS和SAOS-2细胞48 h后,均可抑制其活力,其IC50值分别为1.136 μmol/L和1.261 μmol/L,见图1。因SJSA细胞需要孵育72 h后才能观察到抑制效果,因此随后的研究中主要选取U2OS和SAOS-2细胞为研究对象。

Figure 1.Effects of Belinostat at different concentrations on the viability of U2OS and SAOS-2 cells.
图1 不同浓度贝利司他对U2OS和SAOS-2细胞活力的影响
2 贝利司他诱导骨肉瘤细胞凋亡
ELISA结果显示,0.5、1和2.5 μmol/L贝利司他能以剂量依赖性方式促进U2OS和SAOS-2细胞DNA片段化,见图2A。 同时,贝利司他也能上调U2OS和SAOS-2细胞caspase-3/-7酶的活性(P<0.05),见图2B。此外,Western blot显示贝利司他处理后,细胞中cleaved caspase-3含量增多,Bcl-xL的含量减少(P<0.05),见图2C。
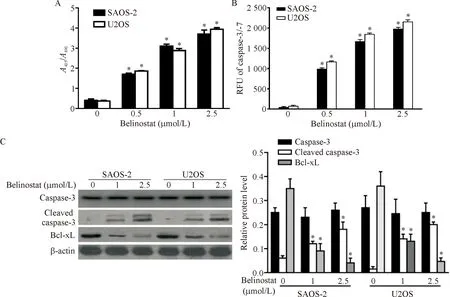
Figure 2.Effect of different concentration of Belinostat on DNA fragmentation (A), caspase-3/-7 activity (B), and cleaved caspase-3 and Bcl-xL expression (C). Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图2 贝利司他诱导U2OS和SAOS-2细胞凋亡
3 贝利司他促进骨肉瘤细胞中组蛋白H3和H4乙酰化
Western blot结果显示,分别采用1和 2.5 μmol/L贝利司他处理SAOS-2和U2OS细胞48 h后,细胞中乙酰化组蛋白H3(acetylated histone H3, AcH3)和AcH4表达水平随着贝利司他浓度的递增而增高(P<0.05),见图3。
4 贝利司他影响AKT通路相关蛋白磷酸化
Western blot结果显示,用1和2.5 μmol/L贝利司他处理48 h后,U2OS和SAOS-2细胞中磷酸化Akt显著减少(P<0.05); Akt的直接底物GSK-3β的磷酸化水平也显著降低(P<0.05);此外,1和2.5 μmol/L贝利司他孵育对U2OS和SAOS-2细胞系中PTEN蛋白表达无显著影响(P<0.05),见图4。

Figure 3.Effect of Belinostat on the acetylation of histones H3 and H4 in U2OS and SAOS-2 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图3 贝利司他对U2OS和SAOS-2细胞中组蛋白H3和H4乙酰化的影响
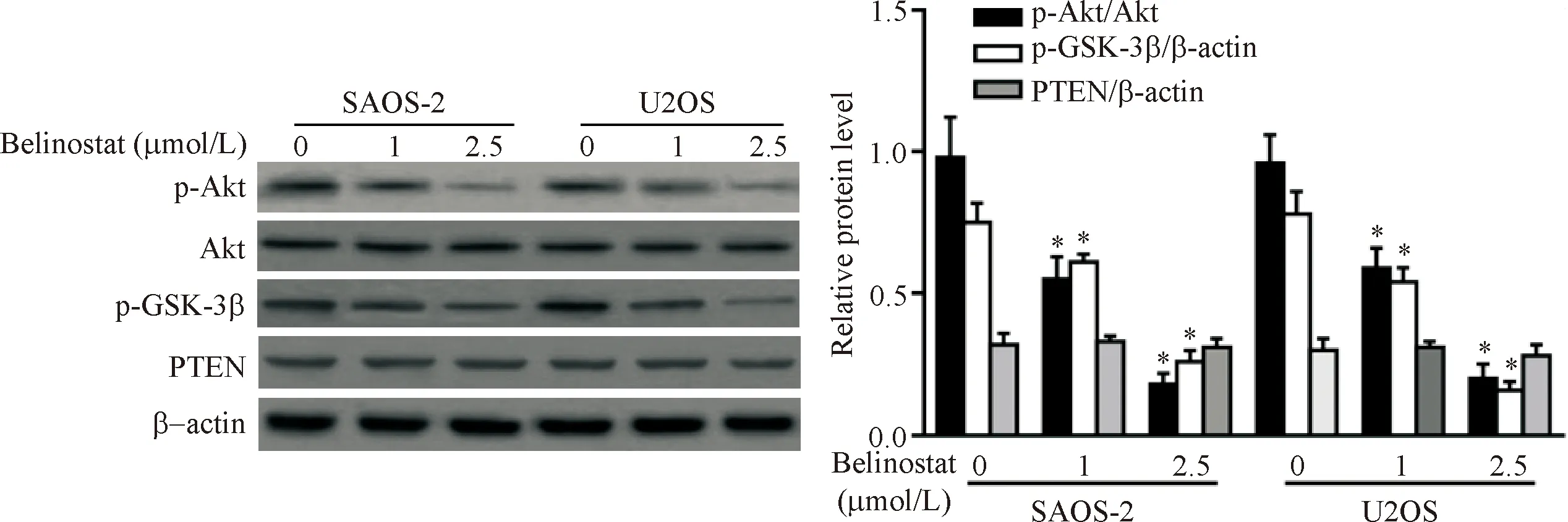
Figure 4.Effect of Belinostat on the expression and phosphorylatin of Akt pathway-related proteins in U2OS and SAOS-2 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图4 贝利司他对U2OS和SAOS-2细胞中Akt通路相关蛋白磷酸化的影响
5 贝利司他增强阿霉素对骨肉瘤细胞的毒性作用
MTT结果显示,贝利司他和阿霉素以固定浓度比组合孵育U2OS和SAOS-2细胞后,随着剂量的增加,细胞活力逐渐降低,见图5。通过CI和DRI的计算显示,由于贝利司他与阿霉素之间的协同作用,其在U2OS细胞中的IC50值可分别降低为原来的41%和19%,在SAOS-2细胞中分别降低为原来的58%和24%,见图5、表1。
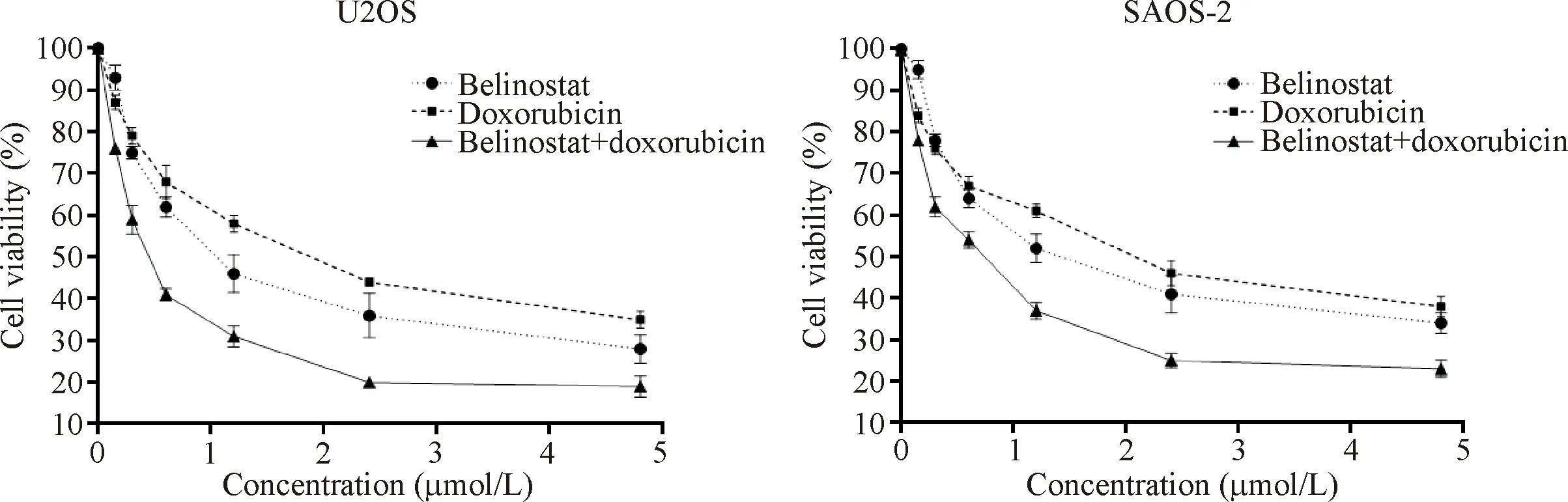
Figure 5.Effect of different concentration of Belinostat on U2OS and SAOS-2 cells viability. Mean±SD.n=3.
图5 不同浓度贝利司他协同阿霉素抑制U2OS和SAOS-2细胞活力
表1 贝利司他与阿霉素处理骨肉瘤细胞的联合指数
Table 1.Combination index (CI) values of Belinostat and doxorubicin at the indicated effective dose (ED) in osteosarcoma cell lines

Cell lineED50ED75ED90ED95U2OS0.720.460.630.85SAOS-20.890.670.140.04
讨 论
DNA甲基化和组蛋白乙酰化是细胞中重要表观遗传机制[14]。HDACi通过促进组蛋白乙酰化来调节染色质的紧密程度,最终影响细胞增殖分化、周期调控、细胞凋亡、迁移和血管生成相关基因的表达[15]。与正常细胞相比,肿瘤细胞对HDACi更敏感[16]。贝利司他是2014年FDA批准上市的一种HDACi,主要用于治疗外周T细胞淋巴瘤。研究表明,贝利司他可抑制多种肿瘤细胞生长,同时不受多重耐药表型的影响,此外贝利司他也可以增强多西他赛或卡铂对卵巢癌细胞增殖的抑制效果[17]。在本研究中,我们研究了贝利司对骨肉瘤细胞生长的影响。MTT结果显示,不同的骨肉瘤细胞系,贝利司他对其生长抑制情况有所不同,在敏感的U2OS和SAOS-2细胞系中,贝利司他可抑制其活力。为了明确贝利司他是否也能影响骨肉瘤细胞的凋亡,随后通过检测细胞DNA片段化和caspase-3/-7的活性以间接证实其促凋亡效应,结果显示,细胞活力降低的同时也伴有凋亡的增加。HDACi的抗肿瘤效应通常是通过增加组蛋白乙酰化从而改变基因转录水平的。因此,我们检测了HDACi处理后骨肉瘤细胞中乙酰化组蛋白的水平,结果显示贝利司他可增加骨肉瘤细胞系中的组蛋白乙酰化,此外,还能抑制Akt的磷酸化,表明贝利司他体外对骨肉瘤细胞具有多效性。
本研究同时也显示,尽管贝利司他诱导组蛋白乙酰化、抑制细胞增殖和诱导细胞凋亡所需的浓度较低,但和阿霉素共同作用于U2OS和SAOS-2细胞后,与贝利司他或阿霉素单独孵育相比,细胞活力显著降低,根据每种细胞系的单一药物处理和组合处理后产生的剂量-效应数据计算出药物的CI值后发现,贝利司他/阿霉素组合具有协同效应,两者联合应用后,细胞IC50值显著降低,与其他研究类似。如HDACi丙戊酸在生理浓度下不影响骨肉瘤细胞的活性,但能增强其对阿霉素的敏感型,在动物实验中也具有类似的效果[18]。
总之,本研究表明贝利司他能抑制骨肉瘤细胞生长,并能协同阿霉素进一步抑制细胞活力。在未来研究中,将开展动物实验,并进一步优化两者之间的剂量组合,从而为骨肉瘤的治疗提供实验依据。

