患肠炎病海马的肠道细菌结构特征分析
闫亚楠 陈美玲 吴锐琼 吴水清 罗辉玉 陈欣欣 何丽斌 郑乐云 黄镇


摘 要:腸炎病是海马人工养殖过程中常见病害,主要是细菌感染而引起的,其传染性强、危害性高。因此,解析患肠炎病海马肠道中的细菌菌群组成对于海马肠炎病的诊断以及防治有着重要意义。采集健康和患肠炎病的膨腹海马肠道组织,采用细菌16Sr DNA片段高通量测序和生物信息学分析手段,探究患肠炎病海马的肠道细菌结构特征。结果表明,健康和肠炎病海马之间的肠道菌群多样性和结构均存在显著差异。从属水平上来看,患病海马的肠道优势菌种为弧菌属Vibrio、漫游球菌属Vagococcus、分枝杆菌属Mycobacterium,健康海马的肠道优势菌种为玫瑰菌属Roseibium、拟杆菌目未分类Bacteroidales_unclassified、弧菌属Vibrio、嗜冷菌属Psychrobacter,健康海马和患病海马中的共有属包括弧菌属Vibrio、别弧菌属Aliivibrio、拟杆菌目未分类Bacteroidetes_unclassified、发光杆菌属Photobacterium。与健康海马肠道菌群相比,患病海马肠道中的弧菌属Vibrio、别弧属菌属Aliivibrio的含量明显高于健康海马。此外,肠炎病海马肠道中分枝杆菌属Mycobacterium、
β变形菌纲未分类Bacteroidales_unclassified、黄杆菌属Tenacibaculum和希万氏菌属Shewanella为特有的细菌种属。研究结果解析肠炎病海马肠道可能的致病菌,对于海马养殖过程中的病害防治有重要的指导意义。
关键词:海马;肠炎病;肠道;高通量测序;宏基因组学
中图分类号:S947.9 文献标志码:A 文章编号:0253-2301(2020)12-0001-08
DOI: 10.13651/j.cnki.fjnykj.2020.12.001
Analysis on the Structural Characteristics of Intestinal Bacteria inHippocampus Infected with Gastroenteritis
YAN Yanan1, CHEN Meiling1, WU Ruiqiong1, WU Shuiqing2, LUO Huiyu2,CHEN Xinxin3, HE Libin2, ZHENG Leyun2*, HUANG Zhen1*
(1. Fujian Key Laboratory of Characteristic Marine Bioresources Sustainable Utilization/College of Life Sciences,
Fujian Normal University, Fuzhou, Fujian 350117, China; 2. Fujian Fisheries Research Institute, Xiamen, Fujian 361006,
China; 3. Xiamen Xiaodeng Aquatic Products Technology Co., Ltd., Xiamen, Fujian 361000, China)
Abstract: Gastroenteritis is a common disease in the artificial breeding process of Hippocampus, which is mainly caused by bacterial infection, and is highly contagious and harmful. Therefore, it is of great significance to analyze the composition of bacterial community in the intestines of Hippocampus infected with gastroenteritis for the diagnosis and prevention of gastroenteritis. The intestinal structure of healthy and diseased Hippocampus abdominalis were collected, and the highthroughput sequencing of bacterial 16Sr DNA fragments and bioinformatics analysis were used to explore the structural characteristics of intestinal bacteria in the hippocampus infected with gastroenteritis. The results showed that there were significant differences in the intestinal bacterial diversity and structure between the healthy and diseased Hippocampus. At the genus level, the dominant intestinal bacteria of diseased Hippocampus were Vibrio, Vagococcus, and Mycobacterium, while the dominant intestinal bacteria of healthy Hippocampus were Roseibium, Bacteroidales_unclassified, Vibrio, and Psychrobacter. The common genera of the healthy and diseased Hippocampus included Vibrio, Aliivibrio, Bacteroidetes_unclassified, and Photobacterium. Compared with the intestinal flora of healthy Hippocampus, the content of Vibrio and Aliivibrio in the intestines of diseased Hippocampus was significantly higher than that of healthy Hippocampus. Besides, there were some unique bacterial genera in the intestines of diseased Hippocampus, such as Mycobacterium, Bacteroidales_unclassified, Tenacibaculum, and Shewanella. The results of the study analyzed the possible pathogenic bacteria in the intestines of Hippocampus infected with gastroenteritis, which would be of important guiding significance for the prevention and control of diseases in the breeding process of Hippocampus.
Key words: Hippocampus; Gastroenteritis; Intestinal; Highthroughput sequencing; Metagenomics
海马是海马属Hippocampus鱼类的通称,属于脊索动物门硬骨鱼纲、刺鱼目、海龙科[1],广泛分布于暖温带、亚热带和热带沿岸浅水海域[2]。海马因其经济和药用价值成为世界上交易量最高的海洋生物之一[3]。近几年来,随着海洋污染加剧、人类对近岸海域过度开发,以及人类对海马的过度捕捞,我国沿海的海马自然资源日益减少,随着人工养殖海马技术的突破,养殖规模不断扩大,人工养殖海马将成为药用海马来源的主要方式。在海马养殖过程中,由细菌引起的肠炎病是常见的疾病,该病多发于海马的幼年期,其具体表现症状为海马肛门松弛、红肿并附有白色物。剖开海马腹部会发现有大量积液、肠内无食物、肠道发炎充血呈红色、后肠肿胀明显、并可能伴有白色结节。病海马行动痴呆、迟缓漂浮于水面。食欲减退鱼体消瘦衰弱致死[4]。
迄今为止,对海马细菌病的研究大部分采用病原菌分离的研究方法,例如Lin等[5]对患有肠炎的直立海马进行分离病原菌,得到了1株病原菌DS3,经鉴定DS3为副溶血性弧菌。Wang等[6]对患病线纹海马的肠道中进行分离病原菌,检测到1种新型的病原菌强壮弧菌。李营[7]从患表皮溃疡综合征线纹海马的溃烂肌肉及肠道组织中分离病原菌,检测到副溶血弧菌和哈维氏弧菌。Li等[8]从患病日本海马的肠道、肝脏和溃烂皮肤中分离出HC2菌株,经鉴定HC2为假单胞菌。Jiang等[9]从患烂尾病的库达海马中分离出3种可培养的肠道细菌菌株,经鉴定为假交替单胞菌属、枯草芽孢杆菌和发光杆菌。Balcázar等[10]从患病长吻海马和欧洲海马的有白斑的皮肤和坏死的尾巴中进行病原菌分离,发现溶藻弧菌和灿烂弧菌在患病海马中占主导地位。Balcázar等[11]从患烂尾病长吻海马的溃烂皮肤中分离出了
BFLP6T菌株,经鉴定BFLP6T菌株是1种新型的分枝杆菌——海马分枝杆菌M.hippocampi sp.Nov。这些研究关注的主要是患病海马的病原菌,但是没有解析患病海马自身的肠道微生物状态。动物肠道中的肠道菌群在宿主中起着“被遗忘”的器官的作用,并为宿主履行其无法自我完成的关键功能[12-13]。许多研究表明,肠道菌群是其宿主代谢、免疫力、能量利用和健康维持的重要组成部分
[14-15]。同样的,海马的肠道菌群在调节免疫应答、抵抗疾病和抑制潜在病原体方面起着重要作用。当海马处于健康状态时,肠道菌群间处于相对稳定的动态平衡中,而这种平衡一旦被打破,致病菌异常增殖,正常菌群的生长受到抑制,宿主就会因肠道菌群的紊乱发生疾病。因此,对养殖过程中肠炎病海马的肠道菌群进行深入研究有助于全面了解海马腸炎病的发病机理。
本研究中通过高通量测序技术,对人工养殖的健康和患肠炎病海马的肠道菌群进行比较分析,解析出健康和患肠炎病海马肠道中各自特异性的微生物群落结构,为患肠炎病海马的治疗与预防提供理论基础。1 材料与方法
1.1 样品采集及处理
健康海马和患肠道疾病的海马采集自福建省水产研究所。海马为膨腹海马Hippocampus abdominalis,体长10 cm。
1.2 样品总DNA提取、PCR扩增及高通量测序
将海马置于解剖镜下,用酒精对其体表进行消毒,在无菌环境中解剖将肠道取出,同时用无菌海水冲洗3次后放在灭菌的离心管中。5条海马的肠道混合成1个样本。在冰上用组织匀浆机将海马肠道样品匀浆后,根据说明书用Soil DNA Kit试剂盒(Omega BioTek,USA)提取细菌总DNA。通过在2%的琼脂糖凝胶中电泳分析总DNA质量和完整性,并使用NanoDrop(ND2000,Thermo Scientific)对DNA浓度进行定量分析。用细菌特异性引物:341F(5′CCTAYGGGRBGCASCAG3′)和806R (5′GGACTACNNGGGTATCTAAT3′) 对16SrDNA基因可变区(V3~V4区)进PCR扩增。PCR产物用2.0%的琼脂糖凝胶电泳检测后送北京诺禾致源生物信息科技有限公司进行基于Illumina HiSeq测序平台的高通量测序。
1.3 数据分析
1.3.1 测序数据处理 根据Barcode序列和PCR扩增引物序列从下机数据中拆分出各样品数据,将Barcode序列和引物序列去除后,利用FLASH v 1.2.7软件对每个样品的reads进行拼接、过滤以得到高质量的tags数据, 随后使用Quantitative Insights Into Microbial Ecology(QIIME 1.9.1)软件与参考数据库(Gold database)比对(UCHIME Algorithm)检验并去除嵌合体序列,得到有效数据(effective tags)。
1.3.2 OTU聚类和物种注释 利用Uparse软件v 7.0.1001对所有样品的全部有效数据(effective tags)进行聚类,默认以97%的相似性(identity)将序列聚类成为操作分类单元(OTUs)、依据其算法原则,筛选 OTUs 中出现频数最高的序列作为 OTUs 的代表序列。用Mothur软件与SILVA的SSUrRNA数据库对OTUs 的代表序列进行物种注释分析,每个OTU在结果分析中视作一种细菌。使用MUSCLE v.3.8.31软件进行快速多序列比对,得到所有OTUs代表序列的系统发生关系。为了去除样品序列差异引起的误差,对所有样品进行均一化处理(以数据量最少的样品为标准,cutoff=69713),以处理后的数据为基础进行后续多样性分析。
1.3.3 样品复杂度分析 使用QIIME 1.9.1软件包计算了群落丰富度指数(Chao and Ace)、群落多样性指数(Shannon and Simpson)、Observedspecies和Goodscoverage,使用R软件v 3.5.2绘制稀释曲线并进行Alpha多样性指数组间差异分析。使用STAMP v.2.1.3进行Metastats分析:通过对组间样本进行比较,在各分类水平上找出两组中具有显著差异的物种。
2 结果与分析
2.1 健康与患病海马肠道的细菌多样性指数分析
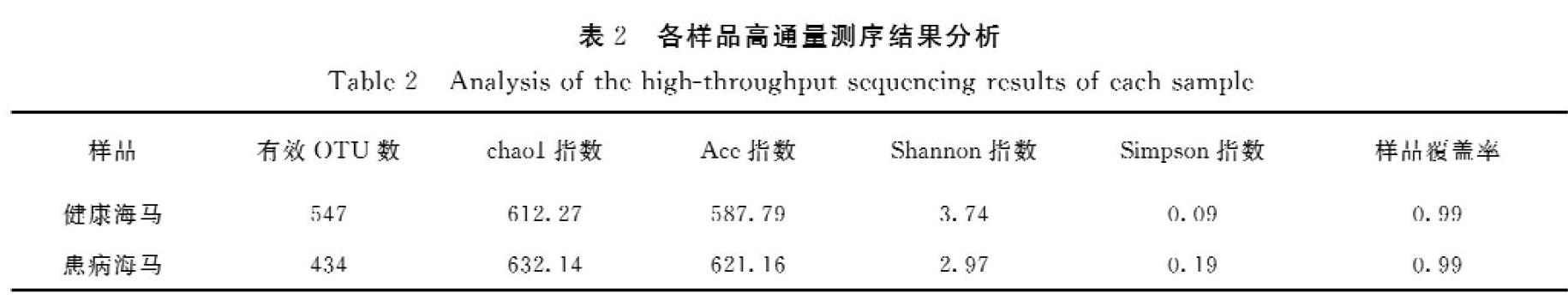
对于健康与患病海马肠道提取总细菌DNA后,使用细菌特异性引物进行了PCR扩增,结果如图1所示。从图1可见,6个样品的PCR产物条带大小正确,并且总量符合测序建库要求。进一步使用illumina Hiseq进行上机测序,6个样品得到的数据统计如表1所示。
对6个样品的测序数据经过OTU比对后,绘制了不同样品的稀释曲线,从图2可以看出,6个样品的稀释曲线均随序列数量的增加而趋于平缓,表明所测的数据量已经可以反映微生物群落结构和多样性(图2A)。進一步将6个样品按照健康与患病海马分为2组,每组的3个生物学重复样品,合并进行分析。以97%的相似性对序列进行聚类,相似度大于97%的序列将聚为同一个OTU,健康和患病样品中有效OTUs数目分别为547、434个,但是健康海马肠道微生物的ACE、Chao1指数低于患病海马,表明健康海马的肠道微生物物种数目低于患病海马组。健康海马肠道微生物的Shannon多样性指数高于患病海马组,并且Simpson多样性指数低于患病海马组,表明在微生物多样性方面,健康海马的肠道中微生物的菌群多样性高于患病海马(表2)。最后,分别对2种样品绘制等级分布曲线,结果如图2B所示,在水平方向上,患病海马组的曲线在横轴上的跨度大于健康海马组,也表明患病海马组的微生物物种数目高于健康海马,同时在垂直方向上患病海马的曲线比健康海马陡峭,表明患病海马样品中存在相对丰度明显占优的细菌种类。
2.2 健康与患病海马肠道的细菌群落组成及相对丰度
首先从细菌分类的门水平上通过对健康与患病海马肠道的细菌群落组成进行比较。本研究确定了4个主要门:变形菌门Proteobacteria(health75.26%、disease 65.6%)、厚壁菌门Firmicutes(health 11.33%、disease 15.98%)、拟杆菌门Bacteroidetes(health 11.05%、disease 9.99%)、放线菌门Actinobacteria(health 11.37%,disease 7.34%)。
其次,在细菌分类的属水平上,共鉴定出19个主要属。其中患病海马的肠道优势菌种为弧菌属Vibrio、漫游球菌属Vagococcus、分枝杆菌属Mycobacterium、β变形菌纲未分类Betaproteobacteria_unclassified、黄杆菌属Tenacibaculum、希万氏菌属Shewanella。健康海马中的优势菌种为玫瑰菌属Roseibium、拟杆菌目未分类Bacteroidales_unclassified、弧菌属Vibrio、嗜冷菌属Psychrobacter、梭菌目未分类Clostridiales_unclassified,红细菌科未分类Rhodobacteraceae_unclassified。其中弧菌属Vibrio、弧菌科未分类Vibrionaceae_unclassified、别弧菌属Aliivibrio、拟杆菌目未分类Bacteroidetes_unclassified、发光杆菌属Photobacterium为健康海马和患病海马中的共有属。具体的各个属百分数如图3所示。
2.3 健康与患病海马肠道的细菌群落组成差异性分析
为了解析健康与患病海马肠道的细菌群落组成的差异性,将所有的6个样品根据OTU的类型进行了主成分分析,结果如图4所示。从图4可以看出,所有的6个样品可以明显分成2群,一群为健康海马肠道样品,另一群为患病海马肠道样品,表明2群样品之间有明显的差异性。其中健康海马肠道样品聚类较为集中,而患病海马肠道样品聚类较为分散。
为了进一步解析健康与患病海马在属水平上的细菌群落组成的差异性,将两组样本利用STAMP进行显著性差异分析。由图5可以看出,健康海马与患病海马存在明显差异,在患病海马中,弧菌属Vibrio、漫游球菌属Vagococcus、分枝杆菌属Mycobacterium、黄杆菌属Tenacibaculum、希万氏菌属Shewanella、β变形菌纲-未分类Betaproteobacteria_unclassified显著表达。而在健康海马中玫瑰菌属Roseibium、嗜冷菌属Psychrobacter、梭菌目-未分类Clostridiales_unclassified、弓形杆菌属Arcobacter显著表达。
3 结论与讨论
由于第二代高通量测序技术的数据流量、测序深度和准确性都很高,所以目前该技术在水产养殖相关的研究应用广泛,其中在鱼类肠道菌群的研究应用尤为广泛[16]。最近的研究发现,肠道微生物多样性的变化和肠道菌群失衡对寄主鱼类有不同的影响[17-18]。本研究通过基于16Sr DNA的高通量测序技术分析了健康和患肠炎病海马肠道菌群结构差异,这将有助于对于肠炎病海马的治疗以及为海马的健康养殖提供理论基础。
在本研究中,海马肠道菌群中的优势菌群是变形菌门Proteobacteria、厚壁菌门Firmicutes、拟杆菌门Bacteroidetes。另外,在属水平上,本研究在患病和健康海马的肠道中均鉴定出严重的一些潜在病原体:弧菌属、别弧菌属、发光杆菌属,其中弧菌属在患病的海马肠道中的含量明显高于健康海马。弧菌属细菌是海洋环境中分布最广泛细菌类群之一,大部分弧菌属是海洋环境及某些海洋动物中正常菌群的组成部分,但也有部分弧菌会对水产养殖造成巨大危害[19]。比如Lin等[5]、Sao等[20]和Qin等[21]分别对副溶血弧菌、塔氏弧菌和哈维氏弧菌在海马肠道中的作用进行鉴定,结果表明弧菌属的丰度提高可能会导致海马消化不良和食欲不振,使其变得瘦弱,容易受到机会病原体的侵害。此外,在患病海马中还发现了机会致病菌:分枝杆菌属、黄杆菌属。分枝杆菌在淡水鱼类和海水鱼类均存在,鱼类感染分枝杆菌后会在内脏中形成许多灰白色或淡黄色小结节,分枝杆菌病可以分为慢性感染和急性感染,慢性感染会引起鱼类零星死亡但急性感染有可能引起鱼类大量死亡[22]。黄杆菌对淡水鱼类、海洋鱼类、两栖动物、其他水生动物以及海洋微藻都有致病作用,死亡率可高达100%[17]。因此,弧菌属、分枝杆菌属、黄杆菌属的存在可能会诱发海马发病。进一步通过matastats分析,得出健康海马中存在着几个差异显著的菌属:嗜冷菌属Psychrobacter、梭菌目-未分类Clostridiales_unclassified、弓形杆菌属Arcobacter。其中已有报道证明,梭菌和嗜冷菌是健康细鳞鱼和黑斑狗鱼中的优势菌群[18]。梭菌也是养殖条件下健康大黄鱼肠道中的优势菌群[23]。弓形杆菌存在于海水、沿海沉积物以及海洋无脊椎动物中[24],Romero等[25]发现人工养殖的健康智利牡蛎中广泛存在弓形杆菌,此外,在人工养殖的健康欧洲龙虾、鲍鱼中也发现了弓形杆菌[26-27]。上述研究结果与已有报道的结果一致,比如Ma等[16]研究发现,患病云龙石斑鱼和健康云龙石斑鱼之间肠道菌群的丰富度和多样性没有显著差异,但患病鱼中主要的菌群(如变形杆菌)的含量上调。Wang等[28]研究发现,健康和患病养殖大西洋鲑的肠道菌群有所不同,在健康的鱼类肠道中观察到的细菌多样性明显高于发病鱼类,在患病鱼类肠道中,一些机会性病原体明显丰富,而健康鱼类肠道中含有更多的益生菌。
总之,为了解析肠炎病海马肠道中的细菌菌群组成,通过高通量测序比较健康和患病海马之间的肠道细菌组成。结果表明,当海马患病时,主要细菌的丰度发生了显著变化,在患病海马中,拟杆菌和红细菌明显减少,而弧菌则被上调。在属水平上,在患病的海马中一些病原细菌,如弧菌、别弧菌属明显增加;并且仅在患病海马中检出了黄杆菌、分枝杆菌和希万氏菌,这些菌群可能是引起海马患病的重要潜在病原体。本研究结果表明,微生物群结构的改变可能与肠道炎症的发作同时发生,这为了解肠道微生物群与疾病的发生之間的联系提供了帮助。同时本研究的结果对海马的养殖以及对海马肠道微生物群生态学的理解具有重要意义。
参考文献:
[1]罗杰,李锋,刘皓,等.饵料对大海马幼鱼生长与存活影响[J].海洋湖沼通报,2018(4):140-147.
[2]杜庆红,陈栩,朱长寿,等.饥饿与投喂方式对养殖大海马生存和生长的影响[J].海洋水产研究,2004(4):51-56.
[3]LOH TL,TEWFIK A,AYLESWORTH L, et al.Species in wildlife trade:socioeconomic factors influence seahorse relative abundance in Thailand[J].Biological Conservation,2016,201(201):301-308.
[4]苏志星,王元,王松刚.海马人工养殖中肠炎冰的防治技术[J].科学养鱼,2020(1):92.
[5]LIN T T,ZHANG D,LIU X,et al.Variations of immune parameters in the lined seahorse Hippocampus erectus after infection with enteritis pathogen of Vibrio parahaemolyticus[J].Fish and Shellfish Immunology,2016,50:247-254.
[6]WANG X,ZHANG Y,QIN G,et al.A novel pathogenic bacteria(Vibrio fortis)causing enteritis in cultured seahorses,Hippocampus erectus Perry,1810[J].Journal of Fish Diseases,2015,39(6):765-769.
[7]李营.线纹海马(Hippocampus erectus)肠道微生物与其疾病关系的研究[D].青岛:青岛大学,2019.
[8]LI H D,SUN H S,BAI XF,et al.HC 2 of Pseudomonas sp.induced enteritis in Hippocampus japonicus[J].Aquaculture Research,2016,47(6):2027-2030.
[9]JIANG F,HUANG H,YANG N,et al.Isolation, identification,and biological control in vitro of tail rot pathogen strain from Hippocampus kuda[J].PLoS ONE,2020,15(4):e0232162.
[10]BALCZAR J L,GALLOBUENO A,PLANAS M,et al.Isolation of Vibrio alginolyticus and Vibrio splendidus from captivebred seahorses with disease symptoms[J].Antonie van Leeuwenhoek,2009,97(2):207-210.
[11]BALCZAR J L,PLANAS M,PINTADO J,et al.Mycobacterium hippocampi sp.nov.a Rapidly Growing Scotochromogenic Species Isolated from a Seahorse with Tail Rot[J].Current Microbiology,2014,69(3):329-333.
[12]O′HARA ANN M,SHANAHAN FERGUS.The gut flora as a forgotten organ[J].EMBO reports,2006,7(7):688-693.
[13]NICHOLSON J K,HOLMES E,KINROSS J,et al.Hostgut microbiota metabolic interactions[J].Science,2012,336(6086):1262-1267.
[14]BCKHED F,DING H,WANG T,et al.The gut microbiota as an environmental factor that regulates fat storage[J].Proc Natl Acad Sci USA,2004,101(44):15718-15723.
[15]SHI N,LI N,DUAN X,et al.Interaction between the gut microbiome and mucosal immune system[J].Mil Med Res,2017,4(1):14.
[16]MA C,CHEN C,JIA L,et al.Comparison of the intestinal microbiota composition and function in healthy and diseased Yunlong Grouper[J].AMB Express,2019,9(1):187.
[17]林国荣,王春忠,孙富林,等.海水混养池塘虾蛤肠道与养殖环境的微生物多样性[J].微生物学通报,2018,45(9):1989-1999.
[18]黄丽丽,张艳,周红,等.基于16S rRNA高通量测序方法比较新疆冷水鱼肠道中微生物多样性[J].食品科学,2018,39(10):138-144.
[19]GENNARI M,GHIDINI V,CABURLOTTO G,et al.Virulence genes and pathogenicity islands in environmental Vibrio strains nonpathogenic to humans[J].FEMS Microbiol Ecol,2012,82(3):563-573.
[20]HAO P,YONG P,WANG X,et al.Isolation,identification,and histopathological analysis of Vibrio tubiashii from lined seahorse Hippocampus erectus[J].Dis Aquat Organ,2019,133(3):195-205.
[21]QIN G,WANG X,TAN S,et al.A bacterial infection by Vibrio harveyi causing heavy reduction of cultured lined seahorse Hippocampus erectus[J].J Fish Dis,2017,40(4):601-605.
[22]杜佳垠.鱼类分枝杆菌病危害状况与研究进展[J].北京水产,2007(4):31-35.
[23]李英英,陈曦,宋铁英.不同生长速度的大黄鱼肠道菌群结构的差异[J].大连海洋大学学报,2017,32(5):509-513.
[24]COLLADO L,FIGUERAS M J.Taxonomy,epidemiology,and clinical relevance of the genus Arcobacter[J].Clin Microbiol Rev,2011,24(1):174-192.
[25]ROMERO J,GARCíAVARELA M,LACLETTE J P,et al.Bacterial 16S rRNA gene analysis revealed that bacteria related to Arcobacter spp.constitute an abundant and common component of the oyster microbiota(Tiostrea chilensis)[J].Microb Ecol,2002,44(4):365-371.
[26]MEZITI A,MENTE E,KORMAS K A.Gut bacteria associated with different diets in reared Nephrops norvegicus[J].Syst Appl Microbiol,2012,35(7):473-482.
[27]TAJIMA E K.Biodiversity and in situ abundance of gut microflora of abalone(Haliotis discus hannai)determined by cultureindependent techniques[J].Aquaculture,2004,241(1):453-463.
[28]WANG C, SUN G X, LI S S,et al.Intestinal microbiota of healthy and unhealthy Atlantic salmon Salmo salar L.in a recirculating aquaculture system[J].Journal of Oceanology and Limnology,2018,36(2):414-426.(責任编辑:柯文辉)

