白藜芦醇对小鼠结肠运动的抑制作用和机制研究
杨 梦 ,陆红丽,黄 旭,许文燮
1. 荆楚理工学院医学院生理教研室,荆门448000;2. 上海交通大学基础医学院解剖与生理学系,上海200240
白藜芦醇(resveratrol,Res),又称为3, 4', 5-三羟基-反式-二苯乙烯,是一种天然的多酚化合物,存在于花生、葡萄、桑葚等多种植物之中。Res具有保护心血管[1-4]、抗癌、抗衰老、抗菌消炎等作用[5-7]。研究表明,Res是一种植物雌激素,可以舒张血管平滑肌[8]、胃、十二指肠[9-10]和胆囊[11];在不同的平滑肌组织中,Res的作用机制并不一致;而有关Res对结肠运动的作用和机制尚未见报道。
结肠运动是结肠传输的动力。在哺乳动物中,结肠移行性复合运动(colonic migrating motor complex,CMMC)是粪便排出的主要推进性收缩[12]。CMMC是一种复杂的生理活动,受肠神经和2种间质细胞[即Cajal间质细胞(interstitial cells of Cajal,ICC)和血小板衍生生长因子受体α阳性细胞(platelet-derived growth factor receptor α-positive cells,PDGFRα+细胞)]的共同调节[13-15]。而且,结肠平滑肌的收缩与平滑肌细胞上的K+通道和电压依赖性Ca2+通道密切相关[16-19]。
结肠运动障碍引起结肠功能紊乱,可见于多种疾病。在治疗中,一些化学药物的不良反应十分明显,所以越来越多的研究集中在低毒性的天然来源的植物化学物质。而且,Res存在于多种食物之中,研究其对胃肠道运动的作用,尤其对结肠运动的作用,具有重要的生物医学意义。本研究旨在阐明Res对小鼠结肠运动的作用和机制,以期为Res的临床开发和应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验仪器 SZX12型解剖显微镜、IX-70倒置显微镜(日本Olympus Optical公司),JZJ01H型张力换能器、RM6240系列多通道生理信号采集处理系统(中国成都仪器厂),P97微电极拉制仪(美国Sutter公司),EPC-10膜片钳放大器(德国HEKA公司)。
1.1.2 试 剂 Res、Bayk8644、apamin、 四 乙 基 铵(tetraethylammonium,TEA)、河豚毒素(tetrodotoxin,TTX)、Nω-硝 基 -L-精 氨 酸 甲 酯(Nω-nitro-L-arginine methyl ester,L-NAME)、阿托品和5-硝基-2-(3-苯基丙基氨基)苯甲酸[5-nitro-2-(3-phenylpropylamino)benzoic acid,NPPB]均购自美国Sigma公司。
1.1.3 动物 4~5周的成年雄性ICR(Institute of Cancer Research,美国癌症研究所)小鼠由中国科学院上海实验动物中心提供[生产许可证号为SCXK(沪)2018-007,使用许可证号为SYXK(沪)2018-0027],在20~25 ℃下饲养,饮食不限制。研究经上海交通大学医学院动物实验伦理委员会审批。
1.2 实验方法
1.2.1 结肠平滑肌自发性收缩的记录 实验前1日配置溶液和药品。Krebs溶液:葡萄糖 11.5 mmol/L,CaCl22.5 mmol/L,NaCl 121.9 mmol/L,NaHCO315.5 mmol/L,KCl 5.9 mmol/L,MgSO41.2 mmol/L,KH2PO41.2 mmol/L。将Res、Bayk8644和NPPB溶解在二甲基亚砜中。将apamin、TEA、TTX、L-NAME、atropine溶解于双蒸水。所有药物均保持在-20 ℃。用异氟烷麻醉并脱颈处死小鼠,将结肠迅速取出、移至氧饱和的Krebs溶液。在解剖显微镜下,除去黏膜和黏膜下层,将结肠平滑肌组织切成小条(2 mm×8 mm)。使用丝线系住两端,将肌条的一端固定在38 ℃、氧饱和的10 mL浴槽溶液中,另一端连接张力换能器,换能器与多通道生理信号放大器相连,通过电脑记录肌条的自发性收缩[20]。首先使用8只小鼠,观察 Res(10、20、40和 80 μmol/L)对肌条的作用,对比同一肌条在Res处理前后的自发性收缩。然后观察各种阻断剂或激动剂对Res作用的影响。具体如下:先观察记录Res对肌条的作用,洗脱之后用各种阻断剂或激动剂预处理肌条,再观察记录Res对肌条的作用。对比同一肌条预处理前后Res的作用。各阻断剂或激动剂预处理所用的小鼠例数如下:L型Ca2+通道激活剂BayK8644(n=4)、非选择性K+通道阻滞剂TEA(n=9)、Na+通道阻滞剂TTX(n=8)、胆碱能神经元抑制剂阿托品(n=5)、NO合酶抑制剂L-NAME(n=10)、ANO1(anoctamin 1)通道抑制剂NPPB(n=4)和SK3通道抑制剂apamin(n=6)。
1.2.2 CMMC的记录 用异氟烷麻醉并脱颈处死小鼠(n=6),迅速取出结肠放入氧饱和的Krebs溶液。在解剖显微镜下切除肠系膜,用1 mL注射器人工排出粪便颗粒,并将与模拟粪便颗粒连接的玻璃毛细管插入肠管。之后,移入矩形容器,其中充满20 mL温度为(38.0±0.5)℃、氧饱和的Krebs溶液;将结肠固定在硅胶板底部,将丝线连接到结肠的近端和远端,通过张力换能器连接到放大器装置[21]。通过电脑记录Res对CMMC的作用,记录和对比同一离体结肠经Res处理前后的远端和近端CMMC。
1.2.3 结肠平滑肌细胞的分离 实验前1日配置无钙生理盐水:NaCl 134.8 mmol/L,KCl 4.5 mmol/L,葡萄糖 5 mmol/L,MgCl2· 6H2O 1 mmol/L,HEPES 10 mmol/L, 用 Tris 调 节至pH 7.40。用异氟烷麻醉并脱颈处死小鼠,迅速取出结肠放入氧饱和的无钙生理盐水。在显微镜下,除去黏膜和黏膜下层,将肌肉层切成小段(1 mm×4 mm),放入装有无钙生理盐水的试管中,保持在4 ℃。然后配置消化液:在1 mL 无钙生理盐水中加入Ⅱ型胶原酶4 mg、胰蛋白酶抑制剂8 mg、牛血清白蛋白8 mg、二硫苏糖醇2 μmol、木瓜蛋白酶2 μmol,保持在4 ℃,备用。之后将肌条放入装有1 mL消化液的试管中,在37.5 ℃下消化20~30 min,然后用无钙生理盐水多次洗涤肌条,保持在4 ℃,备用[22]。
1.2.4 电生理记录 实验前1日,配置记录钡电流(barium currents,IBa)的灌流液:NaCl 134.8 mmol/L、KCl 4.5 mmol/L、 葡萄糖 10 mmol/L、MgCl2·6H2O 1 mmol/L、HEPES 10 mmol/L、BaCl210 mmol/L, 用 Tris调 节 至pH 7.40;配置记录IBa的电极内液:CsCl 125 mmol/L、TEA 20 mmol/L、EGTA 10 mmol/L、HEPES 10 mmol/L、Na2ATP 2 mmol/L、MgCl2· 6H2O 4 mmol/L, 用 Tris调 节至pH 7.35。用平滑玻璃口的滴管反复吹打肌条(n=6),直至溶液浑浊,形成平滑肌细胞悬浮液。从试管中取悬浮液平铺于倒置显微镜的灌流槽中,10~15 min之后开始灌注。实验在20~25 ℃进行,玻璃电极的电阻为2~4 MΩ,采用膜片钳技术的全细胞记录模式,用膜片钳放大器记录L型Ca2+电流细胞[23]。
1.3 统计学方法
使用Origin 7.5软件分析数据,数据以±s表示。使用单因素方差分析(one-way ANOVA with Bonferroni's post hoc test)评估多组数据,并使用t检验比较配对的2组数据。P<0.05认为差异具有统计学意义。
2 结果
2.1 Res对小鼠离体结肠平滑肌自发性收缩和CMMC的影响
Res以剂量依赖的方式显著抑制小鼠离体结肠平滑肌自发性收缩,10、20、40和 80 μmol/L Res分别抑制收缩幅度 至(86.08±4.43)%、(67.46±4.12)%、(40.59±5.64)%和(17.42±3.78)%(均P<0.05,图1A、C)。Res显著抑制小鼠离体结肠近端和远端的CMMC至(63.13±14.82)%和(61.23±5.18)%(P=0.031,P=0.001,图 1B、D)。

图1 Res对小鼠离体结肠自发性收缩和CMMC的影响Fig 1 Effects of Res on colonic spontaneous contraction and CMMC in mice
2.2 肠神经系统和2种间质细胞在Res抑制结肠平滑肌自发性收缩中的作用
施用TTX前后,Res分别抑制收缩幅度至(56.75±5.27)%和(49.27±8.94)%(图2A、D);施用atropine前后,收缩幅度被抑制到(75.06±9.38)% 和(71.19±10.22)%(图2B、E);施用L-NAME前后,收缩幅度被抑制至(52.43±5.64)% 和(44.68±7.08)%(图 2C、F)。与 Res单独作用组相比,抑制剂+Res组收缩幅度无明显变化(P>0.05),说明3种抑制剂均不能显著阻断Res对结肠平滑肌自发性收缩的抑制作用。

图2 TTX、atropine和L-NAME对Res抑制小鼠结肠自发性收缩的影响Fig 2 Effects of TTX, atropine and L-NAME on Res-suppressed colonic spontaneous contraction in mice
施用apamin前后,收缩幅度分别被Res抑制至(42.38±6.38)% 和(46.51±3.49)%(图 3A、C);施用NPPB前后,收缩幅度分别被Res抑制至(58.39±6.23)%和(49.31±14.76)%(图3B、D)。与Res单独作用组相比,抑制剂+Res组收缩幅度无明显变化(均P>0.05),说明这2种抑制剂也不能显著阻断Res对结肠平滑肌自发性收缩的抑制作用。

图3 Apamin和NPPB对Res抑制小鼠结肠自发性收缩的影响Fig 3 Effects of apamin and NPPB on Res-suppressed colonic spontaneous contraction in mice
2.3 离子通道阻断剂在Res抑制结肠平滑肌自发性收缩中的作用
用TEA预处理前后,收缩幅度分别被Res抑制至(43.89±8.08)% 和(59.93±4.77)%(图 4A、C),差异无统计学意义(P>0.05),提示非选择性K+通道阻滞剂TEA对Res的抑制作用没有影响。
用BayK8644预处理前后,结肠平滑肌自发性收缩被Res抑制至(44.09±13.41)%和(84.56±6.09)%;与Res单独作用组相比,BayK8644+Res组中Res的抑制作用明显被阻断(P=0.031,图4B、D),提示L型Ca2+通道激活剂BayK8644可显著阻断Res的抑制作用。
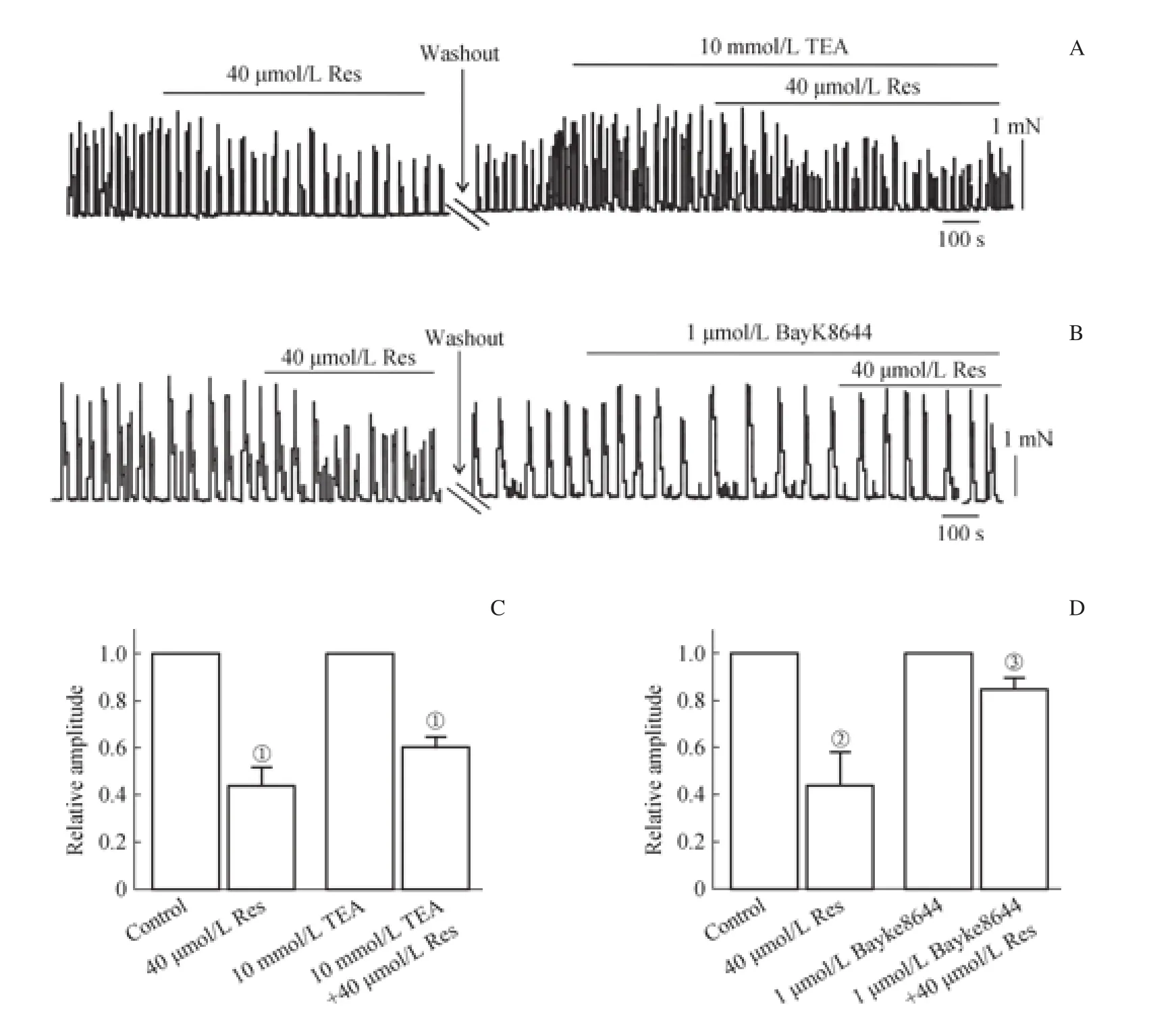
图4 TEA和BayK8644对Res抑制小鼠结肠自发性收缩的影响Fig 4 Effects of TEA and BayK8644 on Res-suppressed colonic spontaneous contraction in mice
2.4 Res对L型Ca2+通道电流的影响
在新鲜分离的结肠平滑肌细胞上,在传统的全细胞模式下,将膜电位钳制在-80 mV,每10 s给予10 mV增加幅度的阶跃刺激,使其去极化依次从-40 mV至70 mV,时间持续440 ms,记录IBa。在I-V关系曲线(current-voltage relation curve)中,从-20 mV至50 mV,40 μmol/L Res显著降低 IBa(均P<0.05,图 5A、B);在0 mV时,IBa被抑制至(35.92±6.88)%(图5C)。

图5 Res对L型Ca2+电流的影响Fig 5 Effect of Res on L-type Ca2+ current
3 讨论
在本研究中,Res显著抑制结肠平滑肌的自发性收缩和CMMC;Res对结肠平滑肌自发性收缩的抑制作用不受TTX、atropine、L-NAME、NPPB、apamin、TEA的影响,却被 BayK8644显著阻断且Res直接抑制结肠平滑肌细胞的L型Ca2+通道电流。这些结果表明,Res对结肠平滑肌运动的抑制作用可能通过L型Ca2+通道介导。
正常情况下结肠运动受肠神经调节,主要包括兴奋性的胆碱能神经[13]和抑制性的氮能和嘌呤神经[14]。报道的Res的作用机制在不同平滑肌的组织中存在差异。Res能舒张大鼠胃和十二指肠、豚鼠胃底平滑肌和人胆囊,与NO通路有关[9-11];但是Res舒张血管的作用与NO通路无关[8]。因此,在本研究中,我们首先研究了Res的抑制作用是否与肠神经系统有关,分别使用TTX来阻断肠神经系统、阿托品阻断胆碱能神经、L-NAME(NO合酶抑制剂)来阻断平滑肌的NO合成;结果发现Res的抑制作用不受这些药物的影响。继而表明,Res对结肠的抑制作用可能与神经系统没有关系。
除了神经系统,结肠运动还受2种间质细胞的调节。ICC 是胃肠平滑肌自动节律性运动的起搏细胞,其上表达的ANO1通道产生起搏电流,使平滑肌去极化产生慢波,并激活平滑肌细胞L型Ca2+通道产生快波,引起平滑肌收缩[24];SK3通道在PDGFRα+细胞上高表达,而在ICC和平滑肌细胞上表达量则非常少[25],SK3通道被激活会引起PDGFRα+细胞的超极化,又通过缝隙连接使相邻的平滑肌超极化,抑制平滑肌L型Ca2+通道,引起平滑肌舒张[24]。为研究Res的抑制作用是否与2种间质细胞有关,我们分别用NPPB阻断ANO1通道、apamin阻断SK3通道,结果发现Res的抑制作用不受影响,继而说明Res对结肠的抑制作用可能与2种间质细胞无关。
平滑肌的收缩性与平滑肌细胞膜上的离子通道密切相关。K+通道在维持静息膜电位和平滑肌松弛方面起重要作用[16-17]。平滑肌细胞中有3种外向钾电流,即延迟整流钾电流(IKV)、钙激活钾电流(IKCa)和瞬时外向钾电流(Ito)[26]。Wade等[17]证明IKV在调节食管肌肉静息张力方面起主导作用,而IKCa在很大程度上限制了与激发相关的收缩。此外,ATP依赖性K+通道参与慢波的形成,并参与硫化氢对胃肠和血管平滑肌的抑制[18,27]。据报道[9-11],Res对大鼠胃和十二指肠、豚鼠胃底平滑肌和人胆囊的舒张作用与ATP敏感性K+通道有关,对人胆囊的舒张作用还与大电导钙激活K+通道通路有关。在我们的实验中,TEA(非选择性K+通道阻滞剂)不能阻断Res的抑制作用,说明K+通道可能没有参与Res对小鼠结肠的抑制作用。
胃肠平滑肌的快波形成和肌肉收缩均由钙内流引起,Ca2+通道的开放和膜电位相关联,是电压依赖性Ca2+通道[19],其可分为L型和T型等。与T型相比,L型电压依赖性Ca2+通道有以下特点:高阈值、大电导;失活慢,开放时程长;当用Ba2+代替细胞外Ca2+时,L型Ca2+电流幅度增大,而T型Ca2+电流不受影响;L型对BayK8844敏感,而T型对其不敏感[28]。在动作电位期间,细胞外Ca2+离子主要通过L型Ca2+通道进入平滑肌细胞而引起收缩。L型是胃肠道平滑肌细胞膜中主要的电压依赖性Ca2+通道[19]。据报道,Res通过抑制L型Ca2+通道而舒张兔主动脉、大鼠的胃和十二指肠[15-16]。在本研究中,Bayk8644(L型 Ca2+通道激活剂)可显著阻断Res对结肠平滑肌自发性收缩的抑制作用。为进一步证实Res的抑制作用与L型Ca2+通道有关,我们使用全细胞膜片钳技术,观察Res对新鲜分离的结肠平滑肌细胞上L型Ca2+通道电流的影响,发现在I-V曲线中,从-20 mV到50 mV Res可显著抑制IBa。这些结果表明Res可能通过直接抑制L型Ca2+通道电流来抑制结肠平滑肌运动。
综上所述,本实验中Res显著抑制小鼠的结肠运动,其机制可能与结肠平滑肌细胞L型Ca2+通道的抑制有关,而肠神经系统、NO信号通路、2种间质细胞和K+通道可能不参与Res的抑制作用。

