表观扩散系数与缺氧诱导因子-1α、核因子-κB在布加综合征大鼠模型中的相关性初探
朱楠,张甜甜,成德雷
(1.安徽省五河县人民医院 影像科,安徽 蚌埠 233300;2.安徽省立医院 介入放射科,安徽 合肥230001)
布加综合征(Budd-Chiari syndrome,BCS)是肝静脉(hepatic vein,HV)和(或)其开口以上的下腔静脉(inferior vena cava,IVC)阻塞导致的淤血性肝损伤,若不及时治疗,最终可进展为肝硬化[1-2]。既往研究发现,缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)、核因子-κB(nuclear factor-κB,NF-κB)是调节BCS病理损伤的重要因子,其在BCS病程中参与调节肝星型细胞活化、细胞外基质沉积、微循环灌注等[3-4],这些均影响细胞内外水分子弥散,理论上可早于肝脏形态学变化而被表观扩散系数(apparent diffusion coefficient,ADC)检测[5]。已有报道ADC值在评估脂肪肝、乙肝后肝硬化等肝损伤中的价值[6],但目前在BCS中的研究报道较少。因此,本研究参照既往文献建立大鼠BCS动物模型[4],动态检测IVC结扎后肝脏ADC值与HIF-1α、NF-κB的变化,初步探讨其在BCS肝损伤中的相关性。
1 材料和方法
1.1 实验动物和试剂
本研究经安徽省立医院伦理委员会批准(编号:20170104),自安徽省立医院动物实验中心购买体质量235~305 g的健康雄性SD大鼠135只[许可证号:SCXK(苏)2005-0001],在12小时明/暗交替光照下,温度15~25 ℃,湿度50%~60%条件下清洁饲养。
3F微导管(日本泰尔茂),RevertAidTM逆转录试剂盒(Thermo Scientific公司),ECL超敏发光试剂盒(Thermo公司),HIF-1α、NF-κB一抗均为兔抗1:300稀释(ZSbio公司),PBS液(ZSbio公司),β-Actin(Santa Cruz公司),PicTureTM检测试剂(Zymed公司),山羊抗小鼠及山羊抗兔IgG购自ZSbio公司。
1.2 实验方法
1.2.1 分组及BCS模型制备:按数字表法将135只大鼠随机分为3组:正常组15只;模型组和假手术组各60只,分为术后1、4、8、12周4个亚组,每亚组15只。大鼠BCS模型制备:常规消毒麻醉后,于剑突下正中开腹分离肝镰状韧带,暴露肝后段IVC,平行紧贴IVC以3 F微导管,并以0号线环绕结扎后抽出,逐层缝合关腹(见图1)。假手术组不结扎肝后段IVC,其他过程同模型组。正常组仅常规饲养,不做任何处理,本研究参考同类研究动物实验设计[7-8],正常组仅观察研究终点12周这个时间点,该组所有时间点相关病理生理数据均用12周的数据进行分析。

图1 模型组结扎IVC
1.2.2 MRI扫描及DSA:MRI扫描:正常组于造模后第12周,模型组及假手术组分别于实验后1、4、8、12周随机取9只大鼠,常规消毒麻醉后,仰卧位腹部加压固定于腕关节线圈中心,以GE HDXT-1.5T磁共振机行常规T1WI、T2WI序列检查及仰卧轴面DWI检查。扫描参数为TR 1 250 ms,TE 65 ms,FOV 55 mm×55 mm,层间距0.2 mm,层厚3.0 mm,反转角90°,激励次数8,矩阵192×192。b值取800 s/mm2,自旋回波-回波平面成像加脂肪抑制。测量各组肝脏ADC值,ROI大小约15~20 mm2,尽量避开胆管、血管及肝脏边缘,分别在肝左、右叶共取2个ROI测得数值的平均值做进一步分析。DSA:各组大鼠于任意一侧下肢消毒、铺巾,以21 G静脉留置针穿刺股静脉,注射对比剂观察IVC血流情况。
1.2.3 HE及免疫组化:正常组于造模后第12周,模型组及假手术组分别于术后1、4、8、12周行MRI检查后,取MRI测量ROI相应层面的新鲜肝组织适量,用10%福尔马林固定24 h,石蜡包埋,制作组织切片,用于HE、免疫组织化学染色。免疫组织化学染色:石蜡切片脱蜡水化,3% H2O2室温孵育5~10 min后PBS冲洗。滴加一抗,室温孵育30~60 min后PBS冲洗。滴加通用型IgG抗体(Fab段)-HRP多聚体,室温孵育10~20 min后PBS冲洗,应用DAB溶液显色,蒸馏水冲洗、复染、脱水、封片。以PBS代替一抗作为阴性对照,采用已知阳性片作为阳性对照,阳性表达为结构清晰的细胞胞浆棕黄染色。
1.2.4 Real-time PCR:肝组织液氮研磨后加入1 mL TRIzol匀浆,严格按照说明书步骤提取总RNA,提取出的RNA逆转录合成cDNA,行Real-time PCR检测。PCR反应条件:95 ℃ 2 min;95 ℃ 5 s,60 ℃ 10 s,40个循环。引物序列:β-actin上游序列:5′-CCCATC TATGAGGGTTACGC-3′,下游序列:5′-TTTAATGTC ACGCACGATTTC-3′;HIF-1α上游序列:5′-TGACCA CTGCTAAGGCATCA-3′,下游序列:5′-GGCTCCTT GGATGAGCTTTG-3′;NF-κB上游序列5′-AAGATCT GCCGAGTAAACCG-3′,下游序列:5′-TCCCGTGAA ATACACCTCAA-3′;基因相对表达量以2-△△Ct计算。
1.2.5 Western blotting:肝组织细胞裂解、离心后收集上清液,按照1:4加入5X SDS-PAGE蛋白上样缓冲液。沸水浴加热10 min,冷却到室温,上样到SDSPAGE胶加样孔内,每孔5~20 μL。浓缩、分离后300 mA恒流转膜90 min。漂洗5 min,室温封闭2 h。一抗4 ℃孵育过夜,加入洗涤液(PBST),每次10 min,共3次,相应二抗室温孵育2 h。加入PBST洗涤液,每次10 min,共3次。使用ECL试剂盒检测蛋白,以Image J软件分析条带灰度值,相对表达量依照内参照结果计算。
1.3 统计学分析
采用SPSS 22.0统计软件进行统计分析,计量资料以(±s)表示,同一时间点各组ADC值、HIF-1α、NF-κB比较采用单因素方差分析;模型组、假手术组组内各亚组比较采用单因素方差分析;两两比较采用LSD检验。ADC与HIF-1α、NF-κB相关性分析采用以Pearson法。以P<0.05为差异有统计学意义。
2 结果
2.1 BCS模型大鼠建模情况
正常组存活15只;假手术组术后1、4、8、12周亚组分别存活15、14、15、15只;正常组及假手术组活动如常、反应机警,DSA均无阳性表现。模型组术后1、4、8、12周亚组分别存活14、13、14、13只,活动逐渐减少、反应迟钝,毛色灰暗,存活大鼠均成功建立BCS模型,肝后段IVC管腔变窄,远端扩张,4周后逐渐见侧支循环形成(图2)。

图2 模型组12周DSA图:肝后段IVC管腔闭塞(红箭),远端扩张,见广泛侧支循环形成(黄箭)
2.2 BCS模型大鼠MRI表现
各组大鼠常规MRI T1WI扫描肝实质信号均匀,肝表面光整(图3A~C)。正常组与假手术组ADC值差异无统计学意义(P>0.05);正常组ADC值均高于模型组(P<0.05);模型组与假手术组ADC值整体差异有统计学意义,随后两两比较,模型组均低于同一时间的假手术亚组(P<0.05),见表1。
模型组ADC值随时间进展先下降后升高,差异有统计学意义(P<0.05,表1);随后各亚组间两两比较,1周组高于4周组、1周组高于8周组、4周组低于12周组,差异均有统计学意义(P<0.05),ADC值在4周组最低,见图3D和表1。
2.3 BCS模型大鼠HE及免疫组化结果
正常组及假手术组大鼠观察至第12周,HE染色均无阳性表现,肝细胞规律排列,形态正常,肝血窦未见明显扩张(图4A~B)。模型组大鼠肝脏病理损伤逐渐加重,1周组肝细胞规律排列,形态正常,肝血窦未见扩张(图4C);4周组肝细胞呈玻璃样变性,肝血窦轻度扩张伴少量红细胞淤积(图4D);8周组肝细胞玻璃样变性加重,肝血窦扩张伴较多红细胞淤积(图4E);12周组肝细胞坏死,胞浆红染,肝血窦明显扩张伴大量红细胞淤积(图4F)。

图3 各组大鼠肝脏T1WI图
表1 各组大鼠ADC值(×10-3 mm2/s)比较(各亚组n=9,±s)

表1 各组大鼠ADC值(×10-3 mm2/s)比较(各亚组n=9,±s)
注:与1周组比,*P<0.05;与4周组比,#P<0.05;与8周组比,△P<0.05;与12周组比,☆P<0.05;正常组 vs 模型4周组、8周组,均P<0.05;假手术组 vs 模型4周组、8周组,均P<0.05。
时间 模型组 假手术组 正常组 F值 P值1周 1.23±0.08#△ 1.26±0.07 1.27±0.08 1.497 0.244 4周 1.03±0.09*☆ 1.28±0.05 1.27±0.08 34.199 0.001 8周 1.12±0.09* 1.28±0.06 1.27±0.08 10.079 0.001 12周 1.18±0.07# 1.27±0.08 1.27±0.08 4.045 0.031 F值 11.184 1.143 — — —P值 0.001 0.934 — — —
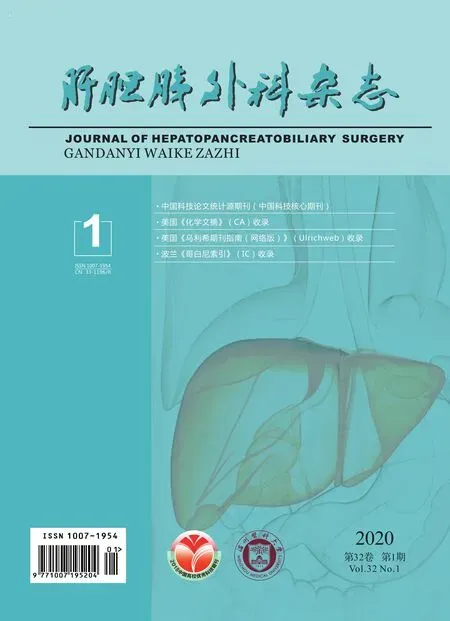
正常组(图5A)、假手术组(图5B)观察至第12周,HIF-1α未见阳性染色,模型组第4周HIF-1α(图5C)阳性染色最显著,位于血管内皮细胞、汇管区间质细胞和胶原组织;正常组(图5D)、假手术组(图5E)观察至第12周NF-κB未见阳性染色,模型组第4周NF-κB(图5F)阳性染色最显著,位于血管内皮细胞、汇管区间质细胞和胶原组织。
2.4 BCS模型大鼠HIF-1α检测结果
组间比较,术后1、4、8、12周,同一时间点,三组之间HIF-1α的mRNA及蛋白表达水平均存在统计学差异,两两比较发现正常组与假手术组无统计学差异(P>0.05),模型组高于假手术组和正常组,差异有统计学差异(P<0.05)。

图4 术后12周各组大鼠肝脏病理图片(HE,×200)
组内比较,随着梗阻时间延长,模型组HIF-1α的mRNA及蛋白水平先升高后下降,BCS模型造模后4周最高,整体差异有统计学意义(F=877.911、333.136,P<0.05),两两比较差异均有统计学意义(P均<0.05)。假手术组内比较无统计学差异。正常组只有一个时间点的数值,不做比较。详见表2和图6。
2.5 BCS模型大鼠NF-κB检测结果
组间比较,术后1、4、8、12周,同一时间点,三组之间NF-κB的mRNA及蛋白表达水平均存在统计学差异,两两比较发现正常组与假手术组无统计学差异(P>0.05),模型组高于假手术组和正常组,差异有统计学差异(P<0.05)。
组内比较,随着梗阻时间延长,模型组NF-κB的mRNA及蛋白水平先升高后下降,BCS模型造模后4周最高,整体差异有统计学意义(F=265.148、334.147,P<0.05),两两比较差异均有统计学意义(P均<0.05)。假手术组内比较无统计学差异。正常组只有一个时间点的数值,不做比较。详见表3和图6。
2.6 各指标间相关性分析
模型组ADC值与HIF-1α、NF-κB负相关;HIF-1α与NF-κB正相关;详见图7A~C和表4。
3 讨论
BCS随着肝静脉回流受阻后淤血缺氧加重,可造成肝细胞水肿、肝微循环障碍、细胞外基质沉积等,导致细胞内外水分子和灌注的改变,可早于肝脏形态学改变被DWI检测[5-6]。
图5 各组大鼠免疫组化图片(×200)
表2 三组大鼠HIF-1α mRNA及蛋白比较(各组n=9,±s)

表2 三组大鼠HIF-1α mRNA及蛋白比较(各组n=9,±s)
组别1周 4周 8周 12周 F(P)值mRNA 蛋白 mRNA 蛋白 mRNA 蛋白 mRNA 蛋白 mRNA 蛋白正常组 1.03±0.11 0.31±0.04 1.03±0.11 0.31±0.04 1.03±0.110.31±0.04 1.03±0.110.31±0.04 - -假手术组 1.05±0.10 0.31±0.03 1.04±0.08 0.30±0.02 1.01±0.090.28±0.04 1.02±0.110.31±0.03 1.022(0.309) 0.714(0.547)模型组 1.70±0.19 0.65±0.04 7.26±0.87 1.28±0.06 4.67±0.241.04±0.07 3.26±0.240.79±0.03 877.911(0.001)333.136(0.001)F值 119.816 253.294 1617.693 1379.092 632.139 1435.154 593.070 1085.194 P值 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001 <0.001
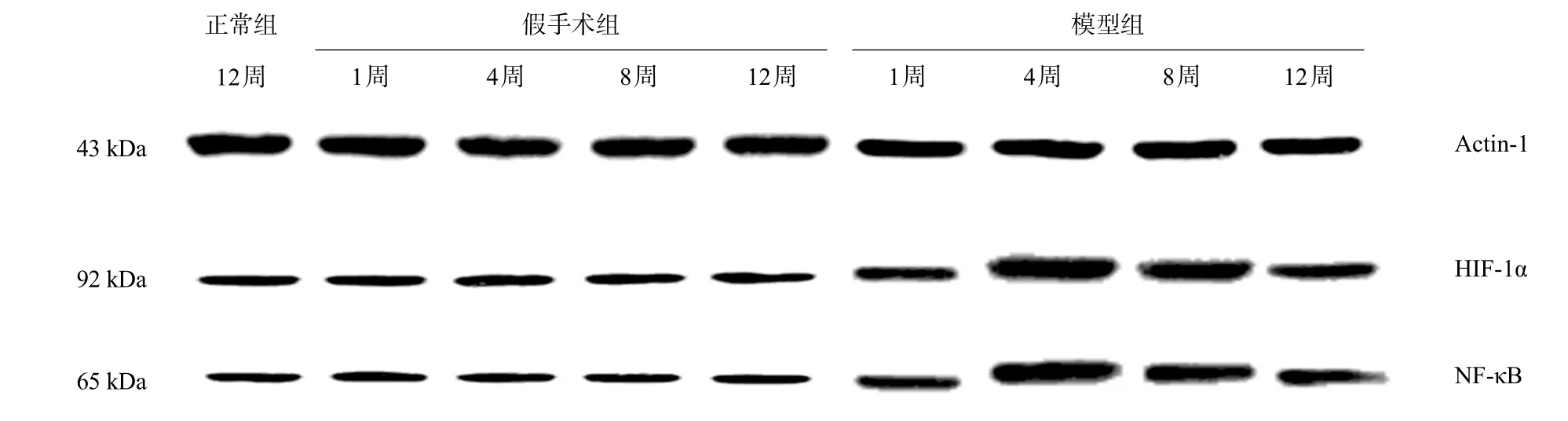
图6 各组HIF-1α、NF-κB蛋白表达图
表3 三组大鼠NF-κB mRNA及蛋白比较(各组n=9,±s)

表3 三组大鼠NF-κB mRNA及蛋白比较(各组n=9,±s)
组别1周 4周 8周 12周 F(P)值mRNA 蛋白 mRNA 蛋白 mRNA 蛋白 mRNA 蛋白 mRNA 蛋白正常组 1.02±0.080.33±0.02 1.02±0.08 0.33±0.02 1.02±0.080.33±0.02 1.02±0.080.33±0.02 - -假手术组 1.01±0.09 0.35±0.04 0.99±0.12 0.36±0.08 1.02±0.100.32±0.06 0.98±0.090.34±0.07 0.482(0.697) 0.861(0.471)模型组 1.79±0.18 0.72±0.09 6.87±0.78 1.45±0.09 4.77±0.641.19±0.12 3.57±0.370.88±0.11 265.148(0.001)334.147(0.001)F值 467.294 158.382 548.342 810.293 576.327 682.753 664.178 187.423 P值 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01 <0.01

图7 各指标相关性散点图

表4 ADC值与HIF-1α、NF-κB相关性分析(相关系数r)
HIF-1α是调节参与细胞对缺氧反应的转录因子,在缺氧期间高表达,进而诱导肝脏损伤[9-10]。NF-κB是与免疫球蛋白K轻链基因增强子B位点特异性结合的核蛋白因子,在各种类型的肝损伤及肝纤维化中发挥作用[11]。本研究发现模型组HIF-1α、NF-κB水平均高于正常组及假手术组,且互为正相关,提示其可能相互调节并参与了BCS模型肝损伤的进展。模型组HIF-1α、NF-κB先升后降,不同于其他原因肝病中随肝损伤进展持续上升的报道[10,12-13],说明其诱导BCS肝损伤的机理有所不同,可能是肝脏淤血缺氧后上调HIF1α表达,激活其下游TGF-β1、PDGF-B等信号转导和上皮间质转化,上调NF-κB,进而诱导肝脏淤血缺氧损伤[12,14];其后随侧支循环缓解淤血缺氧,从而下调HIF-1α、NF-κB的水平,但其始终高于正常,说明侧支循环仅可部分缓解淤血缺氧,而无法从根本解决BCS淤血性肝损伤[15]。
本研究中,模型组ADC值低于正常组及假手术组,说明BCS肝组织存在水分子弥散受限,模型组的ADC值先下降后上升,与HIF-1α、NF-κB水平先上升后下降形成负相关,不同于其他原因肝病中随肝损伤进展持续下降的报道[16-17],这可能是因为随着IVC结扎时间延长,肝淤血缺氧加重,引发HIF1α持续高表达及氧自由基增加,激活NF-κB及TGF-β1等信号,导致其下游靶基因的激活和HSC的活化,抑制ECM降解[12-14];另一方面,HV回流受阻,减弱水分子扩散能力和微循环灌注,肝细胞线粒体肿胀[5],改变细胞膜的流动性和通透性,降低ADC值[5,18],故而与HIF-1α、NF-κB负相关,这与病理结果中肝细胞肿胀、肝窦淤血相符,提示ADC值可反映BCS肝淤血缺氧程度。模型组随着侧支循环建立,缓解淤血缺氧及氧化应激,细胞内外水分子扩散及微循环的代偿性改善表现为ADC值升高以及HIF-1α、NF-κB下调[12-14],这提示三者的变化与淤血缺氧密切相关。然而,ADC值虽有升高,仍低于正常,说明侧支循环虽部分缓解了淤血,但肝脏病理损伤仍缓慢进展,这与大量临床报道相符[15,19],说明只有介入开通梗阻静脉才是治疗BCS的根本手段。
值得注意的是,本研究还存在局限性:大鼠肝脏体积较小,呼吸运动及肺底和腹腔气体等均可能影响ADC值及病理取材的准确性。大鼠生命周期有限,尚无法完美模拟人体长达数十年的BCS病程。
本研究建立大鼠BCS动物模型,动态检测了ADC值、HIF-1α、NF-κB的变化,发现随着IVC结扎时间延长,BCS肝脏ADC值与HIF-1α、NF-κB负相关,三者随着侧支循环缓解淤血缺氧,改善细胞水肿及微血管灌注而升高(下降),说明这几个指标与BCS的肝淤血缺氧损伤存在一定相关性,可作为无创评估BCS肝损伤的一个新的选择。