miR-195通过抑制小胶质细胞自噬促进神经术后持续性疼痛的研究
范宗峙,马刚,史国栋,闫廷飞
(1.中国人民解放军联勤保障部队第988医院骨科,河南 郑州 450042;2.第二军医大学附属长征医院骨科,上海 200003)
神经疼痛广泛发生于神经损伤过程中,多由背根神经节的轴突损伤和异位/自发活动的损伤放电引起[1]。该病发病率较高,在普通人群中的发生率约为7%,中国约有1 600万人罹患神经疼痛并且疗效有限。已有的证据显示中枢神经系统小胶质细胞的激活在神经疼痛形成和维持中起到重要作用[2],同时小胶质细胞的自噬过程参与其免疫炎症反应的调节[3]。我们前期研究发现,miR-195在脊髓神经损伤模型中表达上调[4]。基于背根神经节小胶质细胞与中枢神经系统小胶质细胞功能相似[5],我们检查了脊髓神经结扎模型(spinal nerve ligature model,SNL)术后脊髓小胶质细胞miR-195及自噬水平,以及miR-195模拟物对小胶质细胞的自噬过程及炎症因子的影响,以初步探究在miR-195大鼠术后持续性疼痛中发挥的作用。
1 资料与方法
1.1 实验材料
1.1.1 实验动物 成年雄性SD大鼠购于中国科学院(上海),年龄3~4个月,体重(260±10)g。根据实验动物研究标准的规定,在恒温24℃、昼夜交替环境中饲养,自由摄食、饮水。按随机数字表分成2组(n=18):脊髓神经结扎模型组(SNL组)和假手术组(Sham组)。
1.1.2 主要试剂与仪器 兔源抗LC3多克隆抗体、兔抗大鼠p62多克隆抗体、HRP标记的山羊抗兔IgG(法国Fermentas公司);SYBR Green PCR试剂盒、M-MLV逆转录试剂盒(北京天根生化科技公司);Percoll细胞分离液(北京索莱宝科技有限公司);ECL化学发光试剂盒(广州捷倍斯生物科技有限公司);RIPA细胞裂解液、Trypsin-EDTA细胞消化液,DMEM-H基础培养基,胎牛血清(美国Gibco公司);牛血清白蛋白,TRIzol reagent(美国Invitrogen公司);异氟醚,miR-195模拟物。细胞滤网(BD Biosciences,Alphen aan de Rijn,The Netherlands)、EPPENDORF低温高速离心机;iQ5 Bio-Rad iCycler实时检测系统;TANON凝胶成像分析仪,自动的动态足部触觉测量器(Ugo Basile model 37400,Milan,Italy)。
1.2 方法
1.2.1 大鼠脊髓神经结扎模型制作 实验动物给予异氟醚(2.5%)麻醉后,暴露背部脊柱横截移除左侧L6。分离出L5段神经,用4-0的丝线紧密结扎背根神经节的远端,缝合切口。术后3 d后肌肉注射青霉素预防感染。假手术组模型给予相同的手术处理但是不结扎神经。
1.2.2 脊髓小胶质细胞的分离 术后第1天、第3天、第5天、第10天随机处死4只大鼠,分离腰部膨大部位。将脊髓在4 mL预冷的Hanks’液中磨碎,采用70 μm的细胞滤网过滤并在400 g离心7 min,转移上清获得细胞悬液。15 mL离心管中分别缓慢加入3 mL的75% Percoll、3 mL的50% Percoll,3 mL的5% Percoll及2 mL的PBS。缓慢将细胞悬液加入分离液,10°C条件下1 000 g离心20 min,在50%和75%分界处的细胞即为小胶质细胞。收集后用预冷的PBS清洗,以含有1% BSA的PBS重悬备用。
1.2.3 实时定量逆转录PCR检测miR-195水平 取部分上述小胶质细胞,严格按照说明书要求采用TRIzol reagent提取细胞总核糖核酸(ribonucleic acid,RNA),M-MLV逆转录试剂盒进行逆转录。以U6和β-actin分别作为miR-195和mRNAs的内参,使用SYBR Green PCR试剂盒和Rotor-Gene RG-3000A进行实时定量PCR反应,2-ΔΔCt法进行基因表达水平的定量分析。每个样本分析3次。
1.2.4 Western blot检测LC3与p62蛋白的表达 取部分1.2.2所述方法获得的小胶质细胞,以β-actin为内参进行Western blot检测。PBS洗涤后加入细胞裂解液于冰上涡旋裂解30 min。15 000 r/min离心裂解物15 min后收集上清液,取30 μL上述样本分别加入4×SDS-PAGE上样缓冲液煮沸5 min,上样至120 g/L SDS-PAGE胶电泳。结束后,将凝胶上的蛋白电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,以含50 g/L脱脂奶粉的磷酸盐吐温缓冲液(phosphate buffered saline tween-20,PBST)封闭3 h。根据分子量标记剪下LC3与p62对应位置的PVDF膜,分别转移至兔源抗LC3多克隆抗体与兔抗大鼠p62多克隆抗体(1︰1 000),37℃孵育2 h,PBST清洗3次,加入HRP标记的山羊抗兔IgG(1︰4 000),37℃孵育1 h,PBST清洗3次,增强化学发光法(enhanceed chemi-luminescence,ECL)化学发光法显色曝光。
1.2.5 鞘内给药与效应分析 如1.2.1所述方法进行分组手术后经腰椎穿刺进行鞘内给药。将32号的探针插入脊柱的L5和L6之间,手术当天到术后4 d隔日给予大鼠miR-195模拟物以及2-O-甲基化修饰的miR-195抑制剂3 μg。采用自动的动态足部触觉测量器测试机械刺激缩足反应阈值。最大值为50 g,达到最大值会自动断开。每个爪子的阈值为3次连续测量的平均值,每次测量的时间间隔至少为10 min。对触摸痛进行检测时给予大鼠后爪足底部50 μL丙酮。每个后爪交替给予2次,每次连续给药的间隔为5 min。丙酮给予2 min后检测反应。连续检测3 d后处死大鼠,Percoll密度梯度离心法分离脊髓小胶质细胞,Western Blot检测LC3、p62及促炎因子白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)。
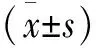
2 结 果
2.1 脊髓神经结扎引起小胶质细胞miR-195表达升高 为探究脊髓神经结扎对大鼠脊髓小胶质细胞miR-195表达的影响,我们建立了大鼠脊髓神经结扎模型,并通过Percoll密度梯度离心法分离脊髓小胶质细胞,采用逆转录实时定量PCR检测miR-195的表达水平。结果表明在术后第1天、第3天、第5天、第10天时SNL组miR-195的表达水平均高于Sham组,并且SNL组内miR-195的表达水平呈现逐渐升高的趋势,表明脊髓神经结扎是脊髓小胶质细胞miR-195表达的刺激因素(见图1)。

注:*代表与sham组(对照组)相比差异具有统计学意义
2.2 脊髓神经结扎引起小胶质细胞自噬水平降低 为探究脊髓神经结扎对大鼠脊髓小胶质细胞自噬水平的影响,我们检测了自噬体膜标记蛋白LC3以及多功能泛素结合蛋白p62。LC3Ⅰ酯化为LC3BⅡ后才能锚定于自噬体膜上,故而LC3BⅡ的表达升高是自噬功能活化的标志之一;而p62通过连接LC3和泛素介导蛋白降解,其表达量与自噬水平呈负相关。SNL后的第1天、第3天、第5天、第10天时LC3-Ⅱ/LC3-Ⅰ的表达下调,同时p62表达水平升高,提示SNL后小胶质细胞自噬过程受到抑制(见图2)。

a 自噬体膜标记蛋白LC3-Ⅱ/LC3-Ⅰ表达比值

b 多功能泛素结合蛋白p62表达水平
2.3 miR-195的模拟物对大鼠行为的影响 为明确miR-195在脊髓神经结扎引起大鼠神经痛中的作用,我们于在体条件下给予miR-195的模拟物,观察其对大鼠行为学水平的影响。结果显示鞘内给予miR-195的模拟物可缩短机械刺激缩足阈值并对热刺激敏感,且这种效应维持在注射后至少3 d(见图3)。
2.4 miR-195模拟物引起小胶质细胞炎症因子增加与自噬抑制 两组大鼠鞘内给予miR-195的模拟物后,我们采用Western Blot法检测脊髓小胶质细胞炎症因子IL-1β,TNF-α和iNOS表达水平及自噬标记蛋白LC3、p62表达水平。结果表明鞘内给予miR-195模拟物诱使大鼠脊髓背角小胶质细胞的炎症因子表达增加,与此同时LC3-Ⅱ/LC3-Ⅰ的表达下调而p62表达水平升高,提示miR-195模拟物抑制小胶质细胞自噬(见图4)。

a 机械刺激缩足阈值 b 热刺激缩足阈值

a 炎症因子表达水平 b 脊髓小胶质细胞的自噬水平
注:*代表与对照组相比差异具有统计学意义
图4 miR-195的模拟物引起小胶质细胞炎症因子表达增加与自噬抑制
3 讨 论
小胶质细胞是定位于中枢神经系统的巨噬细胞,是脊髓水平炎症因子的主要来源,而这些促炎因子在神经疼痛的形成和维持中发挥着重要作用[6]。在坐骨神经炎性病变、慢性压迫性神经损伤、部分坐骨神经结扎和脊神经结扎等各种慢性神经疼痛模型中,痛觉过敏的出现均伴有小胶质细胞的显著活化[7]。尹显和等[8]建立的术后持续性疼痛大鼠模型中,脊髓小胶质细胞活化水平于术后3~7 d明显升高,术后12 d恢复到术前水平。因此我们利用大鼠建立了脊髓神经结扎模型,着力探究脊髓小胶质细胞在持续性疼痛中的分子机制。
近年来的研究表明,miRNAs可能是神经免疫和神经疼痛的重要调节因子[9、10]。Aldrich等[11]发现miR-96,miR-182,miR-183在成年大鼠的背根神经节中高表达,脊髓神经结扎后这些miRNAs的表达大幅度下调,认为它们可能通过转录调节疼痛相关基因的表达导致慢性疼痛。Favereaux等[12]则观察到神经疼痛动物中miR-103表达下降,鞘内给予miR-103可成功的缓解疼痛,提示miRNAs可能成为治疗慢性疼痛的新靶点。而我们的前期研究发现,大鼠脊髓神经结扎模型中后脊髓背角miR-195的表达增加,且增加的峰值及持续时间与术后痛觉过敏程度保持一致,提示miR-195可能参与术后持续性疼痛[4]。据此,我们分离了结扎后脊髓小胶质细胞并检测其miR-195表达水平,结果显示术后2~14 d miR-195表达水平均显著高于假手术组并且持续升高,证明脊髓背角miR-195表达的增加主要来源于小胶质细胞。
Zhou等[13]发现缺血脑损伤后通过激活小胶质细胞自噬可抑制免疫炎症反应,抑制小胶质细胞自噬可增加损伤后炎症反应。Ma等[14]认为小胶质细胞的自噬有助于其活化和随后的炎症反应,然而具体机制仍不明确。基于细胞自噬对于免疫炎症反应的调节功能,我们采用LC3与p62两个自噬标志分子作为指标,检测了脊髓结扎术后小胶质细胞的自噬水平。本研究中,L5脊髓神经结扎后脊髓背角中小胶质细胞自噬水平明显下降,且持续至术后至少10 d,与miR-195的表达水平呈负相关。为探究miR-195表达升高与自噬抑制的关系,我们采用了miR-195模拟物对术后大鼠进行鞘内注射,并检测炎症因子与自噬水平,以及大鼠行为学的变化以衡量神经疼痛程度。有趣的是,miR-195模拟物显著抑制自噬水平并且促进炎症因子的表达,与此同时大鼠械刺激缩足阈值降低并对热刺激敏感,表明miR-195可能通过抑制细胞自噬,从而促进了炎症因子的表达,参与术后神经疼痛的产生和维持。
总之,本研究初步证明miR-195通过调节小胶质细胞的自噬过程影响其炎症反应,在神经损伤后持续性疼痛中发挥重要作用,这为研究临床术后持续性疼痛的治疗提供了新的思路和药物作用靶点。此后,我们将进一步探究miR-195抑制小胶质细胞自噬的机制,以更深入的阐明神经损伤后持续性疼痛的分子机制。

