抗菌肽产生菌侧孢短芽孢杆菌高产菌选育
郄丽萍,马 婕,李丽红,代明伟,张雪霞,任风芝
(华北制药集团新药研究开发有限责任公司 微生物药物国家工程研究中心河北省工业微生物代谢工程技术研究中心,河北 石家庄 052165)
侧孢短芽孢杆菌是既能抗菌、杀虫又有医用价值的微生物资源,具有多种生物学活性及广谱抗菌活性,尤其是对细菌和真菌。国外文献报道较多的抗菌物质有肽类抗生素、非肽类的芽孢菌胺、几丁质酶以及聚酮化合物等[1]。其中抗菌肽是一类具有高效、广谱抗菌活性的小分子碱性多肽[2-3],耐热性、pH值稳定性、储藏稳定性好,具有无毒副作用、无残留、无耐药性等特点[4]。同时,抗菌肽对畜禽具有促生长、保健和治疗疾病的功能,在作为无公害饲料添加剂、药物等方面具有巨大的潜在应用前景。
等离子体诱变技术是通过对细胞有影响的荷电粒子、光、中性粒子等离子体对生物遗传物质及表层造成损伤,引起细胞自我修复,从而导致生物体基因的改变。等离子体诱变技术可以较大程度地提高诱变效率,提高细胞存活率,是一种适合于微生物诱变育种的技术[5]。
由于实验室保存的侧孢短芽孢杆菌产抗菌肽菌株发酵单位偏低,为提高产抗菌肽菌株的产量,作者采用对数生长期的菌体作为诱变对象,利用常压室温等离子体(ARTP)诱变技术筛选抗菌肽高产菌株,以降低生产成本,为工业化生产奠定基础。
1 实验
1.1 菌株、培养基与仪器
侧孢短芽孢杆菌(Brevibacilluslaterosporus)KT-06,本实验室保存。
斜面及固体培养基(LB):胰蛋白胨1%,酵母粉0.5%,NaCl 1%,琼脂1.5%~2.0%,pH值调至7.2~7.4,121 ℃下灭菌20 min。
种子培养基:胰蛋白胨1%,酵母粉0.5%,NaCl 1%,pH值调至7.2~7.4,121 ℃下灭菌20 min。
发酵培养基:葡萄糖2%,玉米浆0.5%,酵母粉0.5%,CaCl20.15%,ZnCl20.005%,pH值调至7.2~7.4,121 ℃下灭菌30 min。
营养琼脂培养基:胰蛋白胨0.6%,牛肉浸膏0.15%,酵母浸出粉0.6%,葡萄糖0.1%, K2HPO40.2%,KH2PO40.8%,琼脂1.5%~2.0%,pH值调至6.0,121 ℃下灭菌20 min。
ARTP-ⅡS型诱变育种仪,无锡源清天木生物科技有限公司;LC-2030C型高效液相色谱仪,岛津。
1.2 方法
1.2.1 菌悬液的制备
将侧孢短芽孢杆菌KT-06斜面菌种挖块(0.5 cm×1.0 cm)接种于种子培养基(40 mL/250 mL三角瓶)中,37 ℃、200 r·min-1振荡培养6~10 h;取2 mL加入6 mL无菌生理盐水中,菌悬液浓度达到107CFU·mL-1。
1.2.2 ARTP诱变[6]
取10 μL菌悬液滴加在无菌不锈钢载片上,将载片置于诱变育种仪中,按设计时间进行照射;然后将载片投入装有1.5 mL无菌生理盐水的EP管中,振荡洗涤,混匀,稀释菌悬液后分离涂布到LB培养基平板上,37 ℃暗培养3 d,计数。
1.2.3 摇瓶培养
挖块(0.5 cm×1.0 cm)斜面培养成熟菌种,接种于种子培养基(40 mL/250 mL三角瓶)中,37 ℃、200 r·min-1振荡培养12~16 h,以5%的接种量接种到发酵培养基(40 mL/250 mL三角瓶)中,37 ℃、200 r·min-1振荡培养25~30 h。
1.2.4 发酵液抑菌活性的测定
抗菌肽抑菌活性的测定采用琼脂扩散法。以藤黄八叠菌CMCC 28001为指示菌,用无菌生理盐水将其稀释到107CFU·mL-1。将100 mL营养琼脂培养基倒入直径195 mm平皿中,冷却凝固;取0.2 mL指示菌菌悬液置于100 mL冷却至50~60 ℃的营养琼脂培养基中,混匀倒板,冷却凝固。适当位置放置牛津杯,向牛津杯中加入300 μL离心发酵液,置于37 ℃培养箱中培养16 h,用游标卡尺测量透明圈直径(mm)。
1.2.5 发酵液HPLC分析条件
取发酵液2 mL,100 ℃ 水浴20 min,13 000 r·min-1离心12 min,取上清液,进行HPLC分析。
HPLC条件:C18 柱(4.0 mm×250 mm,5 μm);A相1‰三氟乙酸,B相纯乙腈,梯度洗脱(条件见表1);检测波长200 nm,进样温度35 ℃,进样量15 μL,进样流速1 mL·min-1;tR7.28 min,tC15 min。
表1梯度洗脱条件

Tab.1 Gradient elution condition
2 结果与讨论
2.1 ARTP诱变剂量(处理时间)的选择
在LB培养基平板上涂布经ARTP诱变处理不同时间的菌悬液,37 ℃培养3 d,以未诱变处理的菌悬液作为对照,计算致死率;摇瓶筛选ARTP诱变处理不同时间的菌落,计算突变率,结果见表2。
表2ARTP处理时间对处理效果的影响
Tab.2 Effect of ARTP treatment time on treatment efficiency
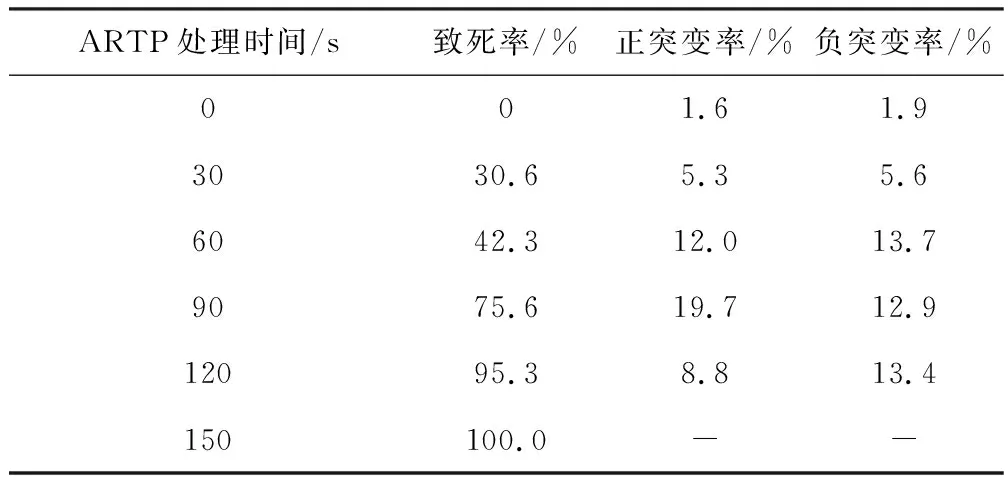
ARTP处理时间/s致死率/%正突变率/%负突变率/%001.61.93030.65.35.66042.312.013.79075.619.712.912095.38.813.4150100.0--
由表2可知,随着ARTP诱变处理时间的延长,致死率逐渐升高;ARTP诱变处理90 s时,正突变率最高。因此,确定最佳ARTP诱变处理时间为90 s。
2.2 突变株摇瓶筛选
采用最佳诱变剂量对菌悬液进行ARTP诱变。第一轮ARTP诱变处理,摇瓶初筛菌株共计212株,获得36株发酵单位提高20%以上菌株;复筛3批后,获得高产菌株KT-3-15,比KT-06产量提高25.5%。进一步对菌株KT-3-15进行ARTP诱变处理,摇瓶初筛菌株共计236株,获得43株发酵单位提高20%以上菌株;复筛3批后,获得高产菌株KT-4-128,比KT-3-15产量提高33.5%,比出发菌株KT-06产量提高67.5%。
2.3 菌种选育系谱图
2.4 高产菌传代稳定性实验
菌种传代稳定性是决定菌种能否工业化生产的关键。采用斜面传代、摇瓶验证的方法,考察新菌株的传代稳定性。连续传代4次,摇瓶验证结果见表3。
表3菌株KT-4-128的传代稳定性/%

Tab.3 Genetic stability of strain KT-4-128/%
由表3可知,连续传代4次,相对发酵转化率稳定,表明新菌株遗传特征稳定,适合工业化生产。
3 结论
以抗菌肽产生菌侧孢短芽孢杆菌(Brevibacilluslaterosporus)KT-06为出发菌株,进行两轮ARTP诱变处理,获得一株具有稳定遗传性的高产菌株KT-4-128,该菌株发酵水平比出发菌株提高了67.5%。表明ARTP技术可有效应用于侧孢短芽孢杆菌的诱变选育,可大幅提高抗菌肽的发酵单位,为其工业化生产奠定了基础。

