珍龙醒脑对血管性痴呆大鼠海马CA1区自噬相关蛋白表达的影响*
★ 章国良 项颖卿 饶丽华 徐向群(.江西省中西医结合医院 南昌 330003;.江西科技学院 南昌 330098)
自噬是细胞受到刺激后溶酶体对自身受损的细胞器和大分子物质的吞噬降解,包括自噬诱导、形成自噬体膜、形成自噬体、自噬体与溶酶体的融合以及降解内容物等过程[1]。众多研究表明,在缺血性损伤之前激活内源性自噬水平可产生神经保护作用[2]。在缺血性损伤发生后过度自噬反而恶化神经元损伤(自噬性细胞死亡)[3]。自噬的发生机制较为复杂,多条信号通路参与了自噬的调节,如PI3K/Akt/mTOR信号通路、AMPK-mTORC1 信号通路、MAPK信号通路、核因子 NF-κB介导的信号通路等[4]。本实验室前期研究发现,珍龙醒脑能促进血管性痴呆大鼠脑组织P13K和Akt蛋白表达,发挥神经保护作用[5]。本研究主要观察珍龙醒脑是否能激活PI3K/Akt通路下游基因mTOR活性,抑制神经细胞自噬性死亡,观察该药对自噬相关基因Beclin-1表达和自噬活性微管相关蛋白1轻链3(LC3)II与I比值的影响,为珍龙醒脑临床应用提供实验依据。
1 材料与方法
1.1 实验动物 健康成年雄性SD大鼠,鼠龄3~4个月,体重(250±30)g,购买自江西中医药大学动物科技中心,生产合格证号SCXK(赣)2018-0003。实验前普通饲料适应性喂养1周,饲养温度24~26℃,普通光照。
1.2 药物与试剂 珍龙醒脑胶囊(青海金诃藏药药业股份有限公司,批号:国药准字Z20026000),包含紫檀香、西红花、珍珠、诃子、塞北紫堇、冬葵果、短穗兔耳草、余甘子、诃子、麝香、木香、人工牛黄等29味中药,规格0.3g/粒,用0.5%羧甲基纤维素钠溶液制备成10mg/mL的混悬液。自噬相关蛋白LC3和Beclin-1兔抗鼠多克隆抗体,由北京中杉金桥生物技术有限公司生产。SP 法免疫组化染色试剂盒,DAB显色试剂盒,均由北京博奥森生物技术有限公司生产。
1.3 分组与给药 72只SD大鼠随机分为假手术组、模型组、珍龙醒脑组,每组又分为造模术后1周、2周、4周和8周4个亚组,每组6只。造模成功后给予珍龙醒脑混悬液200 mg/kg灌胃,假手术组和模型组给予等量生理盐水,1次/d,各亚组分别给药1周、2周、4周和8周。
1.4 造模及取材 采用双侧颈总动脉夹闭法制作VD模型[6]。在相应时间段取大鼠称重,采用10%水合氯醛腹腔注射(350mg/kg)进行麻醉,暴露颈部手术视野,碘伏消毒,取正中矢状切口,依次切开皮肤、皮下组织和筋膜,无齿镊在双侧颈动脉三角处钝性分离迷走神经,游离出颈总动脉,取4号丝线结扎双侧颈总动脉,阻断血流,缝合切口。假手术组除不结扎阻断颈总动脉外,其余手术步骤相同。手术过程中大鼠肛温控制在36℃~37℃,防止低温对脑缺血损伤产生的保护作用,术后注射青霉素20万U预防感染。造模3天后,按Longa5分评分法对各组大鼠进行脑缺血损伤评分,2分及以上者为造模成功。模型制作成功后,在各时间点取材,水合氯醛过量麻醉,大鼠仰卧于操作台上,迅速开胸暴露心脏,取输液导管自升主动脉插管后固定针头,剪开右心耳,快速灌注0.9%NS溶液250mL,待大鼠肝脏血管床变苍白,流出灌注液清澈后,用4%多聚甲醛250mL灌注,直到大鼠身体抽动,头部变硬,断头取脑,去除嗅球、小脑和脑干。冰盘上迅速分离大脑半球,取视交叉前后约3mm范围的冠状切片,放人10%福尔马林中固定,24h之内石蜡包埋、切片。
1.5 海马CA1区mTOR、Beclin-1蛋白表达检测 取石蜡切片,脱蜡至水。采用SP免疫组化法观察mTOR、Beclin-1蛋白表达。阴性对照组以0.01MPBS代替一抗,其余步骤不变。高倍镜下随机选取海马CAl区不重叠6个视野,计数每个视野阳性细胞数,取平均值。
1.6 海马CA1区LC3II/I比值检测 采用Westernblot法检测大鼠海马LC3蛋白表达。各组在相应时间点分别取6只大鼠,10%水合氯醛腹腔注射(350mg/kg)进行麻醉,断头取脑。冰盘上迅速分离大脑半球,用4℃PBS清洗,分离出海马。向其中加入裂解液,充分裂解,移至1.5mL离心管中,然后在4℃下12000rpm离心10min,提取海马总蛋白,并测定蛋白浓度。SDS-PAGE电泳法进行蛋白质分离后经转膜,封闭,加入LC3抗体放置4℃冰箱孵育12h。TBST 清洗一抗,加二抗室温孵育1h,TBST 洗脱二抗,滴注ECL 发光液显色。用Quantity-One 图像分析软件测定目的蛋白条带与内参条带的光密度值,计算目标蛋白表达量。
2 结果
2.1 对大鼠海马CA1区mTOR蛋白表达的影响 在光学显微镜下,mTOR阳性细胞被染色成棕黄色,主要在神经元的核膜、胞浆及轴突表达。假手术组未见或仅见少量mTOR阳性细胞。模型组可见海马CA1区内有大量mTOR阳性细胞存在。结果显示,双侧颈总动脉阻断血流后1周,mTOR阳性细胞表达呈现上升趋势,此后mTOR逐渐升高,至第4周达到高峰,第8周呈现下降趋势。模型组和珍龙醒脑组各时间段mTOR阳性细胞表达数量均高于假手术组,差异均有统计学意义(P<0.01)。珍龙醒脑组各时间段mTOR阳性细胞表达数量与模型组比较明显增加,均有统计学意义(P<0.01)。见表1。
表1 珍龙醒脑对大鼠海马CA1区mTOR蛋白表达的影响(±s,n=24) 分
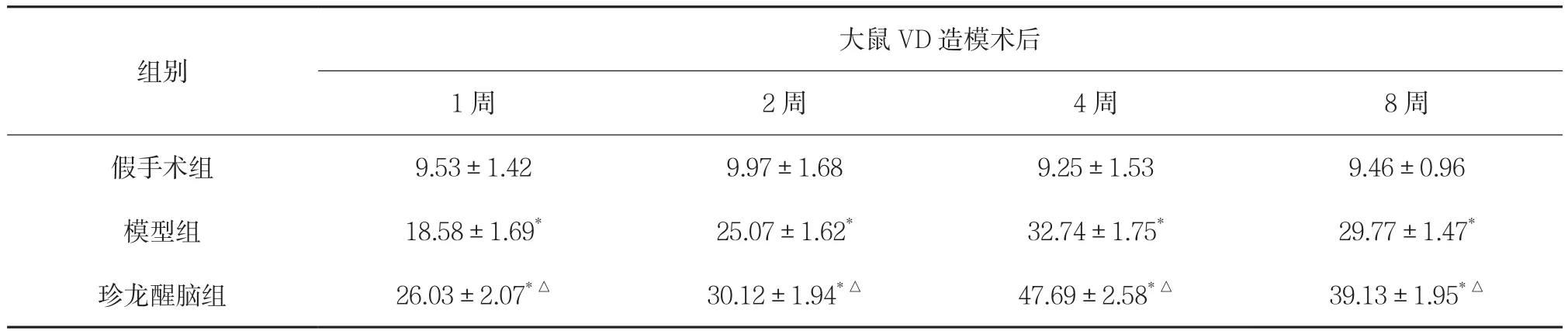
表1 珍龙醒脑对大鼠海马CA1区mTOR蛋白表达的影响(±s,n=24) 分
注:与假手术组比较,*P<0.01;与模型组比较,△P<0.01。
组别大鼠VD造模术后1周 2周 4周 8周假手术组 9.53±1.42 9.97±1.68 9.25±1.53 9.46±0.96模型组 18.58±1.69* 25.07±1.62* 32.74±1.75* 29.77±1.47*珍龙醒脑组 26.03±2.07*△ 30.12±1.94*△ 47.69±2.58*△ 39.13±1.95*△
2.2 对大鼠海马CA1区Beclin-1蛋白表达 在光学显微镜下,Beclin-1阳性细胞被染色成棕黄色,主要表达在神经元的核膜、胞浆,少量在轴突表达。假手术组未见或仅见少量Beclin-1阳性细胞。模型组可见海马CA1区内有大量Beclin-1阳性细胞存在。结果显示,双侧颈总动脉阻断血流后1周,Beclin-1阳性细胞表达呈现上升趋势,此后Beclin-1逐渐升高,至第4周达到高峰,第8周呈现下降趋势。模型组各时间段Beclin-1阳性细胞表达数量明显高于假手术组,差异有统计学意义(P<0.01)。珍龙醒脑组各时间段Beclin-1阳性细胞表达数量与模型组比较明显减少(P均<0.01)。见表2。
表2 珍龙醒脑对大鼠海马CA1区 Beclin-1蛋白表达的影响(±s,n=24) 个

表2 珍龙醒脑对大鼠海马CA1区 Beclin-1蛋白表达的影响(±s,n=24) 个
注:与假手术组比较,*P <0.01;与模型组比较,△P <0.01.
组别大鼠VD造模术后1周 2周 4周 8周假手术组 10.10±1.38 10.55±1.57 10.44±1.59 10.46±1.13模型组 22.16±1.75* 32.15±1.47* 53.33±2.36* 37.27±1.99*珍龙醒脑组 20.56±1.33*△ 28.07±1.69*△ 36.34±1.86*△ 22.57±1.64*△
2.3 对大鼠海马CA1区LC3-II/LC3-I比值的影响 蛋白免疫印迹结果显示,与假手术组比较,模型组与珍龙醒脑组各时间段LC3-II/LC3-II比值明显增高,以第4周比值升高最显著,8周后呈现下降趋势。各时间段亚组与模型组比较,大鼠海马CA1区LC3-II/LC3-I比值均明显降低(P<0.05或P<0.05)。见表3。
表3 珍龙醒脑对大鼠海马CA1区LC3-II/LC3-I比值的影响(±s,n=24)

表3 珍龙醒脑对大鼠海马CA1区LC3-II/LC3-I比值的影响(±s,n=24)
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.05,△P<0.01.
组别大鼠VD造模术后1周 2周 4周 8周假手术组 0.30±0.05 0.31±0.02 0.31±0.03 0.31±0.06模型组 0.46±0.07* 0.49±0.04* 0.55±0.08* 0.43±0.04*珍龙醒脑组 0.40±0.04*# 0.42±0.02*△ 0.44±0.05*△ 0.38±0.02*#
3 讨论
自噬广泛存在于真核生物中,是一高度保守的细胞内长寿蛋白和细胞器的降解途径,参与清除细胞废物、结构重建和生长分化等[7-8]。自噬一方面是细胞对细胞应对外界刺激如饥饿或氧化应激等的一种保护性反应,适度激活可以帮助细胞降解坏死的细胞器,清除异常蛋白、防止蛋白聚集,从而发挥对细胞的保护作用,另一方面,过度的自噬在大量降解坏死细胞器的同时,过度消耗细胞的能量,可诱导自噬性细胞死亡,即II 型程序性细胞死亡[9]。研究证实,在VD损伤中,海马自噬相关蛋白表达以及自噬活性有显著增高[10-11]。
PI3K/AKT/mTOR信号通路在细胞自噬过程中发挥着极其重要作用,mTOR作为该通路中调控自噬的重要位点,它的活性是自噬体形成、成熟的关键[12]。mTOR可抑制自噬起始分子ULKl的活性,降低缺血性脑损伤神经元自噬的发生水平[1]。Beclin1是酵母Apg6/Vps30基因的同源物,是介导哺乳动物自噬过程的首个被确认的基因。Beclin-1可以与 PI3K结合形成复合物,其可以招募胞浆中的Atg5复合物和LC3,进而促进自噬体扩张伸展,形成完整自噬体,参与自噬体膜的早期形成[13]。Beclin1是细胞自噬过程中重要的正性调节因子,常作为衡量自噬水平的重要参考指标[10]。LC3是哺乳动物细胞中酵母Atg8基因的同源物,主要作用于自噬体后期形成过程中,即前自噬体的延长和闭环[14]。LC3可分为 LC3-I和 LC3 II 两种形式。LC3 前体(pro-LC3)先被Atg4切割,形为胞浆型的LC3I。LC3I经过剪切和泛素化加工修饰,与自噬体膜表面的磷脂酰乙醇胺相结合,形成LC3-II。LC3-II定位于膜结构的前自噬体或自噬体,是自噬体的标记性蛋白[15]。LC3 II总量或者膜结合型LC3II与胞浆可溶性LC3 I的比值可定量评估自噬水平,是反映自噬活性高低的一个有效指标[16]。
本研究发现,大鼠VD造模术后1周,Beclin-1阳性细胞表达呈现上升趋势,LC3II/LC3 I比值升高,至第4周达到高峰,第8周回落,表明神经元发生了自噬;这一结果与国内学者[10-11]相关报道一致。经过珍龙醒脑灌胃治疗后,与模型组比较,VD大鼠海马CA1区LC3II/LC3 I比值降低,Beclin 1蛋白表达减少。提示珍龙醒脑可以抑制自噬相关蛋白Beclin-1和LC3的产生,减少LC3II/LC3 I比值,抑制神经元过度自噬现象。课题组前期动物实验发现,珍龙醒脑胶囊制成混悬制剂灌胃,能促进VD大鼠海马CA1区PI3K和Akt蛋白表达,改善VD大鼠的空间探索能力和学习记忆能力[5]。本研究采用免疫组化检测PI3K/AKT信号通路下游因子mTOR蛋白表达,结果显示VD组大鼠mTOR蛋白表达在各时间点均增高。与模型组比较,使用珍龙醒脑灌胃后,VD大鼠的mTOR蛋白表达呈现进一步升高趋势,至第4周达到高峰值,提示,mTOR信号通路在细胞过度自噬过程中发挥抑制作用,珍龙醒脑能促进PI3K和Akt蛋白表达,激活mTOR活性,降低LC3II/LC3 I比值,抑制VD大鼠海马神经元过度自噬,从而减轻神经元损伤,发挥神经保护作用。本研究未涉及到PI3K/AKT/mTOR信号通路抑制剂,有待在今后的实验研究中进一步完善。

