HMMR-AS1介导EMT在宫颈癌顺铂耐药中的作用*
舒琪 马辉平 樊阳阳 杨雅荣
宫颈癌(cervical cancer,CC)是我国乃至全球最常见的妇科肿瘤之一[1-4],在女性肿瘤发病率中居第二位,2018年全球新发乳腺癌病例约57万例,死亡病例约31万例[3]。我国每年约13万新发病例,其中5.3万人将会因为宫颈癌死亡[5]。宫颈癌是一个严重威害女性健康的恶性肿瘤,其高死亡率的主要原因之一即为化疗耐药。文献报道HMMR-AS1(hyaluronan mediated motility receptor- antisense 1)定位于人类染色体5p34,全长1 269 bp,且其表达量在乳腺癌人群中与其互补基因HMMR成正相关,敲低HMMRAS1能够下调HMMR的表达,进而影响乳腺癌细胞的侵袭和迁移能力[6],且能够通过介导EMT在上皮性卵巢癌耐药[7],但是尚未见到其在宫颈癌中所起作用的报道。本研究通过系列细胞及分子生物学实验验证了HMMR-AS1介导EMT在宫颈癌耐药中所起作用,现报道如下。
材料与方法
1 研究对象 本研究所用到的63例宫颈癌组织及对应的癌旁正常组织标本均为2010年1月~2014年12月收集于本院妇科,追踪随访时间最短5个月,最长57个月,且均有追踪随访资料。平均年龄(56.8±11.7)岁。患者相互之间不存在血缘关系,详见表1。
2 细胞与试剂 宫颈癌细胞系Hela购买自中国科学院上海细胞库。所用培养基为DMEM培养基,含10%胎牛血清,培养环境为37℃,5% CO2,饱和湿度。细胞裂解液TRizol购买自Life Technologies公司,逆转录试剂盒购买于TAKARA公司。胎牛血清购买于逍鹏生物公司(Biological Industries,Israel);8μm孔径transwell小室购买于CORNING公司;HMMR-AS1过表达质粒订购于吉凯公司,转染试剂Lipofectamine 2000购买于Invitrogen公司;引物订购于上海生工。氟尿嘧啶及顺铂订购于逍鹏生物公司。E-cadherin抗体、vimentin 抗体、GAPDH 均从ABCAM公司购买。LV201过表达载体及空白对照载体购买自复能基因公司。
3 qPCR 采用TRizol法提取肿瘤组织及对应癌旁正常组织totalRNA,并使用TAKARA反转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)反转录制备cDNA文库;使用ABI 7500 PCR仪进行实验,qPCR Mix 选用SYBR Green PCR Master Mix,反应体系根据其说明书配置,结果采用2-ΔΔCt法进行分析;使用ACTB作为内参基因,基因相对表达量以癌组织表达量高于对应癌旁正常组织为高表达,反之为低表达。
4 细胞转染实验 本研究拟通过慢病毒载体转染升高HMMR-AS1在宫颈癌细胞中的表达水平和增强细胞迁移的能力,并且检测其对常见化疗药物(例如:顺铂) 敏感性的影响。转染所用试剂为Lipofectamine 3000(Invitrogen),操作步骤严格按照其说明书筛选稳定高表达该lncRNA的细胞株用于后续检测。
5 CCK-8实验 取转染后处于对数生长期细胞用于此实验。实验中,取胰蛋白酶消化重悬后的细胞计数,接种于96孔培养板中,每孔接种200个细胞,每组设置5个平行孔;接种5个96孔板用于不同时间点(0 h,24 h,48 h,72 h,96 h)加入CCK-8试剂后在450 nm波长下检测其吸光度值,吸光度值愈高则表示孔内细胞越多。
6 化疗药物敏感性实验 取转染后处于对数生长期的细胞,加入化疗药物后,检测各组细胞的生长情况,通过HMMR-AS1表达水平的高低考察其对化疗药物敏感性差异的影响。实验中,取胰蛋白酶消化重悬后的细胞计数,接种于96孔培养板中,每孔接种2×104个细胞,每组设置5个平行孔;按对数浓度梯度设置化疗药物(5-FU、顺铂)的浓度梯度加药,常规培养24小时后PBS清洗96孔培养板,加入含20%CCK-8试剂的培养基,2小时后在450 nm波长下检测其吸光度值,吸光度值愈高则表示孔内细胞越多。
7 Western blot实验 取转染后处于对数生长期细胞用于此实验,采用Western blot进行分析[8]。
8 统计学处理 应用实验SPSS13.0软件,采用配对t检验分析癌组织和对应癌旁正常组织中lncRNA表达水平的差异,采用卡方检验和独立样本t检验分析不同宫颈癌患者临床特征及疾病进展中lncRNA表达水平的差异,采用K-M法绘制生存曲线,用log-rank检验不同组患者生存时间之间的差异。采用独立t检验分析细胞迁移和侵袭能力差异;采用重复测量的方差分析方法分析细胞增殖能力的差异(CCK-8实验及化疗药物敏感性实验)。所有检验均为双侧检验,α=0.05,P<0.05表示差异有统计学意义。
结 果
1 HMMR-AS1在宫颈癌组织中高表达 本次研究采用qPCR检测了所有63对宫颈癌-癌旁正常组织,癌组织中的表达量显著高于对应癌旁正常组织,平均达1.74倍(Mean±SD,0.013 2±0.021 6 vs. 0.007 6±0.010 3,P=0.03,P<0.01),见图1。
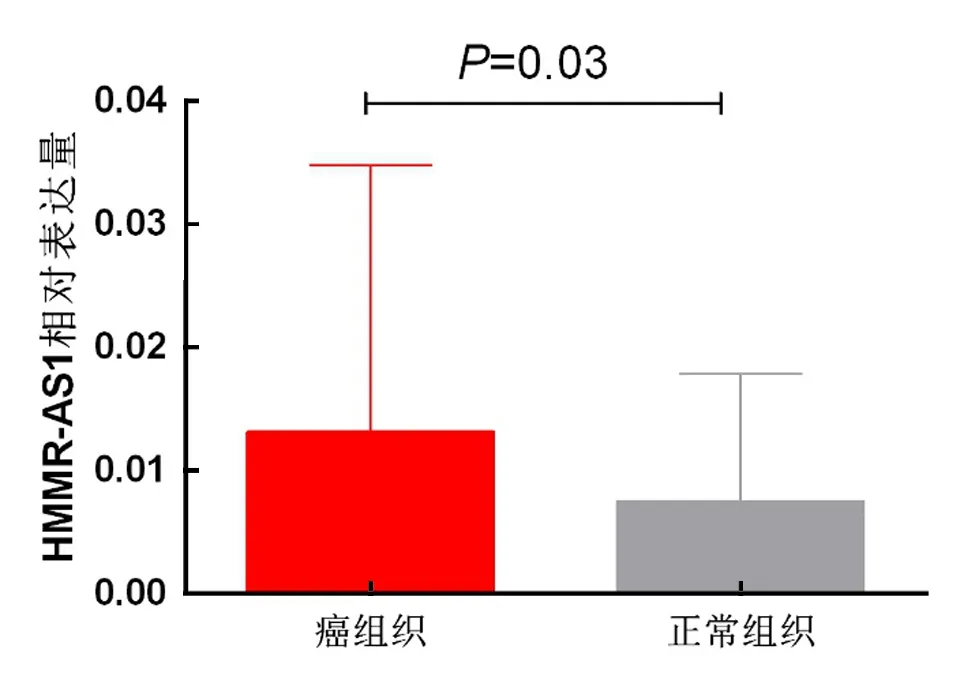
图1 HMMR-AS1在宫颈癌中高表达
2 HMMR-AS1表达水平与宫颈癌患者临床特征之间的关系 分析HMMR-AS1表达水平与宫颈癌患者临床特征之间的关系可见,HMMR-AS1高表达与宫颈癌患者肿瘤分期(P=0.031)、是否原位癌(P=0.004)、是否淋巴结转移(P=0.047)、是否远端转移(P=0.033)、是否化疗(P=0.007)有关,见表1。
3 HMMR-AS1高表达与宫颈癌患者生存期缩短相关 本研究进一步分析了HMMR-AS1表达量与宫颈癌患者生存随访资料之间的关系,将本研究患者分为HMMR-AS1高表达组和低表达组,使用Kaplan-Meier法进行生存分析,使用Log-rank检验两组间生存率的差异,结果显示,HMMR-AS1低表达组中位生存时间为39个月,高表达组中位生存时间为26个月,组间总生存率(overall survival,OS)差异有统计学意义,HMMR-AS1高表达组OS明显低于HMMR-AS1低表达组(χ2=7.31,P=0.006 9;见图2)。
4 成功筛选稳定高表达HMMR-AS1的Hela细胞系 本研究通过慢病毒感染成功筛选稳定高表达HMMRAS1的Hela细胞系,通过荧光照片确认转染成功 (见图3),并通过实时荧光定量PCR验证发现,高表达细胞系中HMMR-AS1的相对表达量显著高于空白对照组 (P=0.000 2,见图4)。
5 高表达HMMR-AS1促进宫颈癌细胞增殖 本研究通过MTT实验验证了高表达HMMR-AS1后对宫颈癌细胞增殖能力的影响。通过重复测量的方差分析,结果显示:当细胞增殖48 h以后,高表达细胞系增殖速度明显较对照细胞快。转染后0 h,24 h,48 h,72 h,96 h在490 nm下的吸光度值(OD值),分别为高表达vs.对照(时间,P高表达vs.对照):0.318±0.016 vs. 0.316±0.028(0 h,P>0.05);0.317±0.024 vs.0.315±0.015(24 h,P>0.05);0.486±0.016 vs.0.423±0.026(48 h,P=0.044);0.627±0.051 vs.0.492±0.025(72 h,P=0.011);0.827±0.046 vs.0.643±0.034(96 h,P=0.002);见图5。通过以上数据可见在细胞生长达到平台期以前,HMMR-AS1能够明显促进宫颈癌细胞的增殖。
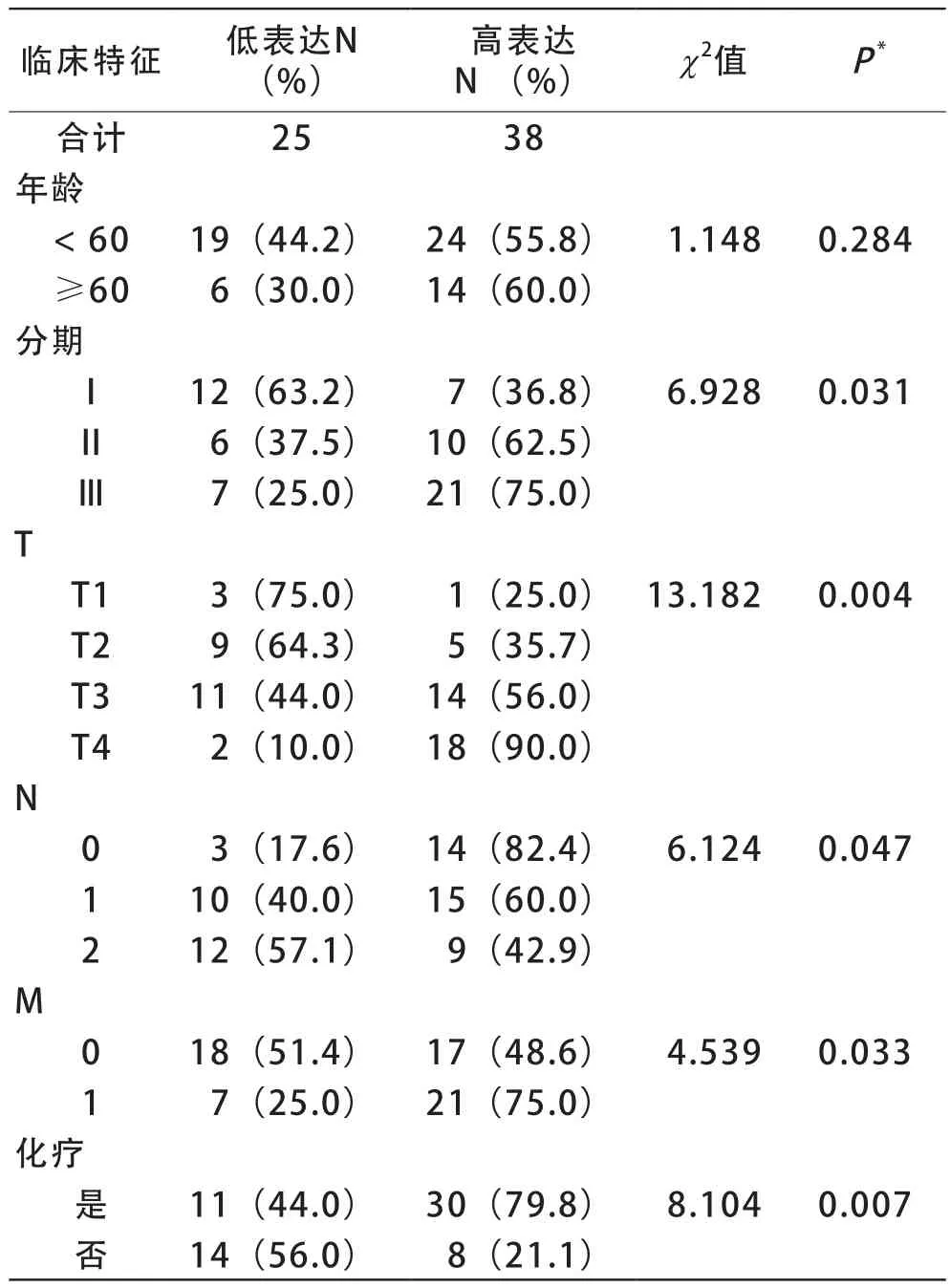
表1 HMMR-AS1表达水平与宫颈癌临床特征之间的关系
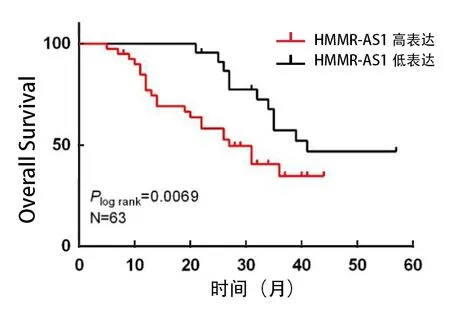
图2 HMMR-AS1缩短宫颈癌患者生存期
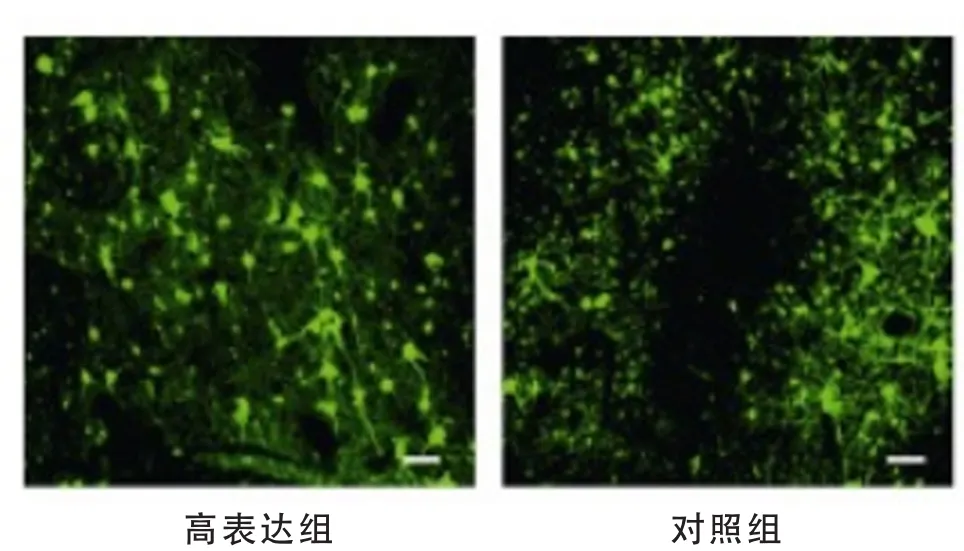
图3 高表达组和对照组的荧光图
6 高表达HMMR-AS1促进宫颈癌细胞迁移 本研究通过Transwell迁移实验验证了高表达HMMR-AS1后对宫颈癌细胞迁移能力的影响。通过吉母萨染色后显微镜下拍照(200×)计数后分析发现:高表达组宫颈癌细胞迁移能力明显较对照细胞增加:高表达vs.对照:78.4±6.2 vs. 54.2±9.6,P=0.000 65,见图6。
7 高表达HMMR-AS1促进宫颈癌细胞侵袭 本研究通过Transwell侵袭实验验证了高表达HMMR-AS1后对宫颈癌细胞侵袭能力的影响。通过吉母萨染色后显微镜下拍照(200×)计数后分析发现:高表达组宫颈癌细胞侵袭能力明显较对照细胞增加:高表达vs. 对照:65.6±8.1 vs. 41.0±7.3,P=0.005 3,见图7。

图4 成功筛选HMMR-AS1过表达Hela细胞株
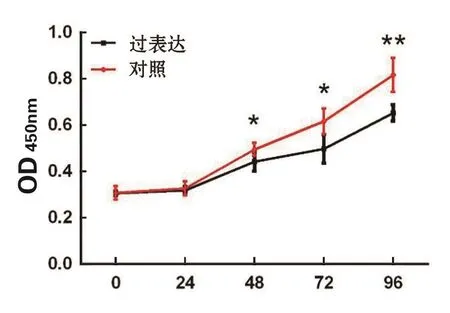
图5 HMMR-AS1促进细胞增殖(*P<0.05,**P<0.01)
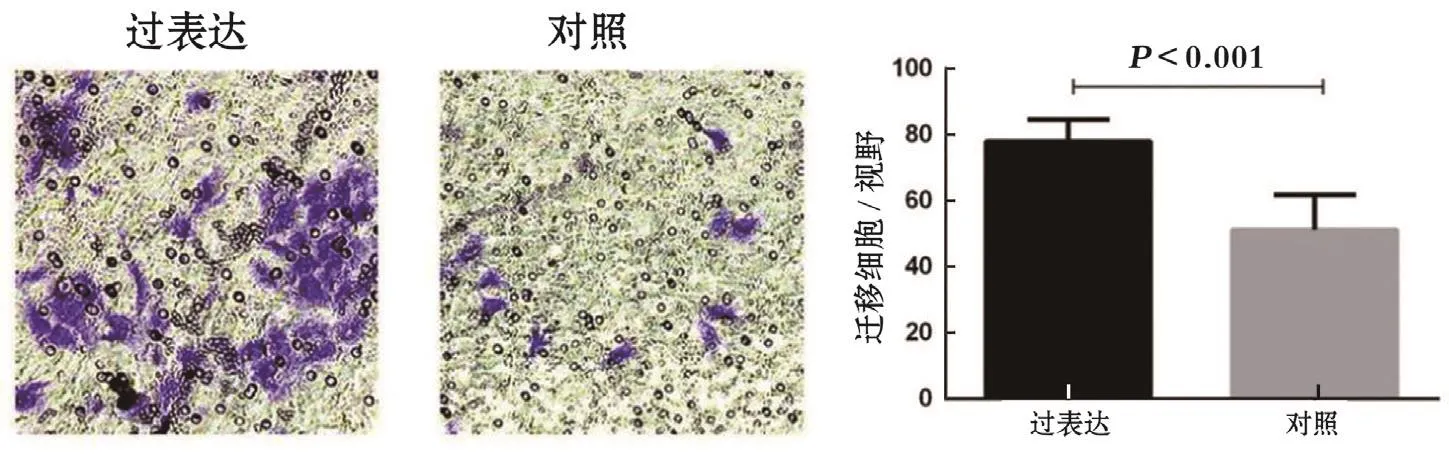
图6 HMMR-AS1促进细胞迁移(200×)
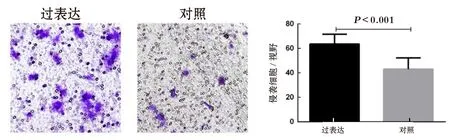
图7 HMMR-AS1促进细胞侵袭(200×)
8 Hela细胞系中EMT标志物的表达 通过检测高表达细胞系中上皮样细胞标志物E-cadherin和间质样细胞标志物 vimentin的表达情况,结果显示,经高表达后,HMMR-AS1在高表达细胞系中的相对表达量是对照细胞系的14.23倍(P=0.002 3,见图8A)。通过检测细胞中EMT标志物基因及其蛋白质的表达量,结果显示上皮样细胞标志物E-cadherin在高表达细胞系中的表达量显著低于对照细胞系(P=0.005 6,见图8B),而间质样细胞标志物Vimentin在高表达细胞系中的表达量显著高于对照细胞系(P=0.007 2,见图8C),且在蛋白质水平发现同样趋势(P=0.009 5,见图8D)。

图8 Hela细胞系中EMT标志物的表达
9 高表达HMMR-AS1降低宫颈癌细胞对化疗药物的敏感性 通过改进CCK-8实验验证了高表达HMMRAS1后宫颈癌细胞对常见化疗药物5-FU和顺铂敏感性的影响。实验中,首先通过CCK-8实验测得Hela对顺铂的IC50,高表达组对顺铂的IC50为52.21±6.22 μmol/L,对照组对顺铂的IC50为7.21±1.11 μmol/L(P=0.003 2)。顺铂处理后细胞的存活曲线见图9。实验结果均显示:高表达组细胞对顺铂的敏感性降低,提示HMMR-AS1高表达能够导致宫颈癌细胞对顺铂耐药。
讨 论
宫颈癌是一种严重危害女性健康的恶性肿瘤,其发病年龄各国报道各异,但发病年龄均呈年轻化的趋势[5,9-11]。目前根据文献报道宫颈癌预后较差的主要原因之一为耐药性的出现[12]。有关耐药机制的研究比较丰富[13],其中研究较多的是上皮-间质细胞转化(Epithelial-Mesenchymal Transition,EMT)机制[7],且证实EMT与肿瘤细胞侵袭和迁移相关[14]。因此,阐明宫颈癌的耐药机制对宫颈癌的诊断和治疗至关重要。
近年来,非编码RNA,特别是长链非编码RNA(long non-coding RNAs,lncRNAs)受到越来越多研究者的关注[15-18]。lncRNAs的类型不同,其作用机制也有区别[19-22]。Chu等[23]研究发现HMMR-AS1在上皮性卵巢癌中高表达,且其高表达与上皮性卵巢癌的不良预后相关;Li等[24]研究发现敲低HMMR-AS1能抑制恶性胶质瘤细胞的侵袭和转移。本研究发现HMMR-AS1在宫颈癌中高表达,且其高表达与宫颈癌患者的不良预后相关,高表达患者生存期较低;本研究发现高表达HMMR-AS1能促进宫颈癌细胞的增殖、侵袭和转移,且化疗敏感性实验表明高表达HMMR-AS1能降低宫颈癌细胞对顺铂和5-FU的敏感性;此外高表达HMMR-AS1能够促进宫颈癌细胞的EMT。本研究与王冉冉等[7]在上皮性卵巢癌中作用机制相似。在作用机制方面,本研究结果表明HMMRAS1可通过介导EMT调控Hela细胞化疗敏感性,促进Hela细胞增殖、迁移和侵袭,进而导致宫颈癌预后不良。目前HMMR-AS1介导EMT调控宫颈癌获得耐药性的机制尚未清晰,且HMMR-AS1通过调节上下游基因及其信号通路仍需进一步探究。

