基于D-苯丙氨酸骨架的萘普生类似物的合成及其对COX-2的选择性研究*
李永莲,阳元娥,刘文锋
(1. 广东轻工职业技术学院 生态环境技术学院,广东 广州 510300;2. 广东轻工职业技术学院 食品与生物技术学院,广东 广州 510300;3. 五邑大学 生物科技与大健康学院,广东 江门 529020)
随着全球人口增加和人口老龄化等问题的凸显,慢性炎性疾病(如关节炎、溃疡性结肠炎、脓毒症、动脉粥样硬化等)的发病率也逐年升高,已经成为不容忽视的公共卫生问题之一[1]。自从阿司匹林(Aspirin)问世以来,已有100余种非甾体抗炎药物(NSAIDs)用于临床,NSAIDs目前已成为缓解炎症症状和治疗炎症相关疾病使用最为广泛的药物[2],但是服用NSAIDs的患者患有胃溃疡或十二指肠溃疡等胃肠道副作用。研究表明,NSAIDs的作用靶点之一是环氧合酶(COX),而COX有两种亚型:环氧合酶-1(COX-1)和环氧合酶-2(COX-2)。然而,NSAIDs药物的有效作用在于其对COX-2的抑制,而不良反应是源于对COX-1活性的抑制[3-4]。因此,研发新型NSAIDs药物的关键是提高抑制COX-2的选择性,避免抑制COX-1的活性。许多专家学者[5-7]对传统的非甾体抗炎药进行了成功的结构改造,可以提高对COX-2抑制的选择性。
萘普生是常用的非甾体抗炎药物(NSAIDs),对COX-1 和 COX-2 都有抑制作用,但其对COX-2的选择性不高[8],对COX-1的抑制强于COX-2。所以,萘普生在发挥药效的同时还伴随着胃肠道副作用、心血管疾病和其他不良反应[9]。因此,本研究基于萘普生抑制COX的特性,采用经典的酰胺化反应,设计和合成目标化合物,以期得到对COX-2选择性抑制的萘普生类似物。
1 实验材料与方法
1.1 实验试剂与仪器
萘普生;D-丙氨酸甲酯盐酸盐;D-苯丙氨酸甲酯盐酸盐;1-乙基-(3-二甲基氨基丙基)碳酰二亚胺盐酸盐(EDCI);1-羟基-7-偶氮苯并三氮唑(HOAt);三乙胺;氢氧化锂;盐酸;其中所用试剂均为市售分析纯或化学纯。
DF-101S集热式磁力恒温搅拌器;R-1001N旋蒸蒸发仪;SHB-Ⅲ循环水式多用真空泵;DFZ-6020真空干燥箱;WFH-203B三用紫外灯;AVANCE NEO 500核磁共振分析仪。
1.2 目标化合物的合成
采用经典的酰胺化反应,根据合成路线(图1)分别合成了化合物1,2和3。1.0 mmol萘普生、1.0 mmol 甘氨酸甲酯盐酸盐、1.2 mmol EDCI和1.2 mmol HOAt先后加入50 mL圆底烧瓶中,加入20 mL二氯甲烷作溶剂,然后缓慢滴加0.1 mmol三乙胺,室温下搅拌反应1 h。经TLC点板检测原料反应完全后,产物经浓缩用柱层析进行分离纯化,得到化合物1。以化合物1为原料,将其溶解在20 mL混合溶液中(四氢呋喃∶甲醇∶水=3∶1∶1)加入过量的氢氧化锂,并超声振荡10 min,然后加入盐酸调节溶液的pH为3~4,即得化合物2。参照化合物1的合成方法,合成化合物3。具体方法如下:以1.0 mmol化合物2和1.0 mmol D-苯丙氨酸甲酯盐酸盐为原料,1.2 mmol EDCI和1.2 mmol HOAt为酰胺化试剂,0.1 mmol三乙胺作为催化剂,20 mL二氯甲烷作为溶剂,充分混匀后室温搅拌反应1 h。最后经TLC监测反应,并浓缩过柱得到化合物3。
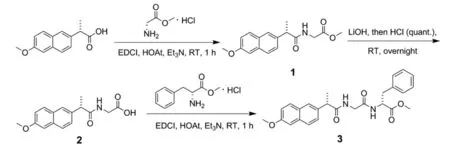
图1 萘普生类化合物的合成路线图
1.3 目标化合物的结构鉴定
核磁共振(NMR)是在外磁场的作用下,电子的自旋磁矩与磁场相互作用而裂分为能级不同的核磁能级,吸收射频辐射后产生能级跃迁,产生核磁共振波谱。核磁共振波谱包括1H核磁共振波谱和13C核磁共振波谱,是有机化合物结构鉴定和解决复杂结构问题最重要的分析方法。本实验采用 Bruke AVANCE NEO 500 核磁共振分析仪对目标化合物的结构进行表征。
1.4 目标化合物的细胞毒性测试
采用MTT法检测目标化合物对RAW 264.7细胞生存能力的影响。选取对数生长期的RAW 264.7细胞,用细胞刮从培养皿中刮下,加入含有10% FBS的DMEM培养基中制成细胞悬浮液,以接种浓度1×104个/mL的浓度接种于96孔板(100 μL/孔),同时设置空白调零孔(培养基铺板孔)和对照孔(DMSO处理孔),5% CO2,37℃培养过夜,加入浓度梯度(10, 20, 30, 40, 50 μM)的目标化合物处理(含1 μg/mL LPS),每个样品设3个复孔,5% CO2,37℃孵育24 h后小心吸出培养液,每孔加入100 μL培养基配制的MTT溶液(5 mg/mL,即0.5% MTT);继续培养2 h后,小心吸去孔内培养液。每孔加入200 μL DMSO,置摇床上低速振荡10 min,使结晶物充分溶解;用酶标仪测量550 nm处各孔的吸光值,细胞存活率计算公式=(对照组OD值-药物实验组OD值)/(对照组OD值-空白调零孔OD值)×100%。
1.5 目标化合物抑制COX-1和COX-2活性的检测
RAW 264.7细胞以5×105个/mL的密度接种在6孔板中(2 mL/孔),置于37℃、5% CO2培养箱内孵育。24 h后细胞贴壁,空白对照组加入2 μL DMSO,LPS对照组加入2 μL DMEM培养基,药物实验组加入2 μL不同浓度的目标化合物溶液(终浓度10, 30, 50 μM),预处理1 h。然后LPS对照组和药物实验组分别加入体积为1 μL的LPS溶液(终浓度1 μg/mL)刺激。加LPS后置于37℃、5% CO2培养箱内孵育16 h。吸取每孔上层培养液于2 mL离心管内,于4℃,5000 rpm,离心15 min,吸取上清液进行COX-1和COX-2活性检测。具体操作方法按照Cayman公司COX活性检测试剂盒说明书进行,最后经37℃避光孵育5分钟后进行荧光测定。设置激发波长为560 nm,发射波长为590 nm,记录实验数据。最后根据化合物的剂量效应可分别测定化合物抑制COX-1的IC50和抑制COX-2的IC50,从而计算出化合物的SI值(SI值=IC50(COX-1)/ IC50(COX-2))。
2 结果与讨论
2.1 目标化合物的结构确证
图2和图3分别是化合物1的1H-NMR谱图和13C-NMR谱图,经分析得出以下结论:化合物1中氢原子的总数为19个,与目标化合物1的理论氢原子个数相符;化合物1中碳原子的总数为17个,与目标化合物1的理论碳原子个数相符。
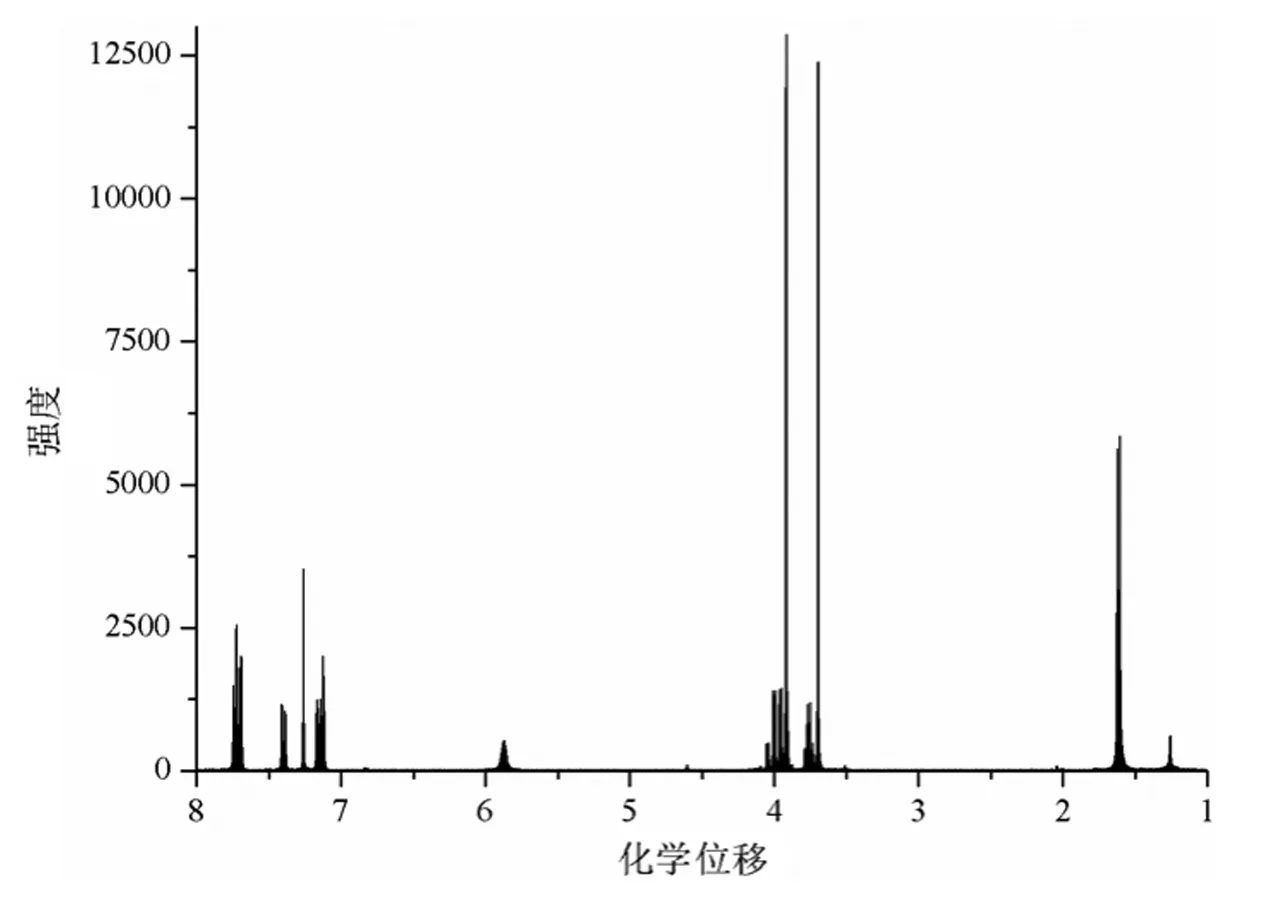
图2 化合物1的1H-NMR谱图
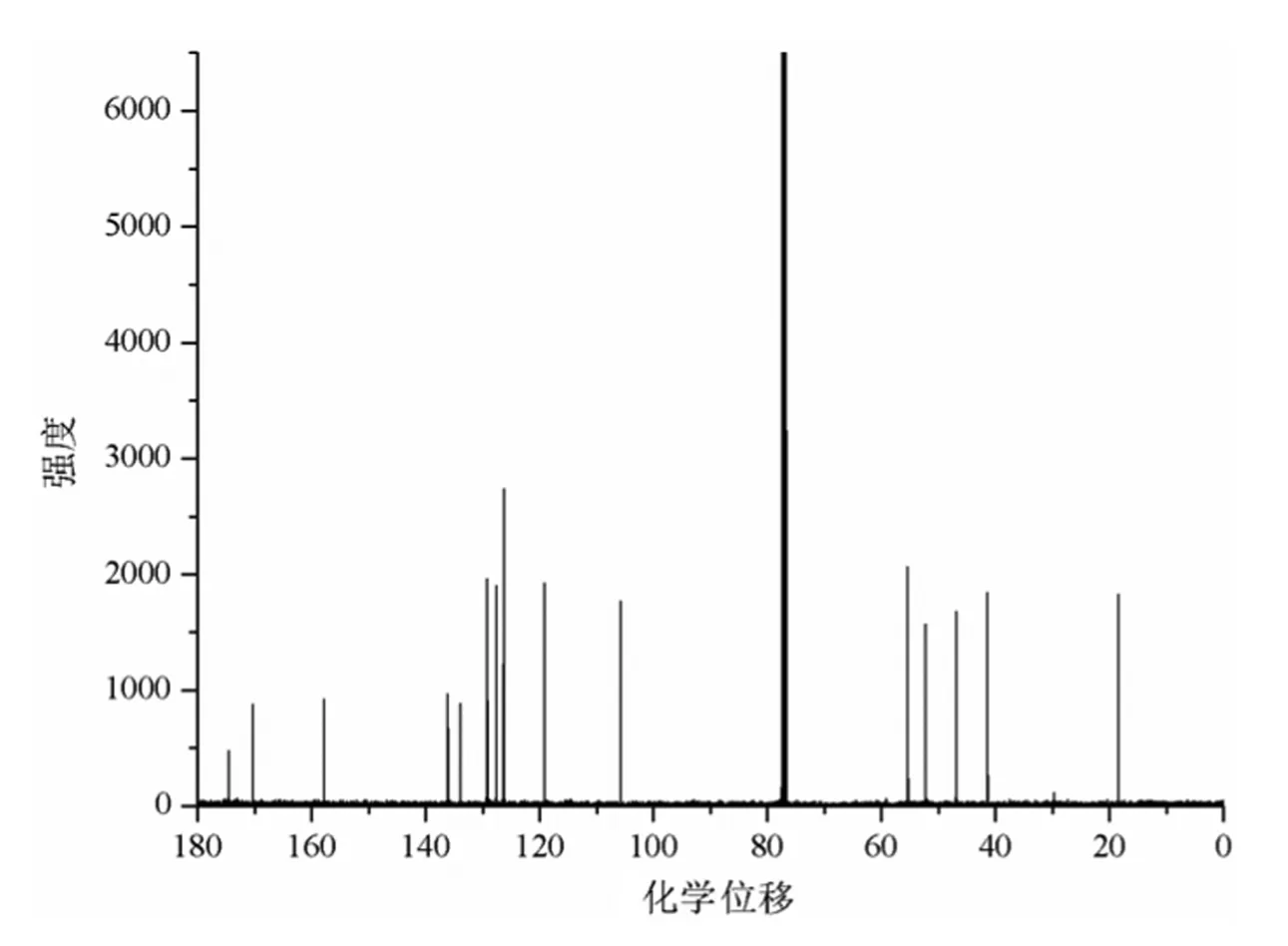
图3 化合物1的13C-NMR谱图
图4和图5分别是化合物2的1H-NMR谱图和13C-NMR谱图,经分析得出以下结论:化合物2中氢原子的总数为17个,与目标化合物2的理论氢原子个数相符;化合物2中碳原子的总数为16个,与目标化合物2的理论碳原子个数相符。
图4 化合物2的1H-NMR谱图
图5 化合物2的13C-NMR谱图
图6和图7分别是化合物3的1H-NMR和13C-NMR谱图,经分析得出以下结论:化合物3中氢原子的总数为26个,与目标化合物3和化合物3的理论氢原子个数相符;化合物3中碳原子的总数为28个,与目标化合物3和化合物3的理论碳原子个数相符。
图6 化合物3的1H-NMR谱图
图7 化合物3的13C-NMR谱图
化合物1,2和3的物理性质、产率和核磁数据如下所示:
化合物1:methyl (2-(6-methoxynaphthalen-2-yl)propanoyl)glycinate,白色固体粉末,产率为81%。1H NMR (400 MHz, CDCl3) δ 7.71 (dd,J=14.3, 6.1 Hz, 3H), 7.40 (dd,J=8.5, 1.7 Hz, 1H), 7.17 (d,J=2.5 Hz, 1H), 7.14 (d,J=2.5 Hz, 1H), 7.12 (d,J=2.3 Hz, 1H), 4.00 (d,J=5.4 Hz, 1H), 3.96 (d,J=5.2 Hz, 1H), 3.92 (s, 3H), 3.76 (d,J=7.2 Hz, 1H), 3.69 (s, 3H), 1.61 (d,J=7.2 Hz, 4H).13C NMR (101 MHz, CDCl3) δ 174.52, 170.30, 157.83), 136.04, 133.85, 129.25, 129.04, 127.58, 126.27, 119.16, 105.77, 55.33, 52.21, 46.86, 41.35, 18.39.
化合物2:(2-(6-methoxynaphthalen-2-yl)propanoyl)glycine,白色固体粉末,产率为77%。1H NMR (400 MHz, DMSO) δ 8.25 (t,J=5.5 Hz, 1H), 7.78 (s, 1H), 7.76 (d,J=3.3 Hz, 1H), 7.73 (s, 1H), 7.45 (dd,J=8.6, 1.5 Hz, 1H), 7.14 (dd,J=8.9, 2.5 Hz, 1H), 3.86 (s, 3H), 3.81 (s, 1H), 3.76 (d,J=6.6 Hz, 1H), 3.73-3.68 (m, 2H), 1.41 (d,J=7.1 Hz, 3H).13C NMR (101 MHz, DMSO) δ 174.17, 171.74, 157.46, 137.68, 133.60, 129.56, 128.84, 127.06, 127.01, 125.87, 118.98, 106.18, 55.62, 45.21, 41.43, 19.07.
化合物3:(2-(6-methoxynaphthalen-2-yl)propanoyl)glycyl-D-leucine,白色固体粉末,产率为80%。1H-NMR (400 MHz, CDCl3) δ 7.66 (d,J=8.7 Hz, 3H), 7.36 (d,J=8.2 Hz, 1H), 7.16-7.03 (m, 2H), 6.99 (d,J=7.2 Hz, 1H), 6.85 (d,J=7.6 Hz, 1H), 6.75 (s, 1H), 4.42 (s, 1H), 3.99 (dd,J=16.2, 5.7 Hz, 1H), 3.89 (d,J=4.4 Hz, 3H), 3.85 -3.77 (m, 1H), 3.77-3.67 (m, 1H), 1.56 (d,J=6.9 Hz, 4H), 1.46-1.32 (m, 1H), 1.26 (s, 1H), 0.83 (s, 6H).13C-NMR (101 MHz, CDCl3) δ 175.64, 175.12, 169.50, 157.80, 135.72, 134.42, 133.52, 129.29, 128.99, 127.64, 126.15, 126.03, 119.21, 105.70, 55.33, 50.90, 46.67, 43.21, 40.79, 24.76, 22.71, 21.77, 18.18.
2.2 目标化合物对RAW 264.7细胞的毒性和对COX-2的选择能力
萘普生衍生物的细胞毒实验数据表明:化合物1,2和3对RAW 264.7细胞的毒性与萘普生的相当,说明此类化合物具备一定的成药性。
COX-2的选择性实验表明:经D-氨基酸残基修饰的3个化合物对COX-2的选择性有所提高(表1),其中化合物3对COX-2的选择性最高(S=2.77),安全有效且副作用小。
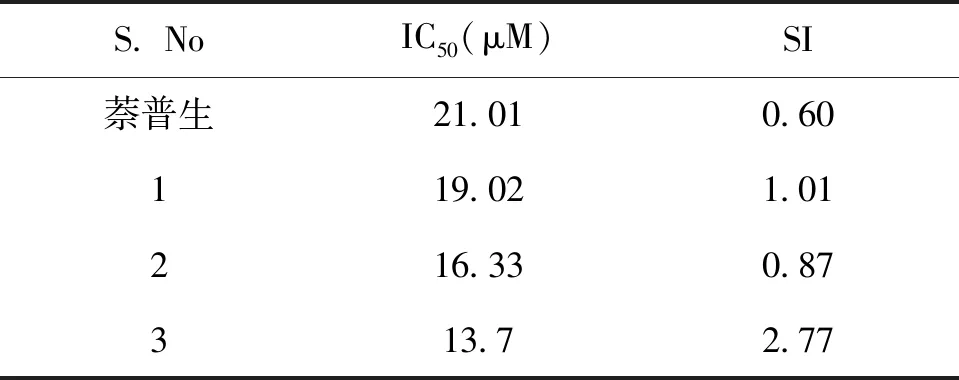
表1 萘普生衍生物的细胞毒实验数据(IC50)和对COX-2的选择能力(SI)
3 结论
合成的基于D-苯丙氨酸骨架的萘普生类似物,目标化合物的结构通过核磁共振氢谱及碳谱得到确证;通过MTT法和免疫荧光法分别测定目标化合物对RAW 264.7细胞的毒性和对COX-2的选择能力,结果显示系列化合物的细胞毒性数据与萘普生的相当,目标化合物3对COX-2具有较好的选择性。

