低酰基和高酰基结冷胶对模型饮料中百香果皮花色苷热稳定性的影响
程宏桢,蔡志鹏,王 静,徐明生,沈勇根*,卢剑青,刘馥源,李晓明
(江西农业大学食品科学与工程学院,江西省发展与改革委员会农产品加工与安全控制工程实验室,江西 南昌 330045)
百香果,学名西番莲(Passiflora coeruleaL.),是西番莲科西番莲属的一种多年生蔓生草质藤本植物,主要分布于热带和亚热带地区,我国广西、海南和广东等地广泛种植[1]。百香果最常见的是将其加工为果汁,其果汁色泽金黄、香气馥郁、甜酸可口,深受消费者喜爱。然而百香果皮(passion fruit peel,PFP)通常被丢弃,导致果皮利用率极低,造成资源的浪费和环境的污染。PFP中除含有果胶、纤维素、多糖、矿物质外,还富含活性成分花色苷。研究表明,PFP花色苷具有抗氧化[2]、抗炎[3]、降血压[4]、抗焦虑[5]、降血糖[6]等功效。因此,对PFP花色苷进行系统研究和资源开发具有广泛的应用前景和实用意义。
花色苷是一种广泛存在于植物中的水溶性天然色素,属于黄酮类化合物[7]。花色苷在贮藏、加工和使用过程中,受到热、氧、光和生物等外界因素影响,使其内部分子结构发生变化,产生降解[8]。抗坏血酸是微量营养素,因其可以延长保质期、提高营养和调节风味,通常用于商业饮料中,但花色苷作为食品成分使用时,虽然果汁中的内源性抗坏血酸不会对花色苷降解产生显著影响,但由于饮料基质中抗坏血酸浓度的增加,强化抗坏血酸会损害花色苷结构导致褪色[9-10],这限制了花色苷在饮料体系中的应用。
结冷胶是生物体鞘氨醇单细胞菌在有氧发酵条件下分泌的羧基化细胞外多糖[11],具有成胶用量少、凝胶形成能力好、透明度高、复配性好等优越性[12],还能赋予食品极佳的香气、质地和口感。目前市售2 种结冷胶,从发酵液中直接回收多糖产生高酰基(high acyl,HA)结冷胶,而通过碱处理进行的脱酰作用产生低酰基(low acyl,LA)结冷胶,但LA结冷胶和HA结冷胶由于酰化程度不同,可能与花色苷之间的空间相互作用也不同,导致稳定性有差异。前人研究证明多糖与花色苷的复配可以提高花色苷稳定性[13-14]。Xiong Shaoyuan等[15]研究表明用葡聚糖凝胶包封花色苷与用大豆油相比,回收率从25%提高至33%。Buchweitz等[16]研究表明在pH 5.0条件下加入果胶和果胶多糖可显著提高黑加仑汁中花色苷稳定性。Guan Yongguang等[17]研究表明阿拉伯胶提高了花色苷在80 ℃和126 ℃条件下降解的半衰期和在pH 5.0条件下的热稳定性。由此,多糖与花色苷的复配成为一种弥补花色苷降解的绿色、安全的有效途径。结冷胶可通过氢键、疏水作用力和离子作用力等介导与花色苷相互作用产生非共价化合物,从而提高花色苷稳定性[18],解决抗坏血酸强化且富含花色苷的饮料中变色问题,这对于结冷胶在食品中的应用具有重要的指导意义。
目前,结冷胶作为新型微生物多糖,其优越的凝胶性能远高于其他亲水胶体,但结冷胶作为一种食品添加剂在饮料体系中鲜有应用,且国内外对PFP花色苷的研究主要集中在色素提取和贮藏中的氧化褐变,鲜见有关LA/HA结冷胶与PFP花色苷的复配体系以改善花色苷降解的研究报道。为此,本实验以PFP花色苷为原料,研究LA和HA结冷胶对含有抗坏血酸的模型饮料中PFP花色苷热稳定性的影响。分析不同浓度的LA结冷胶和HA结冷胶对花色苷稳定性的影响,探究LA结冷胶和HA结冷胶在含抗坏血酸的模型饮料中花色苷的热降解动力学和色差的变化情况,利用超高效液相色谱-四极杆飞行时间串联质谱仪分析鉴定PFP花色苷组分,以期为PFP花色苷的稳定化控制及结冷胶的推广应用提供参考依据。
1 材料与方法
1.1 材料与试剂
百香果为紫果,采自广西崇左某农户果园,于-80 ℃冰箱超低温保藏。
果胶酶 河南万邦实业有限公司;HP-20大孔吸附树脂 北京索莱宝科技有限公司甲酸、乙腈、甲醇(均为色谱纯) 美国天地有限公司;LA和HA结冷胶(纯度99%) 苏州威晟生物科技有限公司;乙醇、冰乙酸、乙酸钠、盐酸、氯化钾、磷酸氢二钠、柠檬酸、抗坏血酸均为国产分析纯。
1.2 仪器与设备
BSA124S电子天平 赛多利斯科学仪器(北京)有限公司;SCIENTZ-10N冷冻干燥机、SB-3200DTDN超声波清洗机 宁波新芝生物科技股份有限公司;Q500B高速多功能粉碎机 上海冰都电器有限公司;LXJ-IIB离心机 上海安寿科学仪器厂;ColorQuest XE色差仪美国HunterLab公司;WFJ 2100可见分光光度计 尤尼柯(上海)仪器有限公司;MALDI SYNAPT MS超高效液相色谱-四极杆飞行时间串联质谱联用仪 美国Waters公司。
1.3 方法
1.3.1 PFP花色苷的提取纯化
1.3.1.1 PFP花色苷的提取
选择发育成熟、表皮紫红的百香果用蒸馏水洗净,取皮切块,冷冻干燥,打粉后过60 目筛,4 ℃干燥避光保存,备用。称取适量PFP粉,采用超声酶法提取花色苷,按料液比1∶10(g/mL)加入含85%乙醇和0.05% HCl的提取液中,先进行酶法提取,果胶酶添加量5 mg/g、酶解pH 3.0、酶解温度25 ℃、酶解时间60 min,然后在功率108 W条件下超声提取20 min,4 000 r/min离心10 min,经过分离得到含有PFP花色苷的上清液,备用。
1.3.1.2 PFP花色苷的纯化
选用经预处理后的HP-20大孔树脂对花色苷粗提液进行湿法上柱,柱高15 cm,调节吸附流速为3.5 BV/h,待吸附饱和后用蒸馏水以2 BV/h的流速冲柱洗涤,随后用含85%乙醇和0.05% HCl的混合溶液解吸,冲柱流速为3 BV/h,待树脂层接近无色,对洗脱液进行真空浓缩,得到纯化的花色苷浓缩液,经冷冻干燥,得到深紫色的PFP花色苷粉末。
1.3.2 样品溶液的制备
PFP:精确称取0.09 g PFP花色苷粉末于50 mL棕色试剂瓶,加入30 mL 0.1 mol/L磷酸氢二钠-柠檬酸缓冲溶液(pH 3)中溶解充分,配制成含有0.3%的PFP花色苷溶液。
PFP+VC:精确称取0.09 g PFP花色苷粉末和0.24 g抗坏血酸粉末于50 mL棕色试剂瓶,加入30 mL 0.1 mol/L磷酸氢二钠-柠檬酸缓冲溶液(pH 3)中溶解充分,配制成含有0.3%花色苷和0.6% VC的混合体系。
PFP+VC+LA/HA:精确称取0.09 g LA/HA结冷胶于50 mL棕色试剂瓶,加入15 mL超纯水溶解,80 ℃水浴30 min,搅拌直至完全水合,冷却至室温后,用柠檬酸调节pH值为3。精确称取0.12 g PFP花色苷和0.24 g抗坏血酸粉末于50 mL烧杯中,加入20 mL 0.1 mol/L磷酸氢二钠-柠檬酸缓冲溶液(pH 3)中溶解完全,随后迅速取15 mL该溶液转移至上述棕色试剂瓶,混合均匀,配制成含有0.3%花色苷、0.6% VC和0.3% LA/HA的混合体系。
1.3.3 样品溶液的热处理
将配制好的PFP、PFP+VC、PFP+VC+LA和PFP+VC+HA 4 种不同的混合体系于85 ℃水浴加热0、1、2、3、4、5 h,随后冷却至室温,测定吸光度。
1.3.4 抗坏血酸质量分数对PFP花色苷稳定性的影响
精确称取适量抗坏血酸,分别用0.1 mol/L磷酸氢二钠-柠檬酸缓冲溶液(pH 3)配制成质量分数分别为0%、0.2%、0.4%、0.6%、0.8%、1.0%的抗坏血酸溶液,在PFP质量分数0.3%、水浴温度85℃、加热时间5 h条件下,探究不同质量分数的抗坏血酸溶液对PFP花色苷稳定性的影响。
1.3.5 LA/HA质量分数对PFP花色苷稳定性的影响
精确称取适量LA和HA结冷胶,分别用超纯水配制成质量分数为0%、0.1%、0.2%、0.3%、0.4%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的溶液,用柠檬酸调节pH值为3.0,在花色苷质量分数0.3%、抗坏血酸质量分数0.6%、水浴温度85 ℃、加热时间5 h条件下,研究不同质量分数LA和HA结冷胶对PFP花色苷的影响。
1.3.6 总花色苷质量浓度的测定
参照李恩惠等[19]的方法稍作修改,采用pH示差法测定花色苷质量浓度。吸取0.025 mol/L(pH 1.0)的KCl-HCl缓冲液和0.4 mol/L(pH 4.5)的乙酸钠-乙酸缓冲液各4.5 mL于试管中,分别加入待测样品0.5 mL,室温避光放置30 min,分别测定波长520 nm和700 nm处吸光度。按式(1)、(2)计算花色苷质量浓度:
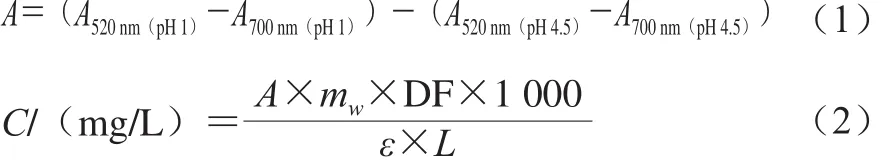
式中:mw为矢车菊素-3-O-葡萄糖苷的摩尔质量(449.38 g/mol);DF为稀释倍数(10);ε为消光系数(26 900 L/(mol·cm));L为光程(1 cm)。
1.3.7 色差的测定
采用全自动色差仪在总透射模式下对花色苷溶液的L*(亮/暗)、a*(红/绿)和b*(黄/蓝)进行测定。按式(3)计算:
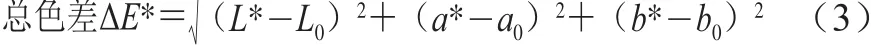
式中:L*、a*、b*为加热后值;L0、a0、b0为加热前值。
1.3.8 降解动力学分析
根据处理前和处理后PFP花色苷质量浓度,按式(4)计算保留率:

式中:Ct为处理第t分钟花色苷质量浓度/(mg/L);C0为处理第0分钟花色苷质量浓度/(mg/L)。
研究表明,运用指数速率模型可以较大范畴地模拟有机物的降解过程[20]。有机物的降解速率与有机物质量质量浓度的关系表达,见式(5):

式中:ω为有机物的质量浓度/(mg/L);k为降解速率常数/min-1;t为反应时间/min;n为反应级数。
假设降解动力学反应符合零级、一级、二级和三级动力学模型,即当n为0、1、2、3时,式(5)的积分形式,见式(6)~(9):


式中:k0、k1、k2和k3分别为零级、一级、二级和三级反应降解速率常数/min-1。
当,即PFP花色苷质量浓度下降一半时,所需要的衰变时间为半衰期t1/2。对于一级反应,对应的半衰期为:

1.3.9 PFP花色苷的结构鉴定
1.3.9.1 高效液相色谱条件
色谱柱:ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);用1%甲酸溶液(A相)和100%乙腈(B相)进行洗脱;洗脱条件:0~10 min,100% A;10~15 min,60% A;16~25 min,100% A。柱温45 ℃,进样量2 μL,流速0.3 mL/min,洗脱液中花色苷检测波长520 nm。
1.3.9.2 质谱分析
电喷雾离子源,正离子模式扫描;质量扫描范围m/z20~1 500;毛细管电压3.5 kV;锥孔电压20 V;离子源温度100 ℃;脱溶剂气温度400 ℃;脱溶剂气流速700 L/h;锥形气体流量50 L/h;碰撞能量6/20 V;检测器电压1 800 V。
1.4 数据处理
使用Excel 2016对实验数据进行整合处理,每组实验均重复3 次,结果以 ±s表示,采用Origin 8.5绘制图表,使用SPSS 20.0进行差异显著性分析(Duncan多重比较)。
2 结果与分析
2.1 抗坏血酸质量分数对PFP花色苷稳定性的影响
分别配制质量分数为0%、0.2%、0.4%、0.6%、0.8%、1.0%的抗坏血酸溶液,在PFP花色苷质量分数为0.3%、水浴温度85 ℃和加热时间5 h条件下,探究不同抗坏血酸质量分数对PFP花色苷稳定性的影响,结果见图1。
由图1可知,随着抗坏血酸质量分数的升高,花色苷质量浓度呈下降趋势。在0%~0.6%范围内,花色苷质量浓度下降趋势较快,当抗坏血酸质量分数超过0.6%时,下降趋于平缓,说明抗坏血酸的加入不利于花色苷的稳定,且抗坏血酸质量分数越高,花色苷降解越多,但质量分数超过一定限额,降解反应变慢。这可能是大量的抗坏血酸可以表现出关于Fenton反应的促氧化作用,其通过与饮料中的金属离子螯合而增加活性氧物质的形成,其中特别是·OH,可以进一步降解花青素结构,导致颜色损失[21]。因此,后续实验选取质量分数0.6%的抗坏血酸。
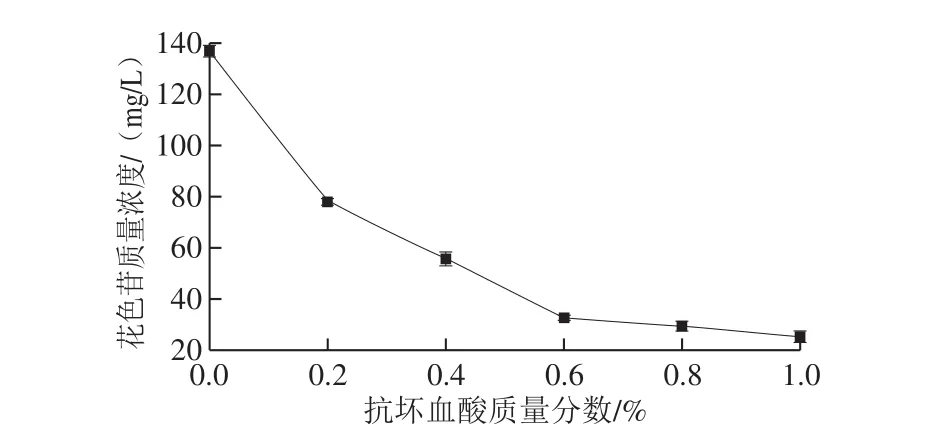
图 1 抗坏血酸质量分数对PFP花色苷稳定性的影响Fig. 1 Effects of ascorbic acid concentration on the thermal stability of anthocyanins from passion fruit peel
2.2 加热时间对抗坏血酸存在下PFP花色苷模型饮料热稳定性的影响
按1.3.2节方法配制PFP和PFP+VC 2 种饮料体系,在水浴温度85 ℃、加热时间5 h条件下,研究抗坏血酸对PFP花色苷热稳定性的影响,结果见图2。
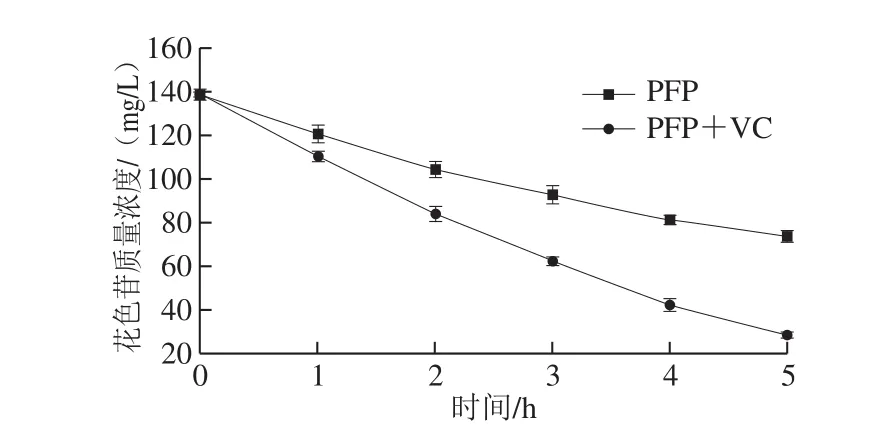
图 2 抗坏血酸对PFP花色苷热稳定性的影响Fig. 2 Thermal stability of anthocyanins from passion fruit peel in the presence of 0.6% ascorbic acid
由图2可知,随着加热时间的延长,2 种模型饮料体系中花色苷质量浓度都呈下降趋势,仅有花色苷的体系在热处理后花色苷质量浓度下降较缓慢,而添加抗坏血酸的体系下降趋势更快。说明在质量分数0.6%的抗坏血酸存在下,花色苷的稳定性降低,并且在热处理期间显示出褪色现象,这是由于抗坏血酸与花色苷B环羟基之间的缩合反应以及抗坏血酸氧化过程产生的过氧化氢导致的[22]。虽然抗坏血酸对花色苷有不利影响,但是抗坏血酸作为营养强化剂和抗氧化剂以及其特殊的风味,仍被广泛加入到商业饮料中。
2.3 LA和HA结冷胶对PFP花色苷热稳定性的影响
分别配制质量分数为0%、0.1%、0.2%、0.3%、0.4%、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%的LA结冷胶和HA结冷胶溶液,在PFP花色苷质量分数为0.3%、抗坏血酸质量分数为0.6%、水浴温度85 ℃、加热时间5 h条件下,研究不同质量分数LA和HA结冷胶对PFP花色苷稳定性的影响,结果见图3。
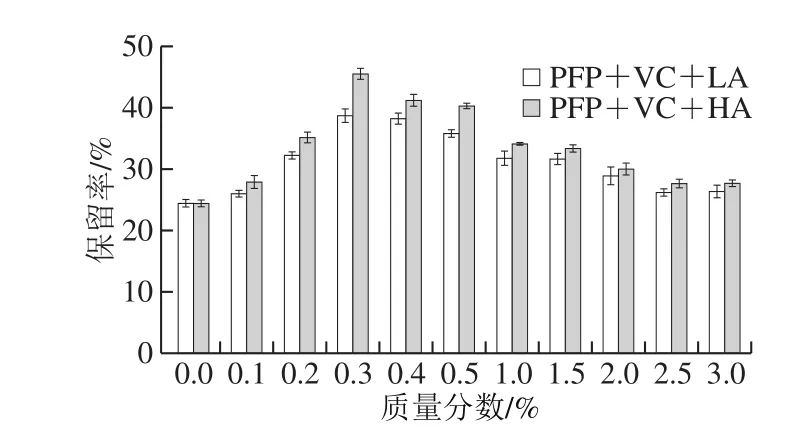
图 3 LA和HA结冷胶体系质量分数对PFP花色苷稳定性的影响Fig. 3 Effects of LA and HA concentration on the stability of anthocyanins from passion fruit peel
由图3可知,随着2 种结冷胶质量分数的不断升高,PFP花色苷保留率均呈先升高后下降的趋势。在0%~0.3%范围内,LA和HA结冷胶的添加使保留率上升较快,在0.3%的结冷胶体系中保留率达到顶峰,这可能归因于在低质量分数下,结冷胶分子中构象的延伸性更好,从而暴露出更多的糖蛋白,通过与花色苷相互作用,增强花色苷的稳定性[23]。但随着结冷胶质量分数不断升高,保留率开始下降,花色苷稳定性降低,说明花色苷的稳定不依赖于高质量分数的结冷胶,这可能是高质量分数的结冷胶分子间空隙太过紧密导致结冷胶分子构象更加紧凑,伴随着空间位阻的减少,花色苷与糖蛋白间的相互减少,稳定性降低[24]。同时,HA体系对花色苷的稳定性始终高于LA体系,可能是因为HA结冷胶拥有更高程度的酰化,与花色苷间具有更加良好协同作用,并在酸性条件下形成更稳定的分散体系,从而达到稳定胶体的作用[25]。因此,添加较低质量分数(0.2%~0.5%)的结冷胶更有助于花色苷的稳定。
2.4 PFP花色苷的降解动力学分析
Nakamura等[26]研究表明,凝胶长时间暴露在高温环境中,其机械性能改变。在高热环境暴露5 h后,结冷胶结构弱化,体积模量下降,结冷胶胶体链之间交联性变差,所以高温对结冷胶有破坏作用,但其仍能够在一定程度上缓解花色苷的降解。
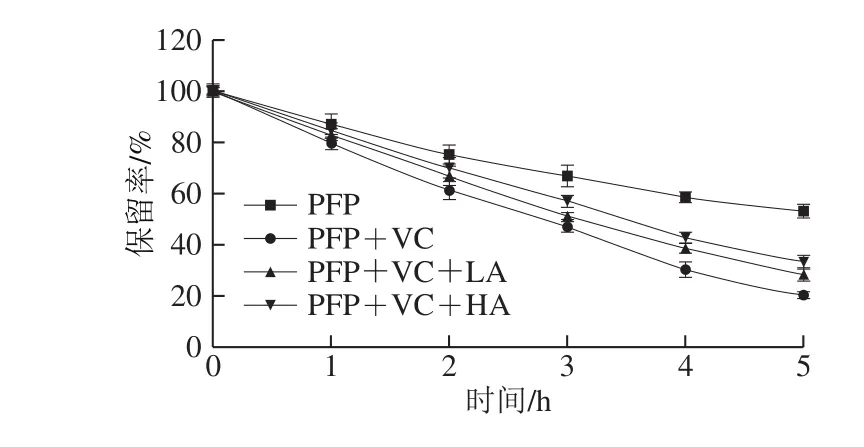
图 4 4 种模型饮料体系中花色苷保留率的变化Fig. 4 Changes in anthocyanin residues in four model beverage systems
由图4可知,花色苷随加热时间和模型饮料体系的变化发生了不同程度的降解反应。花色苷随加热时间的延长,保留率持续降低,不断地发生降解反应,热处理5 h后,4 种模型饮料体系中花色苷的保留率分别为53.08%、20.05%、28.82%、34.53%。结果表明,LA体系和HA体系在抗坏血酸存在下均能显著提高花色苷的稳定性(P<0.05),且HA体系比LA体系对于增强花色苷稳定性表现出更优越的性能,与Xu Xuejiao等[27]研究结果一致,这可能由于HA结冷胶酰化程度更高,其酰基在高温下带电而发生的相互排斥作用比LA结冷胶小,导致其糖苷键构象的变化也小,所以HA比LA结冷胶在稳定花色苷方面更有效。

图 5 4 种模型饮料体系中花色苷的降解动力学Fig. 5 Degradation kinetics of anthocyanins in four model beverage systems
一般而言,降解动力学模型的判断主要取决于拟合方程的线性回归系数R2最高的模型。由表1可知,4 种模型饮料体系中花色苷的降解动力学模型均为一级动力学模型,这与Zhang Zhaoqi等[28]研究结果一致。由图5可知,ln(C/C0)与t线性关系良好(R2>0.99),说明4 种模型饮料体系中PFP的降解动力学模型仍然符合一级动力学模型。

表 2 4 种模型饮料体系中花色苷动力学参数Table 2 Kinetic parameters for degradationof anthocyanins in four model beverage systems
由表2可知,PFP花色苷热降解速率k和半衰期t1/2受不同的模型饮料体系的影响。在单纯的花色苷溶液体系中,该体系表现出最低的降解速率0.002 3 min-1和半衰期308.44 min,但抗坏血酸的存在显著加速了花色苷的降解(P<0.05),k增至0.004 5 min-1,且半衰期155.09 min比未添加时降低近一半。向花色苷和抗坏血酸体系中添加LA和HA结冷胶,显著减缓了花色苷的降解(P<0.05),在含有LA和HA结冷胶的体系中t1/2分别为189.69 min和217.92 min,说明结冷胶的添加有助于花色苷的稳定,且HA结冷胶效果更好,这表明HA结冷胶的糖蛋白与花色苷之间有更大的相互作用,在高温处理后HA结冷胶构象排序,从无序的线圈状态转换为双螺旋结构,形成一个更有凝聚力的网络[29]。另外,HA结冷胶对抗坏血酸中带正电的质子比LA结冷胶更敏感,促使形成额外的氢键,整体凝胶的强度增加,从而带来更高的稳定性[30]。
2.5 4 种模型饮料体系对PFP花色苷色泽的影响
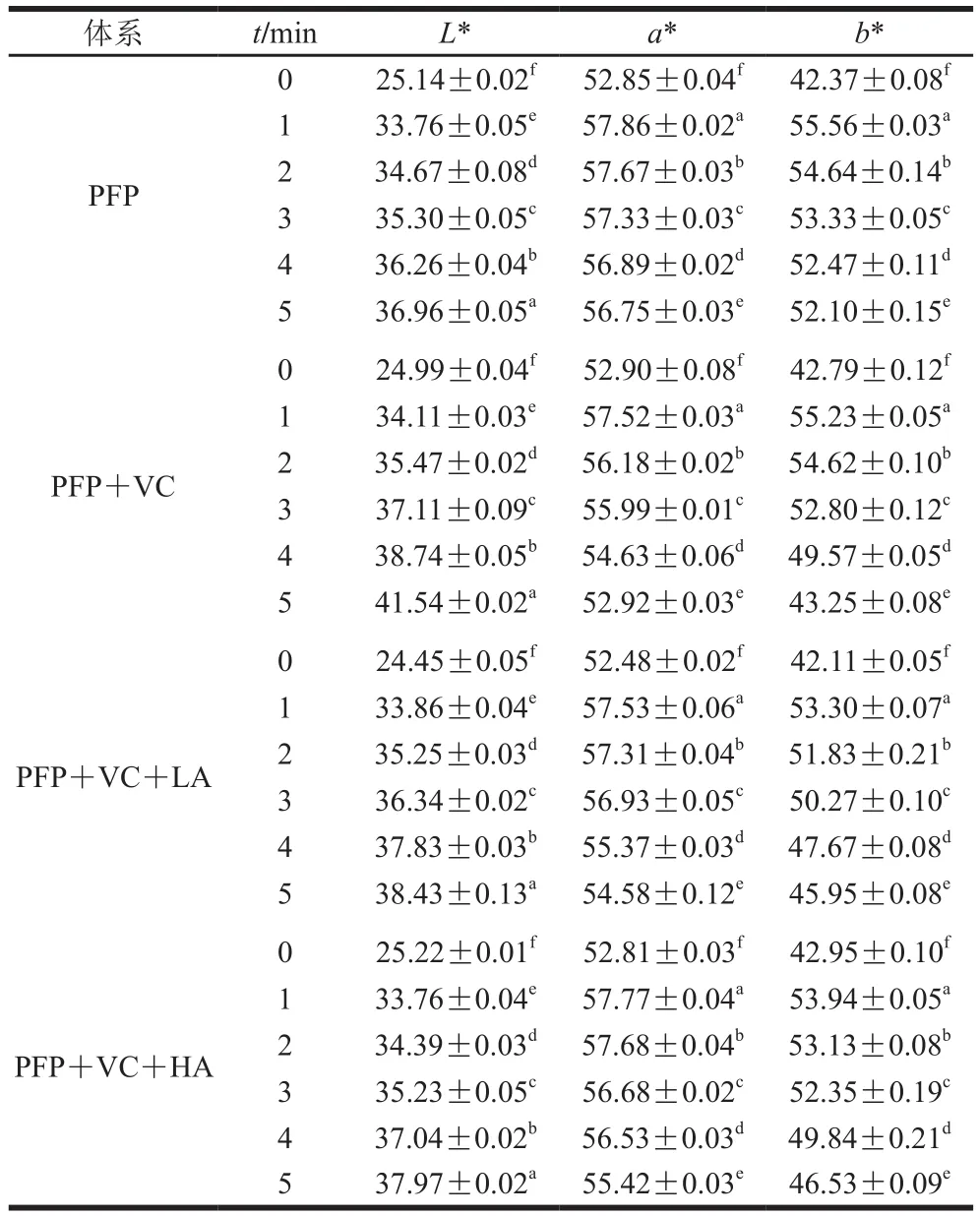
表 3 4 种模型饮料体系色泽的变化Table 3 Color changes of four model beverage systems
由表3可知,4 种模型饮料体系色泽受加热时间延长而变化,当4 种模型饮料体系未热处理时,各组L*、a*和b*值相差不大,在0~1 h范围内,其L*、a*和b*值均有显著增加(P<0.05),即4 种模型饮料系统呈色变亮,红色和黄色加深,这可能是高温加热初期花色苷发生了急剧的降解反应和氧化褐变反应,说明热处理1 h对花色苷稳定性不利影响较大,褪色较快。在1~5 h范围内,L*值显著增加,a*值显著减小,b*值显著减小(P<0.05),即4 种模型饮料系统呈色变亮、红色变淡、黄色加深,但1~5 h内每小时之间L*、a*、b*值变化较0~1 h小,这说明加热超过1 h时花色苷溶液仍出现广泛褪色现象,但较0~1 h褪色反应慢。由图6可知,随着加热时间的延长,只添加抗坏血酸的体系总色差总体呈上升趋势,其余3 个系统的总色差均持续下降。在加热1 h时,只添加VC的体系总色差比纯花色苷溶液总色差小,但加热2 h后只添加VC的体系总色差均大于纯花色苷溶液,这可能是抗坏血酸作为一种天然的抗氧化剂,在加热初期对花色苷具有一定的保护作用,但随着加热时间的延长,抗坏血酸在氧化过程中容易产生质子,然后转化为脱氢抗坏血酸,质子的存在也会导致过氧化氢的存在,它会分解成·OH,从而加速花色苷的降解,导致颜色褪减[31]。同时,LA体系和HA体系总色差均比其余2 个体系低,且HA体系的护色性能明显比LA体系优越,这与上述结果一致。
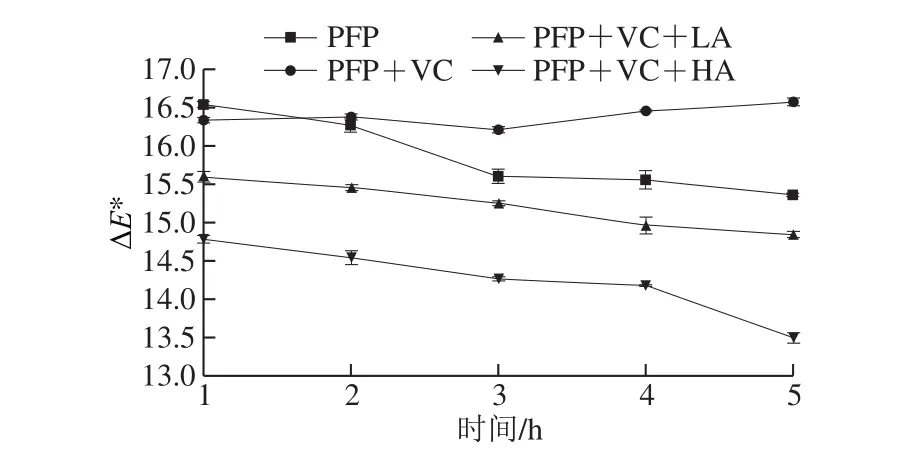
图 6 4 种模型饮料体系总色差的变化Fig. 6 Variations in total color difference of four model beverage systems
2.6 PFP花色苷的结构鉴定

图 7 PFP花色苷组分的高效液相色谱图Fig. 7 HPLC chromatogram of anthocyanin components in passion fruit peel
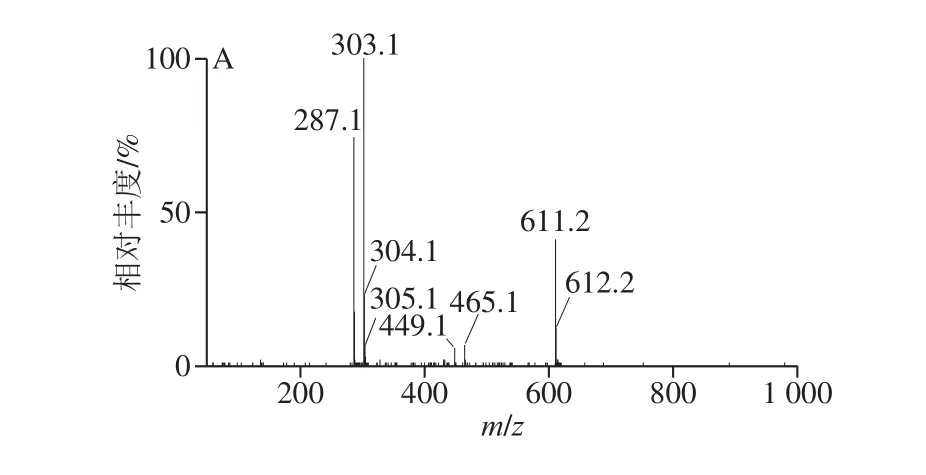

图 8 PFP花色苷组分的二级质谱图Fig. 8 Tandem spectra of anthocyanin components from passion fruit peel
PFP花色苷含量丰富,运用pH示差法测得PFP花色苷含量为46.18 mg/g。使用超高效液相色谱-四极杆-飞行时间串联质谱分析对PFP花色苷进行结构鉴定。从图7可以看出,样品检测到4 个峰:2 个主峰和2 个小峰,其相应的二级质谱图见图8。
由图8可知,PFP样品中含有相对分子质量为611、449、595、463的花色苷,通过其对应的二级碎片离子进一步分析,可以推测出PFP花色苷结构,结果见表4。
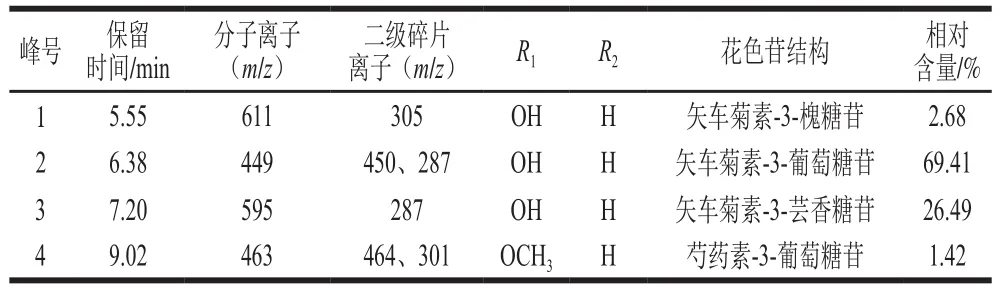
表 4 PFP花色苷组分的质谱信息Table 4 Mass spectral data of anthocyanin components from passion fruit peel
从表4可知,PFP中含有4 种花色苷,分别是矢车菊素-3-槐糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和芍药素-3-葡萄糖苷,其中矢车菊素-3-槐糖苷在PFP中为首次发现,该结论与祝慧[32]和Kidøy等[33]研究结果基本一致,鉴定出的4 种花色苷的化学结构如图9所示。
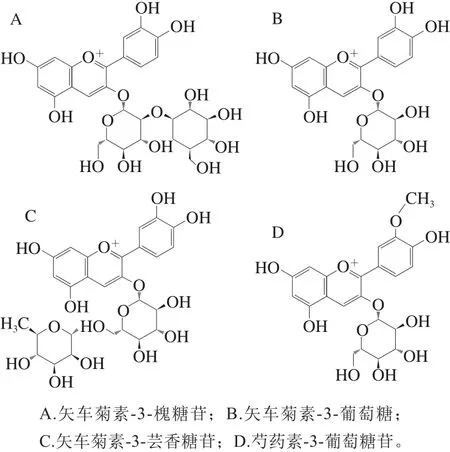
图 9 PFP中4 种花色苷组分的化学结构Fig. 9 Chemical structures of four anthocyanins from passion fruit peel
3 结 论
通过研究HA/LA结冷胶对含有抗坏血酸的模型饮料中花色苷的热稳定性的影响,得出以下结论:
在85 ℃水浴0~5 h条件下,PFP、PFP+VC、PFP+VC+LA和PFP+VC+HA这4 种模型饮料体系中花色苷含量均呈下降趋势,花色苷的降解符合一级动力学模型,其半衰期分别为308.44、155.09、189.69 min和217.92 min。低质量分数(0.2%~0.5%)的结冷胶可以提高花色苷的稳定性,且HA结冷胶与花色苷结合的相互作用强于LA结冷胶。
在加热1~5 h范围内,L*值显著增加,a*值显著减小,b*值显著减小(P<0.05),即4 种模型饮料体系呈色变亮、红色变淡、黄色加深,PFP花色苷仍出现广泛褪,但较0~1 h褪色反应慢色现象。
PFP富含花色苷,利用超高效液相色谱-四极杆-飞行时间串联质谱仪分析鉴定出4 种花色苷,分别为矢车菊素-3-槐糖苷、矢车菊素-3-葡萄糖、矢车菊素-3-芸香糖苷和芍药素-3-葡萄糖苷。

