新型鸭呼肠孤病毒一步法TaqMan-MGB荧光定量RT-PCR检测方法的建立与应用
云 涛,华炯钢,叶伟成,倪 征,陈 柳,张 存
(浙江省农业科学院 畜牧兽医研究所,浙江 杭州 310021)
鸭呼肠孤病毒病是由鸭呼肠孤病毒(duck reovirus,DRV)引起的番鸭、半番鸭、麻鸭、北京鸭、樱桃谷鸭、绿头野鸭和鹅等水禽的急性传染病[1-3]。自1997年以来,我国广东、福建、浙江和广西等番鸭养殖地暴发了一种以软脚为临床症状,以肝、脾表面有少量白点为主要病理变化的“番鸭肝白点病”,经鉴定该病病原为经典鸭呼肠孤病毒(classical duck reovirus,CDRV),即番鸭呼肠孤病毒(muscovey duck reovirus,MDRV),属于基因Ⅰ型[4-6]。自2000年以来,在我国江苏、浙江、福建、广东、河北、山东等地广泛流行一种鸭新型呼肠孤病毒病,病鸭肝脏出现不同程度点斑和块状出血,脾脏肿大甚至坏死,发病率5%~40%,病死率10%~50%,且病鸭日龄愈小,其发病率、病死率愈高,经分离鉴定该病原为鸭新型呼肠孤病毒(novel duck reovirus,NDRV),属于基因Ⅱ型[7]。
NDRV与CDRV同属于呼肠孤病毒科(Reoviridae),正呼肠孤病毒属(Orthoreovirus),为分节段的双股RNA病毒。NDRV含有10个RNA片段,即3个大基因L1、L2、L3,分别编码λA、λB、λC蛋白;3个中基因M1、M2、M3,分别编码μA、μB、μNS蛋白;4个小基因S1、S2、S3、S4,分别编码σA、σB、σC、σNS、P10、P18蛋白;其中8个结构蛋白,4个非结构蛋白[5-6]。NDRVS3基因具有不同于MDRV和禽呼肠孤病毒(avian reovirus,ARV)S3基因的分子特征[8-9]。根据其S3基因的差异,常采用实时荧光定量PCR方法检测NDRV。已有研究主要采用两步法进行NDRV qRT-PCR检测[10-12],即先对样品RNA进行反转录,再以转录产物为模板进行实时定量PCR,该方法操作复杂,易污染。本研究根据GenBank公布的NDRVS3基因序列进行分析比较,在基因保守区域设计1对特异性扩增引物和1个MGB探针引物,利用体外转录的NDRVS3基因作为标准品制作标准曲线,建立NDRV一步法TaqMan-MGB荧光定量RT-PCR检测方法,并与常规qRT-PCR检测方法进行比较,旨在为NDRV的早期诊断、分子流行病毒学调查及疫苗研制提供有效的技术手段。
1 材料与方法
1.1 试验材料
1.1.1 毒株
新型鸭呼肠孤病毒(NDRV JDm10)、经典鸭呼肠孤病毒(CDRV ZJ2000M)、鸭坦布苏病毒(DTMUV ZJ407)、鸭瘟病毒(duck plague virus,DPV)、鸭源新城疫病毒(Newcastle disease virus,NDV)、番鸭细小病毒(muscovy duck parvovirus,MDPV)、Ⅰ型鸭甲肝病毒(duck hepatitis A virus 1,DHAV-1)和H9N2亚型禽流感病毒(avian influenza virus,AIV),均由浙江省农业科学院畜牧兽医研究所禽病研究室分离保存;宿主菌大肠埃希菌DH-5α由浙江省农业科学院畜牧兽医研究所禽病研究室繁殖保存。
1.1.2 主要试剂仪器
One Step PrimeScriptTMRT-PCR试剂盒、MiniBEST病毒核酸提取试剂盒、MiniBEST琼脂糖凝胶DNA提取试剂盒、MiniBEST质粒提取试剂盒购自宝生物工程(大连)有限公司;pBluescript Ⅱ SK(+)载体购自美国Stratagene公司。MEGAscript®T7体外转录试剂盒、MEGA clearTM净化试剂盒购自美国Life Technologies公司。核酸分析仪购自Quawell公司;ABI 7500荧光定量PCR仪购自美国Applied Biosystems公司。
1.2 试验方法
1.2.1 引物的设计与合成
参照GenBank中NDRV JDm10、CDRV ZJ2000M、DTMUV ZJ407、DPV、NDV、MDPV、DHAV-1和AIV等病毒的S3基因序列进行同源性比较,选择保守序列作为扩增区域,采用Primer Primier 3.0软件设计引物和MGB探针,该探针5′端标记的荧光报告基团为FAM,3′端标记的荧光淬灭基团为MGB,预扩增片段为128 bp。上游引物P1:5′-ACAAGTGTCATCAACAGCAATATCG-3′;下游引物P2:5′-ATCATAGTAATCTGCAATGACATGCA-3′;MGB探针:FAM-CGCACTACAGAGCAA-MGB。
1.2.2 标准RNA样品的制备
按照病毒核酸提取试剂盒操作说明提取NDRV JDm10总RNA,以P1和P2为引物,扩增获得特异性目的条带,经DNA凝胶回收试剂盒切胶回收后,将目的片段定向插入pBluescript Ⅱ SK(+)载体中,构建重组质粒并由大连宝生物公司测序。测序正确的阳性重组质粒(pSK-SigB)用限制性内切酶BamHⅠ进行线性化,然后使用MEGAscript®T7体外转录试剂盒对线性化产物进行体外转录,经DNaseⅠ消化后得到单链目的基因RNA,再用MEGA clearTM纯化试剂盒进行纯化,最终获得标准RNA样品。使用核酸分析仪测定标准RNA浓度和纯度,并根据转录获得的RNA分子量计算拷贝数,-80 ℃保存备用。
1.2.3 反应体系及条件的优化
以制备的标准品RNA为模版,参照One Step PrimeScriptTMRT-PCR试剂盒说明书,采用20 μL反应体系,通过矩阵法对引物浓度和探针浓度进行优化,以确定最佳的工作浓度,获得最佳的反应体系。通过设置不同的退火温度(52~60 ℃),根据反应扩增曲线和Ct值的大小,以确定最佳退火温度。反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,52~60 ℃ 31 s,40个循环。
1.2.4 标准曲线的建立
将制备的标准品RNA按10倍倍比稀释,按照1.2.3节中优化的一步法荧光定量RT-PCR反应生成标准曲线,同时设阴性对照。
1.2.5 敏感性试验
将标准品RNA进行101~1010倍比稀释,进行一步法荧光定量RT-PCR检测,以确定该方法的敏感性。
1.2.6 特异性实验
以CDRV、DHV-1、DTMUV、H9N2 AIV、NDV的RNA,以及MPV和DPV的DNA为模板,在相同的条件下进行qRT-PCR检测,以验证引物和探针的特异性,并设阳性对照(NDRV DF-1细胞RNA)和阴性对照(正常DF-1细胞RNA为模板)。
1.2.7 重复性试验
以稀释成1.0×108、1.0×107、1.0×106、1.0×105、1.0×104拷贝·μL-1这5个浓度梯度的标准品RNA为模版,进行qRT-PCR分析,分别进行3次批次内和批次间的重复性试验,同时设阴性对照。计算组内与组间变异系数。根据获得的Ct值,利用统计学方法计算出组内与组间反应Ct值的变异系数(coefficient of variation,CV),以确定该方法的稳定性。
1.2.8 临床样品的检测
使用建立的一步法qRT-PCR检测方法,对2011—2015年间临床收集的浙江各地239份疑似DRV病料(肝脏和脾脏)进行检测,并与常规RT-PCR方法进行比较[13]。
2 结果与分析
2.1 一步法MGB探针qRT-PCR方法的优化
最佳反应体系为20 μL:2×One Step RT-PCR Buffer Ⅲ 10 μL、TaKaRa ExTaqHS 0.4 μL、 Prime Script RT Enzyme Mix Ⅱ 0.4 μL、上下游引物(10 μmol·L-1)各0.4 μL、MGB探针(10 μmol·L-1)0.8 μL、模版2 μL、荧光染料0.4 μL、RNase Free ddH2O 5.2 μL。最佳退火延伸温度为54 ℃。最佳反应条件为:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,54 ℃ 31 s,40个循环。
2.2 标准曲线的建立
以10倍比系列稀释的RNA标准品(1.0×109拷贝·μL-1~1.0×101拷贝·μL-1)为模版,优化的反应体系和反应条件进行一步法TaqMan-MGB荧光定量RT-PCR反应生成标准曲线(图1)。标准品模板浓度与Ct值呈现良好的线性化关系,y=-3.477x+42.504,相关系数R2为0.999。
2.3 敏感性试验
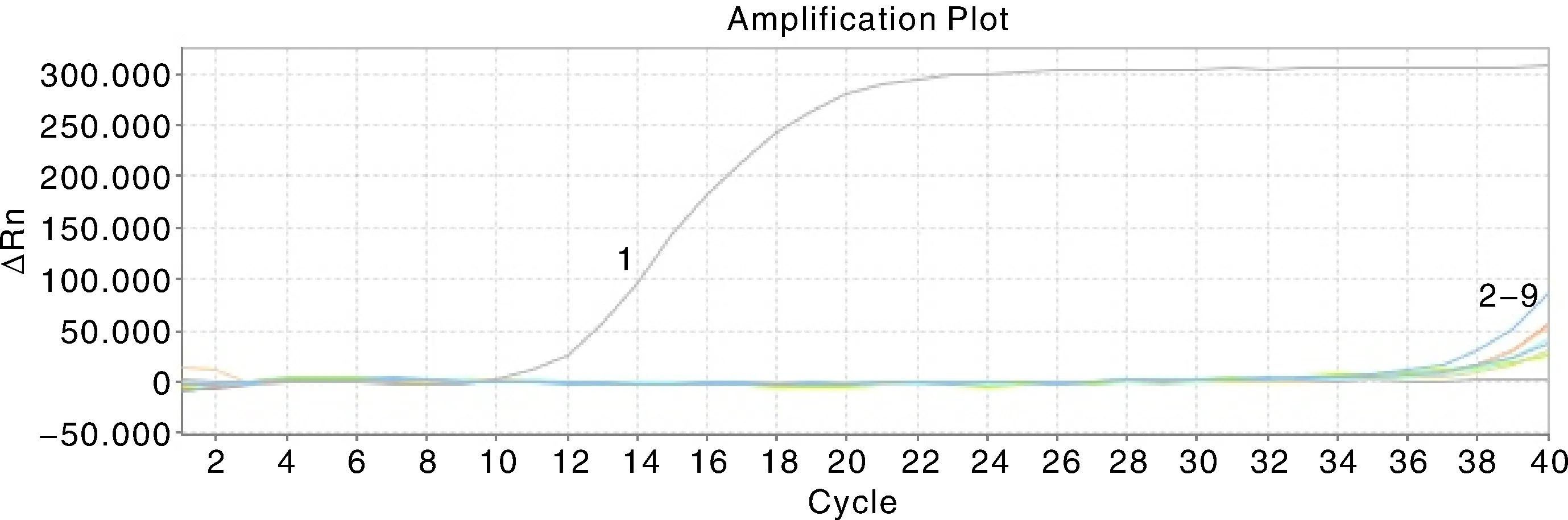
将RNA标准品10倍系列稀释,用建立的一步法TaqMan-MGB荧光定量RT-PCR检测方法进行检测(图2)。结果表明,该方法的检测低限为10拷贝·μL-1,且有典型的扩增曲线,具有良好的敏感性。
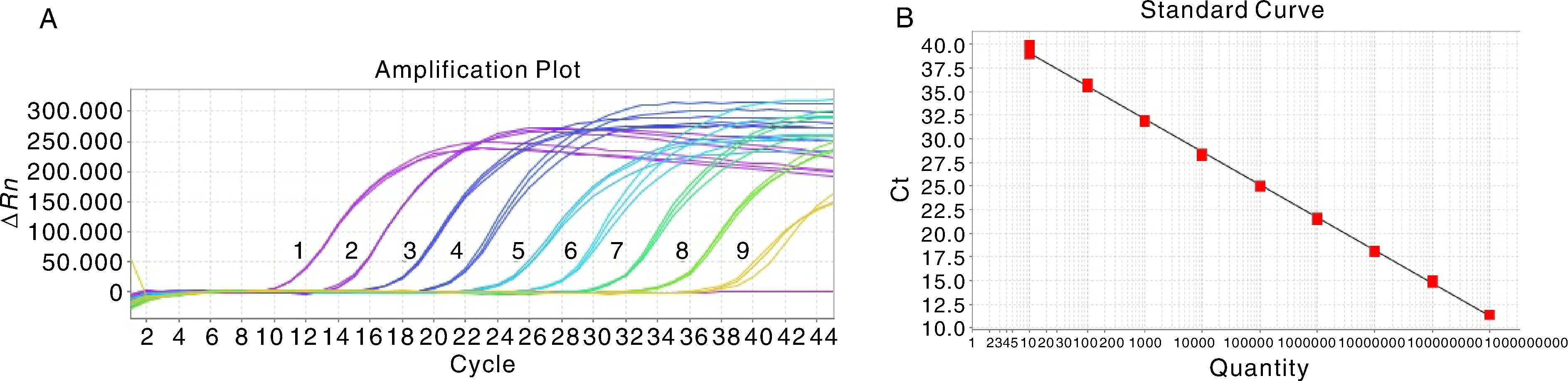
1~9:1.0×109~1.0×101拷贝·μL-1。下同。 1-9: 1.0×109~1.0×101 copies·μL-1. The same as below.图1 NDRV一步法TaqMan-MGB荧光定量RT-PCR扩增曲线(A)和标准曲线(B)Fig.1 The amplification (A) and standard (B) curve of one-step real-time TaqMan-MGB RT-PCR for NDRV
2.4 特异性试验
用建立的一步法TaqMan-MGB荧光定量RT-PCR方法对CDRV、DHV-1、DTMUV、H9N2 AIV、NDV、MPV、DPV、NDRV阳性对照和阴性对照的核酸进行检测(图3)。结果显示,仅NDRV核酸检测结果为阳性,其他病毒的核酸检测结果均为阴性,表明该方法具有很好的特异性。
2.5 重复性试验
分别对标准品进行批内重复和批间重复检测,组内和组间Ct变异系数均小于2%(表1),表明该检测方法重复性良好。
2.6 临床样品检测
采用建立的一步法TaqMan-MGB荧光定量RT-PCR方法对临床采集的239份疑似病例样品(肝脏、脾脏)进行检测,并与常规RT-PCR方法进行比较。结果显示,常规RT-PCR检测239份样品时有75份为阳性,一步法TaqMan-MGB荧光定量RT-PCR方法检测时有100份为阳性,而且常规RT-PCR检测出的阳性样品用一步法TaqMan-MGB荧光定量RT-PCR检测时均为阳性,符合率为100%。

图2 NDRV一步法TaqMan-MGB荧光定量RT-PCR敏感性试验Fig.2 Sensitivity of one-step real-time TaqMan-MGB RT-PCR for NDRV
1,新型鸭呼肠孤病毒阳性对照;2,经典鸭呼肠孤病毒;3,鸭坦布苏病毒;4,鸭瘟病毒;5,Ⅰ型鸭甲肝病毒;6,番鸭细小病毒;7,H9N2亚型禽流感病毒;8,鸭源新城疫病毒;9,阴性对照。 1, NDRV JDm10 positive control; 2, CDRV ZJ 2000M; 3, DTMUV ZJ407; 4, DPV; 5, DHAV-1; 6, MDPV; 7, AIV; 8, NDV; 9, Negative control.图3 NDRV一步法TaqMan-MGB荧光定量RT-PCR特异性试验Fig.3 Specificity of one-step real-time TaqMan-MGB RT-PCR for NDRV
表1 一步法TaqMan-MGB荧光定量RT-PCR组内和组间重复性试验
Table 1 Intra assay and inter assay reproducibility of one-step real-time TaqMan-MGB RT-PCR

RNA标准品浓度Concentration of standard (copies·μL-1)组内变异实验 Inter-assay variability平均数 Mean±SD变异系数 CV/%组间变异实验 Intra-assay variability平均数 Mean±SD变异系数 CV/%1×10814.89±0.0660.4414.99±0.1270.851×10717.98±0.1460.8117.92±0.2651.481×10621.84±0.1630.7521.81±0.1980.911×10524.93±0.1810.7324.81±0.2721.101×10428.32±0.1870.6627.98±0.4471.60
3 讨论
尽管CDRV和NDRV都属于禽正呼肠孤病毒群成员,病毒生物学特性有很多相似性,但是两者在致病性和抗原性上存在显著差异。NDRV感染宿主谱扩大,可引起各品种鸭及鹅感染发病,且致病性增强[14-15]。血清交叉中和试验表明,CDRV与NDRV间仅有弱的交叉中和作用[9]。CDRV与NDRV基因组也存在差异。首先,两者的SDS-PAGE电泳图谱明显不同,CDRV为3/3/4图式,而NDRV为3/3/1/3图式,与ARV相同[16];其次,L、M和S群基因组片段中,S群基因组片段序列变异性最大,S1基因编码的结构蛋白σC和非结构蛋白p10序列变异性最大[4-6,15]。研究发现,σC蛋白与病毒特异性中和反应的表面抗原有关,能够刺激机体产生保护性中和抗体,且该蛋白位于外衣壳的表面,可通过受体介导识别和附着靶细胞,具有受体功能[17-18]。因此,造成NDRV致病性、致病宿主谱扩大的原因可能与结构蛋白σC蛋白变异有关。
目前NDRV病毒常采用实时定量RT-PCR方法检测,基本采用的都是荧光染料法[11-12],该方法中荧光染料可与引物二聚体、引物单链二级结构和错误扩增产物进行非特异性结合,从而造成假阳性。采用两步法探针qRT-PCR方法检测NDRV时,需要对样品RNA进行反转录,检测步骤烦琐,实际临床检测敏感性偏低[19]。本研究建立了NDRV一步法TaqMan-MGB荧光定量RT-PCR检测方法,对体外转录获得的阳性标准品最低检测量为10拷贝·μL-1,比常规RT-PCR敏感性高100倍,并比袁远华等[11]和丁明洋等[12]建立的二步法SYBR Green荧光定量RT-PCR方法的敏感性高或相同。一步法实时定量RT-PCR方法,由于直接以体外转录的含目的基因的RNA为模板,且反转录与聚合酶链式反应在同一PCR管中进行,既降低了试验操作的误差和样品被感染的概率,又缩短了检测时间[20]。同时,与常规TaqMan探针相比,MGB探针在不增加探针引物长度时就可使探针的Tm值提高,使探针杂交的稳定性增加,从而进一步提高了扩增产物的特异性[21]。
本研究建立的NDRV一步法TaqMan-MGB荧光定量RT-PCR检测方法,不但可以定性检测NDRV,而且还可通过制备的标准曲线计算核酸拷贝数,以达到定量检测的目的。其次,通过定量检测病鸭各个组织脏器及体液中的NDRV载量,有助于确定发病鸭群整体的感染状况及感染程度,并为该疫病进一步的防治和防控技术提供依据。该检测方法快速、灵敏、特异、稳定,且操作简便,为NDRV疫苗的研究、临床样品的实验室诊断和早期流行病学调查提供了一种快捷有效的检测方法和技术手段。

