青花菜钙依赖蛋白激酶基因BoCDPK1的克隆与表达
邬菲帆,王佳怡,戴晨宇,杨如棉,徐鹏杰,管 铭,张慧娟,蒋 明
(台州学院 生命科学学院,浙江 台州 318000)
青花菜(Brassicaoleraceavar.italica)又名西兰花、青花椰菜和意大利芥蓝等,是十字花科(Cruciferae)芸薹属甘蓝类蔬菜[1]。青花菜以花球和花茎为主要食用部位,它们色泽翠绿、营养丰富,富含矿物质、膳食纤维、蛋白质和维生素,还含有具抗癌作用的硫苷类物质,青花菜已成为一种深受人们喜爱的保健蔬菜[2-3]。浙江是我国青花菜主产省,全省常年种植面积达1.33万hm2,花球产量占全国的40%[4]。近年来的调查发现,浙江青花菜产区菌核病和霜霉病的发生十分严重,甚至成片受害,给菜农造成巨大的经济损失。我国不是青花菜的原产地,种质资源极为匮乏,抗病材料更是稀缺;通过挖掘与青花菜抗病相关的功能基因,并开展分子育种,是种质创新的重要途径之一[5]。近年来的研究发现,钙信号转导途径在植物生长发育和逆境防御过程中起重要作用,其中的钙依赖蛋白激酶(calcium-dependent protein kinase,CDPK)是钙信号转导途径的组成因子,它参与多种Ca2+介导的信号途径,在抵御生物和非生物逆境中扮演着重要角色[6]。
Ca2+作为第二信使,参与植物发育和逆境防御过程的信号响应,而CDPK作为Ca2+传感蛋白,它们通过磷酸化离子通道蛋白、转录因子和代谢酶等底物,触发一系列的生理生化反应[7-8]。典型的CDPK具有1个S_TKc(serine/threonine protein kinases, 苏氨酸/丝氨酸蛋白激酶)结构域和多个串联的EF手性(EF hand)结构域。S_TKc结构域通常由300多个氨基酸残基组成,用于结合ATP和调节蛋白酶活性,而EF手性结构域能与Ca2+亲和结合[9]。自首次从豌豆(Pisumsativum)中分离到CDPK以来,研究人员已在铁皮石斛(Dendrobiumofficinale)、普通烟草(Nicotianatabacum)、拟南芥(Arabidopsisthaliana)、盐藻(Dunaliellasalina)、毛白杨(Populustomentosa)和二穗短柄草(Brachypodiumdistachyon)等植物中克隆得到CDPK基因,并对部分成员进行了表达分析和功能鉴定[10-16]。但是,有关青花菜CDPK基因的研究未见报道。本研究以青花菜为材料,在克隆CDPK基因的基础上,利用qRT-PCR技术研究它们在霜霉菌和核盘菌侵染下的表达模式,为将来开展基因功能鉴定和抗逆分子育种奠定基础。
1 材料与方法
1.1 材料
选取健康、饱满的Wx青花菜种子,播种于无菌基质(椰砖∶珍珠岩∶蛭石体积比1∶1∶1),放入人工气候箱(温度22 ℃,16 h光照/8 h黑暗,相对湿度75%)中培育幼苗。在两叶一心期,选取生长健壮、长势一致的幼苗移栽至新的无菌基质中。霜霉菌的接种采用喷雾法,在0、6、12、24、36、72、96 h采集叶片。核盘菌的接种采用菌丝块法,用直径为6 mm的无菌打孔器切取琼脂块,具菌丝一侧贴于叶片上表面,对照采用空白PDA块,接种处理0、6、12、24、36、72 h采集叶片,每个处理设置3个生物学重复。叶片置于-80 ℃超低温冰箱中保存,用于后续的DNA或RNA提取。实验材料对菌核病和霜霉病均表现为低感,接种核盘菌12 h,PDA接触位置开始发黑,72 h病斑变大,并发生腐烂;接种霜霉菌72 h,叶面出现少量枯斑,7 d病斑较多,周围出现明显的褪绿圈,叶背出现霉层。
1.2 方法
1.2.1 DNA和RNA提取
基因组DNA和RNA的提取采用试剂盒法,试剂盒购自北京鼎国昌盛生物技术有限责任公司;RNA提取采用TaKaRa的MiniBEST Plant RNA Extraction Kit试剂盒,实验操作根据说明书进行。DNA和RNA经电泳检测后,置于-80 ℃冰箱保存备用。cDNA的合成采用TaKaRa公司的试剂盒,操作按说明书进行。
1.2.2 青花菜CDPK基因的克隆
根据野甘蓝(B.oleraceavar.oleracea, XP_013613262)和甘蓝型油菜(B.napus, NP_001302636)的CDPK基因序列设计PCR引物,上游和下游引物分别为5′-ATGGGCAATTCATGCCGTGG-3′与5′-CTAAGCGTCTCTCATGCTAATGTTCAG-3′。在20 μL反应体系中,加入14.3 μL ddH2O、2.0 μL缓冲液(含20 mmol·L-1Mg2+)、0.5 μL dNTPs(10 mmol·L-1)、0.4 μL上游引物、0.4 μL下游引物(20 μmol·L-1)、2.0 μL模板DNA(20 ng·μL-1)和0.4 μLTaq酶(2 U·μL-1)。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,56 ℃退火45 s,72 ℃延伸2 min,共32个循环;72 ℃延伸10 min。
1.2.3 PCR产物的回收、转化和测序
PCR产物经凝胶电泳检测后,用DNA凝胶回收试剂盒回收片段,试剂盒购自碧云天生物技术研究所。连接采用TaKaRa试剂盒,在PCR管中依次加入5 μL T4 DNA连接缓冲液、1 μL T-easy载体、3 μL回收产物和1 μL T4 DNA连接酶,置于4 ℃冰箱中连接过夜。经转化、单菌落挑取和菌液PCR鉴定,取3个阳性克隆测序。
1.2.4 BoCDPK1基因的序列分析
用SMART工具(http://smart.embl.de)预测编码蛋白的结构域;借助MEGA-X软件构建系统发育树,建树方法为邻接法(neighbour-joining),经1 000次自举检测。BoCDPK1的同源蛋白序列下载自NCBI,它们分别来自陆地棉(Gossypiumhirsutum)、海岛棉(G.barbadense)、雷蒙德氏棉(G.raimondii)、甘蓝型油菜(B.napus)和芜菁(B.rapa)等。
1.2.5BoCDPK1基因表达分析
根据测序得到的序列,设计qRT-PCR上下游引物,分别为:5′-TCCATCACCATCACCCACGTTTC-3′和5′-GGTTCTTTCACGGGAAGCACAAG-3′。以肌动蛋白基因为内标,引物为:5′-ACGTGGACATCAGGAAGGAC-3′和5′-GAACCACCGATCCAGACACT-3′。qRT-PCR反应在Roche LightCycler 96上进行,分别加入10 μL 2 × Master Mix、上下游引物各0.2 μL(20 μmol·L-1)、2.5 μL cDNA和7.1 μL ddH2O;反应程序为95 ℃预变性2 min;94 ℃变性15 s,59 ℃退火15 s,68 ℃延伸20 s,共40个循环。用2-ΔΔCt计算相对表达量,每个样品技术重复3次。利用SPSS 22.0进行单因素方差分析,差异显著性比较采用Duncan’s新复极差法。
2 结果与分析
2.1 BoCDPK1基因及其编码蛋白的特征
分别以叶片基因组DNA和cDNA为模板进行PCR扩增,经转化和测序,得到各自的核苷酸序列(图1)。结果表明,BoCDPK1的基因组DNA全长为2 414 bp,具7个外显子和6个内含子,第1外显子最长,为730 bp,第6外显子次之,长度为225 bp,第7外显子最短,仅111 bp;内含子均符合GT-AG规则,长度范围为76~354 bp,第1内含子最长,第5内含子次之,为88 bp,第4内含子最短(图2)。
BoCDPK1的编码区全长为1 647 bp,编码548个氨基酸。经SMART在线工具预测,BoCDPK1具1个S_TKc结构域和4个EF手性结构域(图3)。S_TKc结构域位于+89-+347处,而4个EF手性结构域分别位于+394-+422、+430-+458、+466-+494和+500-+528。
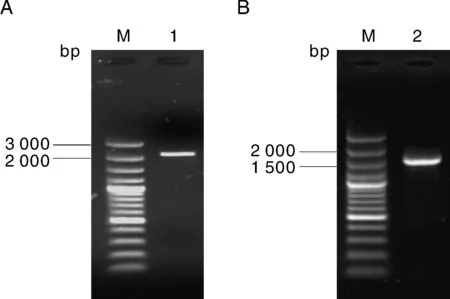
A—基因组DNA模板;B—cDNA模板。M,DNA标准分子质量;1和2为PCR产物。 A-genomic DNA as template; B-cDNA as template。M, DNA marker; 1 and 2, PCR products.图1 BoCDPK1基因的克隆Fig.1 Isolation of BoCDPK1 gene

方框表示外显子,直线为内含子。 Boxes indicated exons, and lines showed introns.图2 BoCDPK1基因的结构Fig.2 The gene structure of BoCDPK1
2.2 BoCDPK1的系统发育分析
从NCBI下载BoCDPK1的同源序列进行多重比对,这些序列中,拟南芥CDPK(OAP08681)参与气孔开闭,还与受伤导致的乙烯生物合成相关;其他基因的功能未知。序列比对结果表明,BoCDPK1与甘蓝型油菜、芜菁和野甘蓝(B.oleraceavar.oleracea)的序列相似性较高,仅个别氨基酸残基存在差异。与野甘蓝相比,BoCDPK1在+47、+48和+52位存在N氨基酸的缺失。与4种芸薹属植物相比,拟南芥CDPK序列上存在多处插入、缺失和变异现象(图4)。3种棉属植物CDPK序列之间也十分保守,仅在个别氨基酸残基上发现差异,但它们与其他物种CDPK的序列差异较大。
系统发育分析结果表明,青花菜BoCDPK1与3种芸薹属植物的CDPK处于同一分支,支持率达100%,它们再与山嵛菜(Eutremasalsugineum, XP_024016164)聚于一组,支持率较小,仅为53%;3种棉属植物聚于同一分支,支持率达100%,它们与大戟科(Euphorbiaceae)的麻风树(Jatrophacurcas, XP_020535061)和蓖麻(Ricinuscommunis, NP_001310655)聚于一组;十字花科的亚麻荠(Camelinasativa, XP_010467489)和荠(Capsellarubella, XP_006297360)聚于一组,支持率为89%;而山柑科(Capparaceae)的醉蝶花(Tarenayahassleriana, XP_010548179)与豆科(Leguminosae)的大豆(Glycinemax, XP_003519696)单独成组(图5)。

划线部分为S_TKc结构域;高亮部分为EF手性结构域。 The underlined residues indicated the S_TKc domain; The highlighted residues showed EF-hand domains.图3 BoCDPK1基因及其编码蛋白序列Fig.3 Gene sequence of BoCDPK1 and its deduced protein sequence

图4 BoCDPK1部分序列及其同源蛋白的比较Fig.4 Comparisons of partial BoCDPK1 and its homologous sequences
2.3 BoCDPK1的表达分析
为明确BoCDPK1在霜霉菌和核盘菌侵染下的表达特点,以cDNA为模板,利用qRT-PCR进行定量分析。结果表明,BoCDPK1的表达受霜霉菌和核盘菌的诱导,相对表达量呈先上升后下降的规律。在霜霉菌侵染下,6~12 h的表达量未见显著变化,24、36、72、96 h的表达量为对照的1.79、2.24、3.4和1.64倍(图6-A)。在核盘菌侵染下,6~72 h的表达量显著上升,其中24 h和36 h的表达量分别为对照的2.4和3.5倍(图6-B)。
3 讨论
钙调蛋白(calmodulin)、钙调磷酸酶B类似蛋白(calcineurin B-like protein)、钙调素类似蛋白(calmodulin like protein)和CDPK为常见的Ca2+传感蛋白,它们根据Ca2+浓度调控下游产生级联反应,其中的CDPK通过磷酸化作用调节基因的表达[17]。CDPK参与植物生长发育,牵牛(Pharbitisnil)PnCDPK1基因的表达受光照诱导,在种子萌发、幼苗生长、花形成和果实成熟过程中起着重要作用[18];马铃薯(Solanumtuberosum)StCDPK1和StCDPK3在匍匐茎中表达,与块茎早期发育和膨大相关[19];烟草NtCDPK1在根尖、茎尖和花蕾中表达,与细胞分裂、分化和凋亡相关[20];拟南芥CDPK28在胚根、根、子叶、莲座叶、花和果荚中表达,表明它参与拟南芥的生长发育过程[21]。本研究从青花菜中克隆到1个CDPK基因,在明确序列特征的基础上,进行了表达和系统发育分析。多序列比对发现,BoCDPK1与其他物种的N端变异较大,为高度可变区域,但它们的S_TKc结构域和EF手性结构域高度保守,与前人的研究结果吻合[22]。EF手性结构域为CDPK的调控域,可与Ca2+高度亲和结合,序列突变将影响亲和性[23]。

图5 BoCDPK1及其同源序列的系统发育树Fig.5 Phylogenetic tree of BoCDPK1 and its homologous sequences

A—霜霉菌;B—核盘菌。不同处理间没有相同字母表示差异显著(P<0.05)。 A-Hyaloperonospora parasitica; B-Sclerotinia sclerotiorum. The bars with different letters showed the significant difference (P<0.05).图6 青花菜BoCDPK1基因在病原菌胁迫下的表达Fig.6 Expression of broccoli BoCDPK1 gene challenged by pathogens
CDPK还参与逆境响应,与多种非生物胁迫和生物胁迫有关。拟南芥CDPK28的表达受NaCl和甘露醇诱导,它过量表达会积累较多的脯氨酸,耐盐能力显著提高[21]。Urao等[24]研究发现,干旱胁迫与盐胁迫均能诱导拟南芥AtCDPK1和AtCDPK2基因的表达;蚕豆CDPK基因VfCPK主要在叶片下表皮表达,在干旱胁迫下,VfCPK1的表达量显著增加[25];水稻(Oryzasativa)OsCDPK7的表达受低温和盐胁迫诱导,它的过量表达能显著提高水稻的耐寒、耐盐和耐旱能力[26];崔喜艳等[27]的研究表明,羊草(Leymuschinensis)LcCDPK基因的表达受干旱及盐碱胁迫的诱导,推测LcCDPK参与羊草抵御逆境胁迫的响应。CDPK参与生物胁迫,蒺藜苜蓿(Medicagotruncatula)CDPK3的表达受苜蓿中华根瘤菌(Sinorhizobiummeliloti)诱导,表达量在接种1 h达到最大值[28]。本研究利用qRT-PCR检测青花菜BoCDPK1基因的表达情况,发现该基因的表达受霜霉菌和核盘菌的诱导,但在表达时间和表达量上存在着一定的差异,说明BoCDPK1在霜霉菌和核盘菌胁迫下具有不同的响应模式。
近年来,有关CDPK与病原菌互作相关的研究不多,与霜霉菌和核盘菌相关的研究未见报道。本研究在克隆BoCDPK1基因的基础上,初步明确了它的序列特征、系统发育关系及其在霜霉菌和核盘菌侵染下的表达模式,为后续开展基因功能鉴定和抗病分子育种奠定了基础。下一步将利用遗传转化技术,通过BoCDPK1的抑制或过量表达研究其在青花菜抗病反应中的生物学功能。

