小鼠巨噬细胞RAW264.7细胞电穿孔转染条件的建立和验证
罗维,艾磊,周越
(1. 南京体育学院运动健康学院,南京 210014; 2. 北京体育大学运动生理学教研室,北京 100084; 3. 江苏省体育科学研究所,南京 210033)
质粒转染对于分子生物学研究具有重要意义,目前最为常用的质粒转染方法主要包括电穿孔法、阳离子脂质体法和反转录病毒法[1-2]。阳离子脂质体法对细胞毒性较大,反转录病毒法又需要考虑多种安全因素[3],而电穿孔法作为物理转染方法,具有操作简单、可重复性好、转染效率高、适用谱广、作用机制清晰等优点,尤其是对于原代细胞等难以转染的细胞系具有较大的优势[4-5]。
RAW264.7细胞是小鼠来源的单核巨噬细胞株[6-8],近几年因在代谢性疾病相关研究中受到广泛关注而成为质粒转染的目标细胞[9]。RAW264.7细胞体积较小,且易极化而难以扩增和传代,增加了该细胞质粒转染的难度[10-11],目前未见稳定高效的RAW264.7细胞质粒转染方法。
Tribbles同源蛋白3(Tribbles Pseudokinase 3,TRIB3)是21世纪新发现的假激酶[12-13],是目前寻找癌症、心血管疾病、糖尿病等慢性代谢性疾病药物靶点的研究热点[14-15],因此,本研究以电穿孔法在RAW264.7细胞中转染TRIB3过表达质粒和TRIB3 siRNA并检测目的基因表达改变情况,以期望一方面建立稳定的RAW264.7细胞电穿孔转染条件,另一方面研究TRIB3过表达质粒和siRNA的转染条件,为后续进一步研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验材料
TRIB3基因过表达质粒(Myc-DDK-Tagged,MR204806)、TRIB3 siRNA(SR410947)以及相应的对照质粒(PS100001)和对照siRNA均购于美国OriGene公司。小鼠巨噬细胞RAW264.7购于自中国科学院细胞库。
1.1.2 主要仪器
电穿孔仪器为日本BEX公司的CUY21EDITII型电转染仪。电极杯购于日本BEX公司,型号为SE-202,电极间隙尺寸为2 mm。电穿孔缓冲液为不含血清的培养基OPTI-MEM,购于德国Gibco公司,货号为31985-062。
1.2 方法
1.2.1 质粒构建与纯化
本研究采用TRIB3基因过表达质粒(Myc-DDK-Tagged,MR204806)、TRIB3 siRNA(SR410947)以及相应的对照质粒(PS100001)和对照siRNA进行转染。TRIB3过表达质粒载体为pCMV6-Entry Vector,全长4929 bp,限制性内切酶Sgf I (GCGAT▼CGC) 和Mlu I (A▼CGCGT)双酶切目的基因与pCMV6-Entry Vector质粒载体后, 使用T4 DNA连接酶将酶切产物连接在一起,使得插入片段与载体定向匹配连接。质粒纯化采用阴离子交换树脂柱纯化方法,经PowerPrep® HP Midiprep质粒纯化试剂盒进行纯化(NP100024),试剂盒购于美国OriGene公司,严格按照试剂盒说明书进行规范操作。TRIB3 siRNA为27-mer siRNA,其中TRIB siRNA(a)序列为rGrCrArUrCrUrGrArCrUrCrArArGrGrArArUrArGrUr CrUGG;TRIB siRNA(b)序列为rGrGrArArGrAr ArArCrCrGrUrUrGrGrArGrUrUrUrGrArUGA.
1.2.2 RAW264.7细胞培养
小鼠巨噬细胞RAW264.7常规培养于含10%胎牛血清、100 U/mL青霉素以及100 μg/mL链霉素的DMEM培养基(Gibco,德国)中,于5% CO2、37℃细胞孵育箱中孵育,依细胞生长状态1 ~ 2 d传代一次。待细胞增殖传代到足够细胞量后统一冻存,选取同一代细胞作为实验对象。
1.2.3 电穿孔转染
RWA264.7细胞在电穿孔转染前24 h换不含青霉素和链霉素的培养基。转染前吸出培养皿中的含血清培养基,加入2 mL无血清培养基洗细胞2次,将细胞刮下,离心后用OPTI-MEM重悬细胞,调节细胞密度为1×106/24 μL OPTI-MEM,每次转染时吸出24 μL细胞悬液,与一定量TRIB3过表达质粒(2、4、6 μg)混合均匀,选择110、120、130和140 mV电压分别进行转染,单次脉冲时间分别为10、20和30 ms,重复次数为10次。
电穿孔转染后将细胞用不含青霉素和链霉素的培养基吹打混匀,接种于6孔板,倒置显微镜下观察后置于5% CO2、37℃细胞孵育箱中孵育,24 h后更换含青霉素和链霉素的培养基。每天在显微镜下观察细胞形态。
确定TRIB3过表达质粒最佳电转条件后,再以这一电转条件转染10、20、50、100 nmol/L TRIB3 siRNA,进行验证的同时筛选TRIB3siRNA的最佳转染浓度。
1.2.4 CCK8法检测细胞存活率
电穿孔转染24 h后收集细胞进行检测,收细胞时每孔加入10 μLCCK-8(美国APExBIO公司),混匀,于孵育箱中继续培养2 h后在酶标仪中检测各孔450 nm处的吸光度值(A450 nm)。根据下列公式计算细胞平均存活率:细胞存活率%=(A实验处理孔-A空白孔)/(A对照孔-A空白孔)×100,每个样本重复三次,检测不同转染条件对细胞存活率的影响。
1.2.5 TRIB3蛋白表达检测
蛋白提取: 电穿孔转染后72 h收集细胞,将细胞刮下吸入2 mL EP管,4℃离心留沉淀,每管加入150 μL裂解液,混匀,置冰上裂解25 min;10 μL裂解的蛋白液加入蛋白定性液,分光光度计检测蛋白浓度;剩余蛋白液加入等体积2 × loading bufer,100℃加热10 min,4℃ 离心取上清。
Western Blot 蛋白上样量为30 μg,经100 V电压电泳和60 V电压电转后取出NC膜,立春红预染剪下对应条带, TRIB3(美国abcam公司)以5%牛血清白蛋白封闭2 h,β-actin(北京中山金桥公司)以5%牛血清白蛋白封闭过夜。5%牛血清白蛋白配制一抗,TRIB3一抗浓度为1/2000、孵育过夜,β-actin一抗浓度为1/5000、孵育2 h。5%牛血清白蛋白配制二抗,TRIB3为兔源一抗,采用山羊抗兔二抗,浓度为1/500,β-actin为鼠源一抗,采用山羊抗鼠二抗,浓度为1/3000,均孵育2 h。X射线曝光胶片显影。
显影后的胶片扫描导入Image-Pro Plus 6.0进行灰度分析。
1.3 统计学分析
2 结果
2.1 不同脉冲电压对细胞形态、存活率和目的基因表达的影响
BEX电穿孔转染仪推荐的脉冲时长为10 ~ 30 ms,脉冲电压为100 ~ 150 mV,因此检测不同脉冲电压对RAW264.7细胞的转染效果时,质粒浓度设为每样本4 μg,脉冲时长设为20 ms,脉冲电压设为110、120、130和140 mV。转染后24 h更换培养基并观察细胞形态、检测细胞存活率,发现110、120 mV组细胞形态与对照组无差异,细胞呈圆形或梭形贴壁生长(图1红色箭头标示处)[16],而130、140 mV组细胞换液前悬浮细胞较多,换液后细胞密度明显减少且出现收缩变圆呈悬浮状(图1黄色箭头标示处)[17],48 h后基本无贴壁细胞。110、120 mV组细胞存活率与未进行转染的对照组无差异(P< 0.05),而130、140 mV组细胞存活率显著低于对照组(P< 0.01) (图2)。
为了检测目的基因表达变化情况,转染TRIB3过表达质粒72 h后进一步检测细胞中TRIB3蛋白的表达,发现与未进行质粒转染的对照组相比,110 mV组TRIB3表达无显著差异(P> 0.05),130、140 mV组TRIB3表达显著增加(P< 0.05),120 mV组TRIB3表达增加更为显著(P< 0.01) (图3)。
以上实验结果说明,110 mV脉冲电压虽能保证较高的细胞存活率,但目的基因表达变化并不显著;130、140 mV脉冲电压虽能显著改变目的基因表达水平,但细胞存活率较低;而120 mV脉冲电压既能保证较高的细胞存活率,又能显著促进目的基因表达,是较为理想的RAW264.7细胞电穿孔转染的电压条件。
2.2 脉冲电压恒定时不同脉冲时长对细胞形态、存活率和目的基因表达的影响
为了进一步探索不同脉冲时长对细胞形态、存活率和目的基因表达的影响,结合2.1中结果,将脉冲电压设为120 mV,质粒浓度仍为每样本4 μg,脉冲时长设为10、20和30 ms。转染后24 h更换培养基并观察细胞形态、检测细胞存活率,发现10、20 ms组细胞形态与对照组无差异,细胞呈圆形或梭形贴壁生长(图4红色箭头标示处),而30 ms组细胞换液前悬浮细胞较多,换液后细胞密度明显减少且出现收缩变圆(图4黄色箭头标示处)。10、20 ms组细胞存活率与未进行转染的对照组无差异(P> 0.05),而30 ms组细胞存活率显著低于对照组(P< 0.01) (图5)。
为了检测目的基因表达变化情况,转染TRIB3过表达质粒72 h后进一步检测细胞中TRIB3蛋白的表达,发现与未进行质粒转染的对照组相比,10 ms组TRIB3表达无显著差异(P> 0.05),20、30 ms组TRIB3表达显著增加(P< 0.01) (图6)。
以上实验结果说明,10 ms脉冲时长虽能保证较高的细胞存活率,但目的基因表达变化并不显著;30 ms脉冲时长虽能显著改变目的基因表达水平,但细胞存活率较低;而20 ms脉冲时长既能保证较高的细胞存活率,又能显著促进目的基因表达,是较为理想的RAW264.7细胞电穿孔转染的脉冲时长条件。
2.3 电压和电击时长恒定时不同质粒浓度对细胞形态、存活率和目的基因表达的影响
为进一步探索不同质粒浓度对细胞形态、存活率和目的基因表达的影响,结合2.1和2.2中结果,将脉冲电压设为120 mV,脉冲时长设为20 ms,质粒浓度设为每样本2、4和6 μg。转染后24 h更换培养基并观察细胞形态、检测细胞存活率,发现各组细胞形态均与对照组无差异,呈圆形或梭形贴壁生长(图7)。2、4 μg组细胞存活率与未进行转染的对照组无差异(P> 0.05),而6 μg组细胞存活率低于对照组(P< 0.05) (图8)。
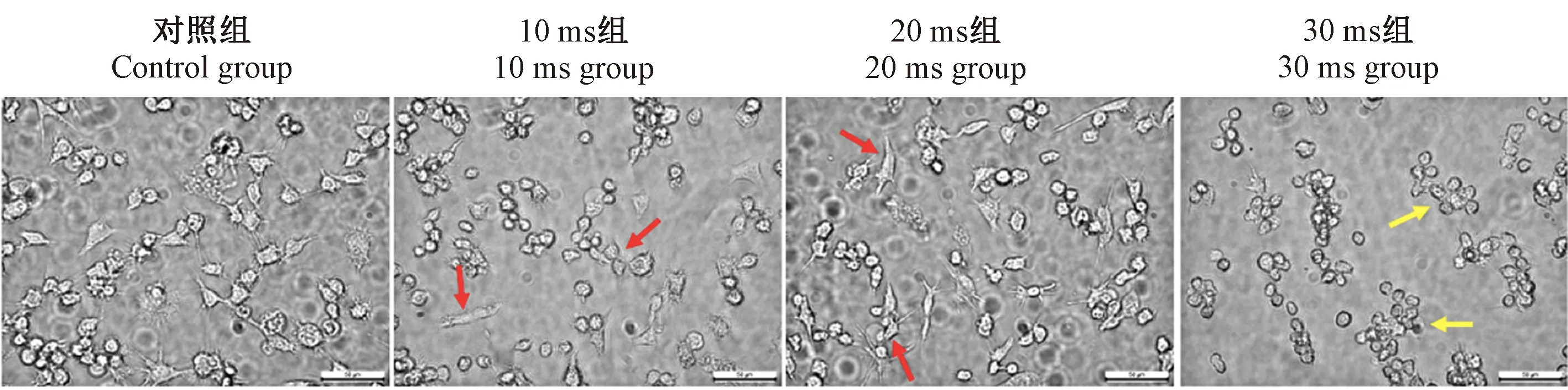
注:红色箭头标注为贴壁生长的RAW264.7细胞,黄色箭头标注为收缩变圆呈悬浮状的RAW264.7细胞。图4 不同脉冲时长电穿孔转染TRIB3过表达质粒对RAW264.7细胞形态的影响(Bar=50 μm,×400)Note. The red arrows points RAW264.7 cells growing close to the wall, and the yellow arrows marks RAW264.7 cells which shrink and become round and suspend.Figure 4 Changes of morphology in RAW264.7 treated with gradient pulsed time(Bar=50 μm,×400)
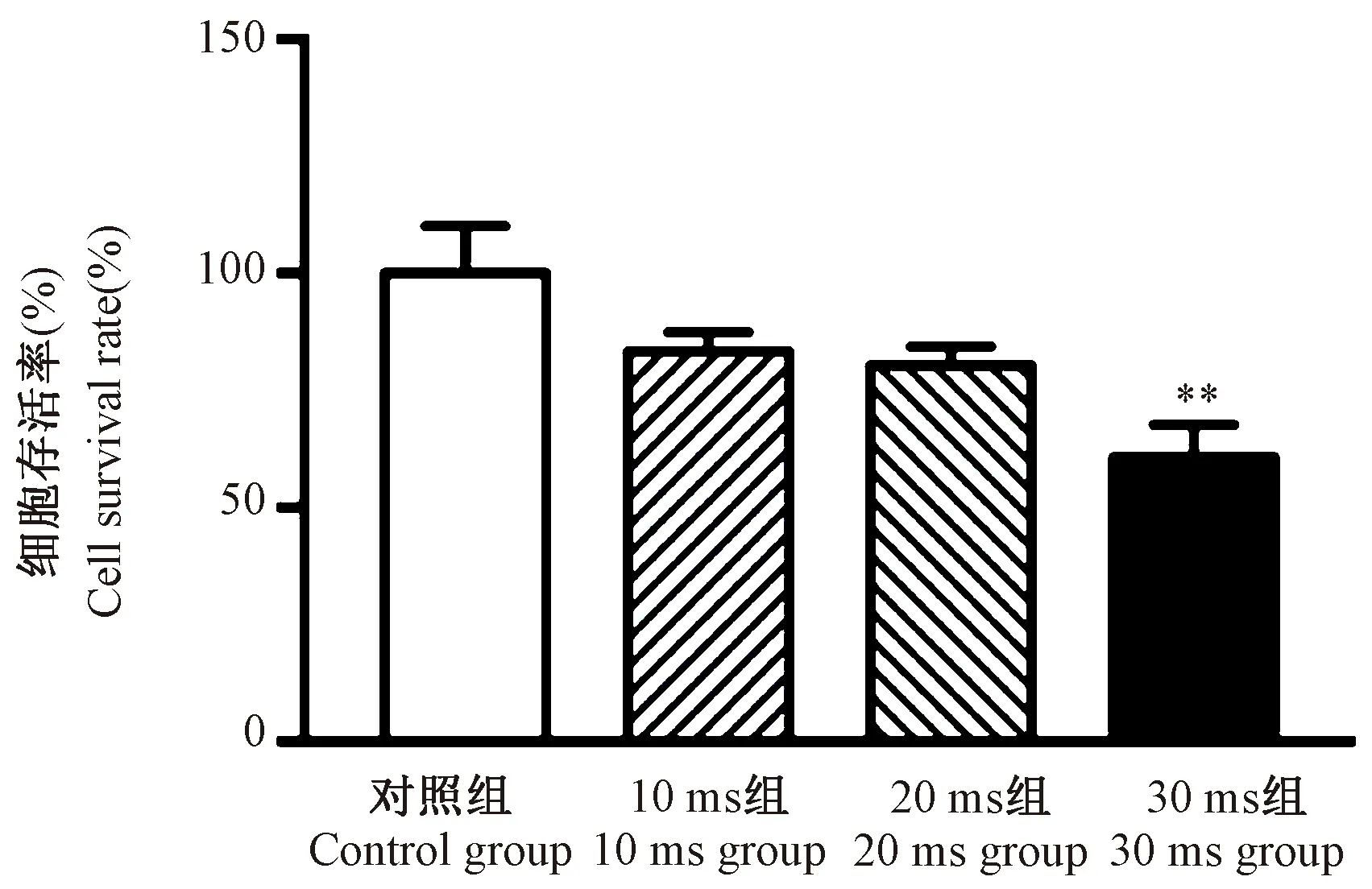
注:与对照组相比,**P <0.01。图5 不同脉冲时长电穿孔转染TRIB3过表达质粒对RAW264.7细胞存活率的影响Note.**P <0.01 vs Control group.Figure 5 Effect of pulse time on RAW264.7 cell survival rate
为了检测目的基因表达变化情况,转染TRIB3过表达质粒72 h后进一步检测细胞中TRIB3蛋白的表达,发现与未进行质粒转染的对照组相比,2、6 μg组TRIB3表达无显著差异(P> 0.05),4 μg组TRIB3表达显著增加(P< 0.01) (图9)。
以上实验结果说明,120 mV脉冲电压、20 ms脉冲时长是理想的巨噬细胞RAW264.7电穿孔转染条件,但该条件下质粒浓度也是影响转染效果的重要因素,本研究中的TRIB3过表达质粒在4 μg 样本浓度时能显著增加目的基因表达水平。
2.4 电压和电击时长恒定时不同TRIB3 siRNA浓度对细胞形态、存活率和目的基因表达的影响
为进一步验证以上研究中的电穿孔转染条件,本研究进一步以该条件转染不同浓度TRIB3 siRNA(TRIB3 siRNA(a)和TRIB3 siRNA (b)),根据质粒说明书,设置浓度为10、20、50和100 nmol/L。转染后24 h更换培养基并观察细胞形态、检测细胞存活率,与2.3中结果一致,各组细胞形态均与对照组无差异,呈圆形或梭形贴壁生长,且各组细胞存活率也与对照组无差异(P> 0.05)。
为了检测目的基因表达变化情况,转染TRIB3 siRNA 72 h后,进一步检测细胞中TRIB3蛋白的表达,发现TRIB3 siRNA组TRIB3表达均显著低于对照siRNA组(P< 0.05),但10、20 nmol/L TRIB3 siRNA(a)组和10 nmol/L TRIB3 siRNA(b)组的TRIB3表达显著低于其他浓度组(P< 0.01) (图10)。

注:与对照组相比,**P< 0.01。图6 不同脉冲时长电穿孔转染TRIB3过表达质粒对目的基因TRIB3蛋白表达的影响Note.**P< 0.01 vs Control group.Figure 6 Changes of TRIB3 protein expression in RAW264.7 treated with gradient pulsed time

图7 不同质粒浓度电穿孔转染TRIB3过表达质粒对RAW264.7细胞形态的影响(Bar=50 μm,×400)Figure 7 Changes of morphology in RAW264.7 treated with gradient plasmid concentration(Bar=50 μm,×400)

注:与对照组相比, *P <0.05。图8 不同质粒浓度电穿孔转染TRIB3过表达质粒对RAW264.7细胞存活率的影响Note.* P <0.05 vs Control group.Figure 8 Effect of plasmid concentration on RAW264.7 cell survival rate
以上实验结果再次证明120 mV脉冲电压、20 ms脉冲时长是巨噬细胞RAW264.7理想的电穿孔转染条件,同时需要根据不同质粒探索最佳质粒转染浓度以实现最好的转染效果,本研究中的TRIB3 siRNA在10 nmol/L转染浓度时能显著抑制TRIB3蛋白表达。
3 讨论
本研究以电穿孔法在RAW264.7细胞中转染TRIB3过表达质粒,通过设置不同的脉冲电压、脉冲时长和质粒浓度探讨电穿孔转染对RAW264.7细胞形态、细胞存活率和目的基因表达水平的影响,筛选最优电穿孔转染条件后再次以TRIB3 siRNA进行转染以进一步对该转染条件进行验证[18],期望一方面建立稳定的RAW264.7细胞电穿孔法转染条件,另一方面研究TRIB3过表达质粒和siRNA的细胞转染条件,为后续进一步研究奠定基础。
电穿孔转染中脉冲电压、脉冲时长和质粒浓度是影响细胞存活率和转染效果的主要因素[19-20]。电阻一定的前提下,脉冲电压大小决定了通过细胞及电转液的电流大小,对于转染效果和细胞存活率具有重要影响[21],因此本研究首先检测不同脉冲电压对RAW264.7细胞形态、细胞存活率和目的基因表达水平的影响,结果表明120 mV脉冲电压既能保证较高的细胞存活率,又能显著增加目的基因蛋白表达水平,是较为理想的RAW264.7细胞电穿孔转染的电压条件。

注:与对照组相比,**P< 0.01。图9 不同质粒浓度电穿孔转染TRIB3过表达质粒对目的基因TRIB3蛋白表达的影响Note.**P< 0.01 vs Control group.Figure 9 Changes of TRIB3 protein expression in RAW264.7 treated with gradient plasmid concentration

注:与对照组相比,*P< 0.05,**P< 0.01;与对应的10 nmol/L组相比,##P< 0.01。图10 以最佳电转条件转染不同浓度TRIB3 siRNA对TRIB3蛋白表达的影响Note. *P< 0.05,**P< 0.01 vs Control group; ##P< 0.01 vs 10 nmol/L group.Figure 10 Changes of TRIB3 protein expression in RAW264.7 treated with TRIB3 siRNA
确定脉冲电压条件后,本研究又进一步检测了电穿孔转染中脉冲时长和质粒浓度对RAW264.7细胞形态、细胞存活率和目的基因表达水平的影响[22],发现脉冲时长为20 ms,质粒浓度为每样本4 μg时,在保证较高的细胞存活率的同时,TRIB3蛋白表达水平约为对照组的1.8倍,显著促进目的基因蛋白表达。因此本研究认为脉冲电压120 mV、脉冲时长20 ms、质粒浓度每样本4 μg是比较理想的RAW264.7细胞中电穿孔转染TRIB3过表达质粒的转染条件。
为进一步验证这一脉冲电压和脉冲时长条件是否适用于在RAW264.7细胞中转染siRNA,本研究又以这一条件转染TRIB3 siRNA,浓度为10 nmol/L时,细胞获得较高存活率的情况下,TRIB3蛋白表达水平仅为对照组的0.19倍,显著下调目的基因蛋白表达,说明120 mV、20 ms的电穿孔条件同样适用于在RAW264.7细胞中转染TRIB3 siRNA。另外,实验中发现质粒或siRNA的转染浓度与目的蛋白表达间均未成线性关系,我们分析可能是由于质粒和siRNA浓度对转染效率的影响存在一定的阈值,过高或过低均有可能影响转染效果。本研究实验过程中还发现电穿孔转染操作中应密切关注电阻情况,一般在150 ~ 250 Ω之间较为合适,若电阻持续过低则应减少细胞悬液体积或更换电极杯,若电阻过大则应适当增加细胞悬液体积。
综上所述,本研究通过优化脉冲电压、脉冲时长和质粒浓度,以120 mV、20 ms条件在RAW264.7细胞中电穿孔转染TRIB3过表达质粒(每样本4 μg)和TRIB3 siRNA(10 nmol/L),在保证较高的细胞存活率的同时能显著改变目的基因的蛋白表达水平,为后续RAW264.7细胞中质粒转染相关的基础研究提供实验依据和借鉴。
——一道江苏高考题的奥秘解读和拓展

