高温热稳定性Au/β-Mo2C催化剂的制备及在逆水煤气变换反应中的应用
刘孟杰, 丁 巍,*, 戴咏川, 赵玉柱, 赵 越,3, 郝元川
(1.辽宁石油化工大学 化学化工与环境学部, 辽宁 抚顺 113001;2.中国石油天然气集团公司抚顺石化分公司石油三厂, 辽宁 抚顺 113004; 3.中国石油大庆油田有限责任公司, 黑龙江 大庆 163002)
近年来,化学燃料燃烧过程中排放大量的二氧化碳,引发了严重的全球气候变化,威胁着中国经济和社会的可持续发展[1-3]。如何将人类生活和工业产生的多余CO2回收,将其转化为化学制品或燃料[4-6],其中,一条重要的途径是可以将CO2转化成CO,再通过F-T合成进一步生成甲醇、低碳烯烃等一系列高附加值的化学品。这是绿色环保、资源综合利用、可持续发展的战略性途径。
RWGS反应可有效地实现CO2的转化,传统的铜/锌催化剂的稳定性较差[7]。Duke等[8,9]提出将Pt担载在TiO2载体上,通过增加载体的缺陷中心和增强Pt与载体间的相互作用来稳定Pt纳米粒子,使反应活性提升,但Pt系催化剂在反应中会有少量的CH4生成使CO的选择性降低。而用贵金属Pt/CeO2催化剂虽实现了在界面处发生CO2加氢反应,但大量的氧空穴导致催化剂失活严重[10]。最近,Zhu等[11]发现Au/CeO2催化剂在此反应中表现出优异的低温活性和CO的高选择性,但随着反应温度的升高,活性反而急剧下降。由于CeO2等氧化物载体与活性金属Au之间的作用力较弱,在高温反应下,不足以稳定Au纳米粒子,使其发生聚集和生长,从而使催化剂失活。
碳化钼作为一类过渡金属碳化物,具有类贵金属的特性。近几年,研究者将Mo2C作为载体合成一系列M/Mo2C(M=Cu、Ni、Pd、Pt、Ag和Au)负载型催化剂,广泛应用于小分子转化[12-14]、加氢反应[15-18]、电化学氧化还原[19]等催化反应中,表现出比其他贵金属催化剂更优异的催化活性、稳定性和耐久性。研究表明,由于Mo2C与金属之间具有强相互作用(SMSI)。这种特性使载体与金属之间存在协同效应,使活性金属分散更均匀,从而明显提高催化剂性能。其中,SMSI可以有效避免Au物种在高温下发生晶粒长大,使催化剂具有较好的高温热稳定性。可见,碳化钼是一类非常有应用前景的新型催化材料。
目前,碳化钼的制备方法有程序升温反应法[20]、化学气相沉积法[21]、液相燃烧法[22]、超声波合成法[23]、碳热还原法[24]和高温固相合成法[25]等。其中,程序升温碳化法是合成高比表面积碳化钼的有效方法。本实验采用有机碳源预先与钼盐均匀沉淀形成前体,然后碳化钼在程序升温过程中缓慢生成,即可制备出高纯度的β-Mo2C,再采用原位沉淀法合成Au/β-Mo2C催化剂用于逆水气变换反应,有望实现合成一类对CO2加氢反应具有高活性、高温热稳定性,且CO高选择性的Au催化剂,实现CO2的高效转化。
1 实验部分
1.1 实验仪器与试剂
乌洛托品C6H12N4(分析纯);七钼酸铵(NH4)6Mo7O24(分析纯);四氯金酸HAuCl4(分析纯);氨水(15%);去离子水。
分析电子天平(FA1104 上海良平仪器仪表有限公司);控温加热套(KDM 城华鲁电热仪器有限公司);恒温加热磁力搅拌器(DF-101D 巩义市予华仪器有限责任公司);电热鼓风干燥箱(101A-1 龙口市电炉总厂);箱式电阻炉(马弗炉)(SRJX-3-9 沈阳市电炉厂);pH计(PHSJ-3F 上海仪电科学仪器股份有限公司)。X-ray diffraction(XRD日本理学公司D-2500型);Scanning electron microscope(SEM JSM-7001F型热场发射扫描电子显微镜);BET比表面积测试法(BET测试法 ASAP2420型自动物理吸附仪);Scanning transmission electron microscope(STEM日立SU-8010扫描透射电子显微镜)。
1.2 催化剂的制备
1.2.1β-Mo2C的制备
称取一定量的七钼酸铵(AMT)和乌洛托品(HMT),按质量比为1∶8的药品混合后放入反应器中,再加入一定量的15%的氨水和去离子水,搅拌均匀至透明溶液,将反应器放入油浴中搅拌加热,搅拌速率为20 rad/s,反应温度为50 ℃,保持4 h,产物逐渐析出。然后升温到80 ℃,恒温加热3.0-4.0 h时直到蒸干,将产物取出烘干,即得到碳化钼前体。
将干燥后的前体放入管式炉中,采用程序升温法进行高温碳化,全过程需在Ar保护下进行,以15 ℃/min的升温速率,使样品从室温升至800 ℃,保持2 h。然后停止加热,自然冷却至室温后,在流量为300 mL/min的1% O2/Ar的气氛下,钝化处理2-4 h,即可得到高纯度的碳化钼β-Mo2C。
1.2.2 Au/β-Mo2C催化剂的制备
取不同体积的1% HAuCl4溶液,加入20 mL去离子水,再加入一定量的β-Mo2C,逐渐滴入0.25 mol/L氨水,调节溶液的pH值为9。保持在80 ℃,回流6-8 h,用去离子水多次清洗,抽滤后的样品在50 ℃下干燥过夜,合成不同负载量分别为0.1%、0.2%、0.5%、1.0%、2.0%和5.0%的Au/β-Mo2C催化剂。
1.3 RWGS反应的催化性能
实验选取200 mg Au/β-Mo2C催化剂(dp=20-40目),将其装入U型石英反应器(di=10 mm)中。反应前,催化剂在H2气氛下,以60 mL/min(STP)的流量,250 ℃下预处理1 h。然后通过六通阀切换成原料气(CO2/H2/N2=45∶45∶10,体积比)进行高温热反应实验。稳定性实验在特定的温度条件下进行,进料流量为60 mL/min。反应温度由位于催化剂床中心位置的K型热电偶烘箱控制。反应产物中的水蒸气经冰浴除去,其他气相产物通过气相色谱进行分析。以CO2的转化率和CO的选择性来评价系列催化剂的性能。其中,CO2的转化率和产率、CO的选择性的计算见公式(1)-(3),反应装置流程示意图见图1。
Conversion(CO2)=
(1)
Selectivity(CO)=
(2)
Productivity(CO)=conversion(CO2)×selectivity(CO)
(3)
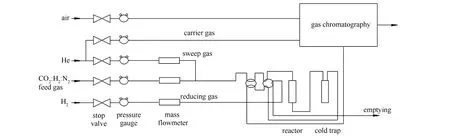
图1 CO2加氢反应流程示意图
2 结果与讨论
2.1 XRD表征
本实验采用程序升温碳化的方法制备了β-Mo2C,再用原位沉淀法负载活性金属Au,合成Au/Mo2C负载型催化剂。图2为碳化温度为800℃时β-Mo2C和不同Au负载量的Au/Mo2C催化剂的XRD谱图。
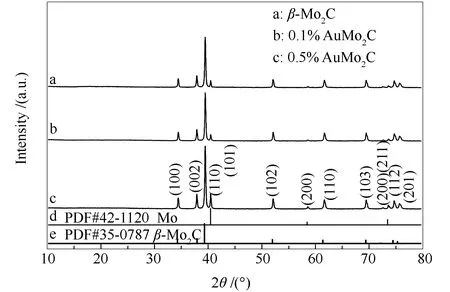
图2 Au/Mo2C与β-Mo2C的XRD谱图
图2中的a、b、c谱线分别为β-Mo2C、0.1%Au/Mo2C、0.5%Au/Mo2C的XRD谱图,图2中的谱线d为Mo原子标准谱图,图2中的谱线e为β-Mo2C标准谱图。2θ分别为34.44°、38.02°、39.44°、52.12°、61.53°、69.62°和74.65°时,图2中出现了β-Mo2C的(100)、(002)、(101)、(102)、(110)、(103)和(200)晶面的特征衍射峰。其中,0.5%的Au/Mo2C催化剂的β-Mo2C结晶度最好。这说明,由于Mo2C具有类贵金属的电子特性使其与Au纳米粒子之间发生了强电荷极化作用[26]。当Au的含量较低时,Au的负载不会改变β-Mo2C晶相,但相对较高负载量的Au会增加β-Mo2C的结晶度。图2中负载Au后的Au/Mo2C催化剂与纯相的β-Mo2C相比,没有出现Au的特征衍射峰。这是由于Au的负载量较低,分散性好,说明碳化钼对Au具有良好的锚定作用,抑制了金纳米粒子的生长。同时,图2中发现了Mo的特征衍射峰,将不同负载量的催化剂Au/Mo2C相比较,均有此特征峰,说明碳化温度达到800 ℃时,会有部分单质钼的生成。
实验又研究了Au负载量为0.1%的Au/Mo2C在不同温度、不同气氛下晶体结构的变化,并进行XRD的表征,结果见图3。
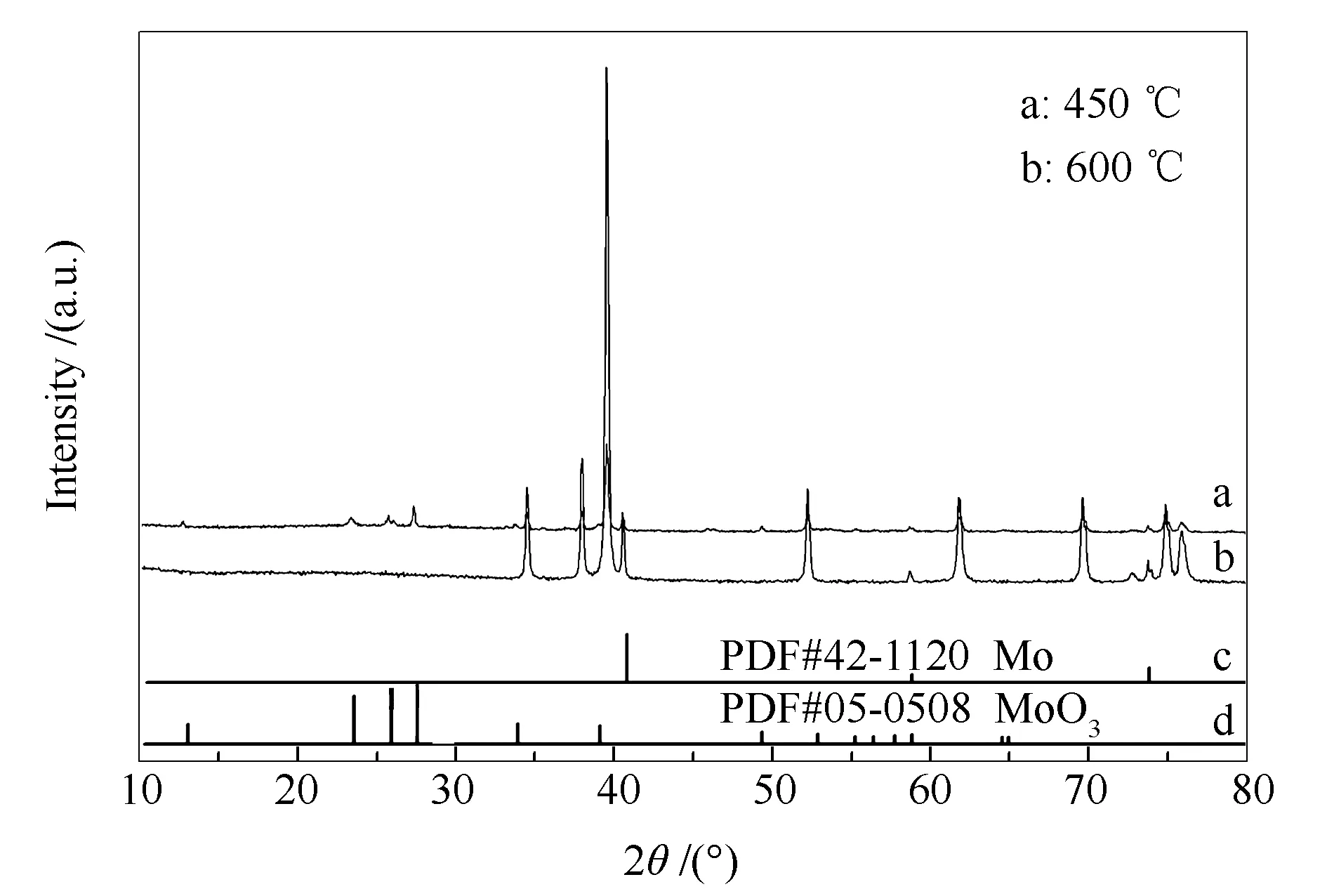
图3 不同碳化温度下0.1%Au/Mo2C催化剂的XRD谱图
图3中的谱线a为在空气中450 ℃时0.1%Au/Mo2C的XRD谱图,图3中的谱线b为在Ar气氛保护下600 ℃时0.1% Au/Mo2C的XRD谱图,图3中的谱线c是Mo原子的标准图谱,图3中的谱线d是MoO3的标准谱图。由图3可见,在12.82°、23.43°、25.65°、27.24°、34.56°和39.78°处出现MoO3的特征衍射峰,说明在450 ℃空气的气氛下,Au/Mo2C催化剂中部分Mo2C已被氧化生成MoO3;而在Ar气氛保护下,反应温度在600 ℃时,仍未发生Au纳米粒子长大的现象,催化剂仍以纯的β-Mo2C形态存在,因此,在Ar等惰性气氛中Au/Mo2C催化剂体现了良好的高温热稳定性。
2.2 STEM表征
实验对Au的负载量分别为0.5%、1.0%、2.0%和5.0%的Au/β-Mo2C催化剂进行了STEM的检测,更深度地了解催化剂活性金属的微观形貌和粒径分布,结果见图4。

图4 不同Au负载的Au/β-Mo2C催化剂的STEM照片 Figure 4 STEM images of used Au/β-Mo2C catalysts with different Au loadings(a): 0.5%;(b): 1.0%;(c): 2.0%;(d): 5.0%
由图4可知,金纳米粒子以明亮的圆形或椭圆形斑点的形式展现,被锚定在β-Mo2C的载体中。当Au/β-Mo2C催化剂中Au的负载量为0.5%、1.0%和2.0%时,Au纳米粒子以2 nm左右的原子簇形式存在,并且均匀分散。当Au的负载量增加为5.0%时,Au纳米粒子的直径增大,只有部分以原子簇形式存在。通过20张STEM照片计算分析,在四种不同负载量的Au/β-Mo2C催化剂中,Au纳米粒子的粒径在1-3 nm的比例分别为98%、95%、90%和65%,其粒径主要分布分别为1.42±0.61、1.83±0.64、2.18±0.65和2.79±0.88 nm。说明当Au负载量较低时,Au在β-Mo2C上的分散性较好,这一结果与XRD表征结果一致。随着Au负载量增加到5.0%时,锚定在β-Mo2C上的Au纳米粒子发生了晶粒长大的现象,此时,可能会有部分Au纳米粒子发生聚集[27],这种现象在Pt催化剂中也同样存在[28]。
2.3 BET表征
实验对新制备的载体Mo2C、在450 ℃空气中碳化的Mo2C以及Au负载量为2.0% 分别经550和600 ℃反应后的Au/Mo2C催化剂进行了BET分析,其N2吸附-脱附等温曲线见图5。
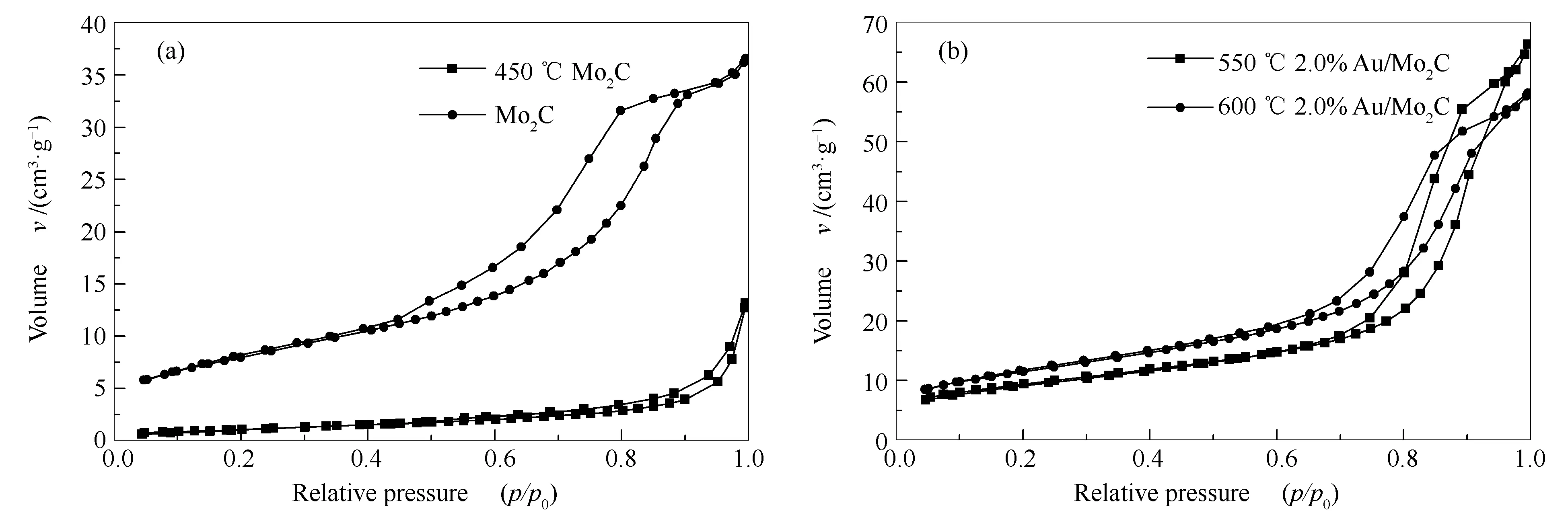
图5 不同温度下Mo2C和Au/Mo2C催化剂的N2吸附-脱附等温曲线
由图5可知,四种样品的N2吸附-脱附等温曲线均呈现Ⅳ型的滞后环。其中,图5(a)中新制备的载体Mo2C在相对压力p/p0<0.4时,曲线较为平缓,p/p0>0.4时曲线陡然上升,滞后环在p/p0=0.9处停止,其吸附量较大,说明材料中含有大量的介孔结构。而经空气中碳化后的Mo2C在p/p0=0.7时才出现滞后环,曲线上升不明显,吸附量也较低,说明孔容明显减小,这是由于材料中介孔结构坍塌,完全转化成较大的堆积孔结构造成的,可能大量碳化钼的晶型结构已经转化成了氧化钼。
而图5(b)中,负载量为2.0%的Au/Mo2C催化剂经550和600 ℃反应后的两种样品分别在相对压力p/p0为0.7和0.6时出现良好的滞后环结构,说明负载Au之后并没有改变载体Mo2C的介孔结构,而且Au纳米粒子均匀分散在载体的内外表面,使催化剂拥有大量的微孔结构,使其吸附量有明显的增加,并且在高温下,没有Au长大的现象,说明此催化剂具有较好的高温热稳定性。这种良好的孔结构保证了催化剂的高活性和较高的CO选择性。
2.4 RWGS反应催化性能评价
Au/Mo2C负载型催化剂可以有效地促进反应的进行,在逆水气变换反应中,催化剂的CO2转化率、CO的选择性以及高热稳定性是衡量催化剂催化性能的重要指标。
实验选取β-Mo2C以及负载量分别为0.2%和2.0%的Au/β-Mo2C催化剂在微型加氢反应器上进行RWGS反应评价三个催化剂。反应前,催化剂需在250 ℃,H2气氛下,预处理1 h,然后切换原料气,逐渐升温至500 ℃进行加氢评价,每25 ℃取一个样进行气相色谱分析。按公式(1)和公式(2)计算CO2转化率和CO的选择性,CO2转化率和CO选择性随温度的变化见图6。
由图6可知,随着反应温度的逐渐升高,其CO2的转化率均呈直线上升的趋势;而CO的选择性均随温度的升高而有所下降。其中,CO的选择性中各曲线趋势各有特点,可以看出,β-Mo2C催化剂在温度高于350 ℃时,曲线下降较快,而负载型Au/Mo2C在400 ℃以后才发生下降,0.2%Au/Mo2C催化剂下降的不明显,反应温度为500 ℃时,CO的选择性仍保持在98%左右。表明,此类催化剂具有高效性,在低负载量时,催化性能最好,具有较高活性和高温热稳定性。这归功于低负载量的催化剂中Au分散度更好,β-Mo2C对Au纳米粒子的锚定作用更强,使其在反应中更有效地抑制Au纳米粒子的长大,提供更多的有效活性中心,使催化剂具有更优异的CO2转化率和CO选择性。而Au负载量为2.0%时,虽然看似负载的活性金属更多,应具有更多的活性中心,但实际的反应结果表明,反应温度升高到400 ℃后,高负载量的催化剂的反应活性下降较严重,这是由于部分Au纳米粒子摆脱了β-Mo2C对它的半包覆作用,发生了晶粒长大的现象,使催化效果有所下降。
这一结果从不同负载量0.2%和2.0%的Au/Mo2C催化剂反应前后的孔性质分析结果可以得到证实。通过BET方法表征得到的结果见表1。
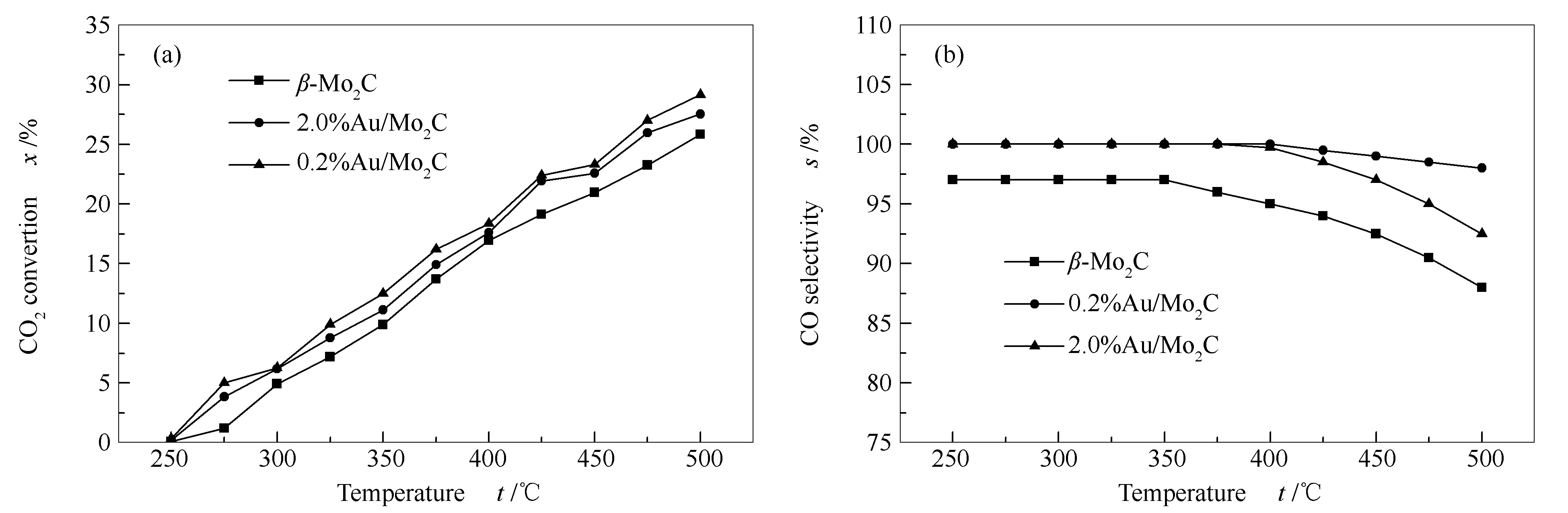
图6 CO2转化率及CO选择性随温度的变化
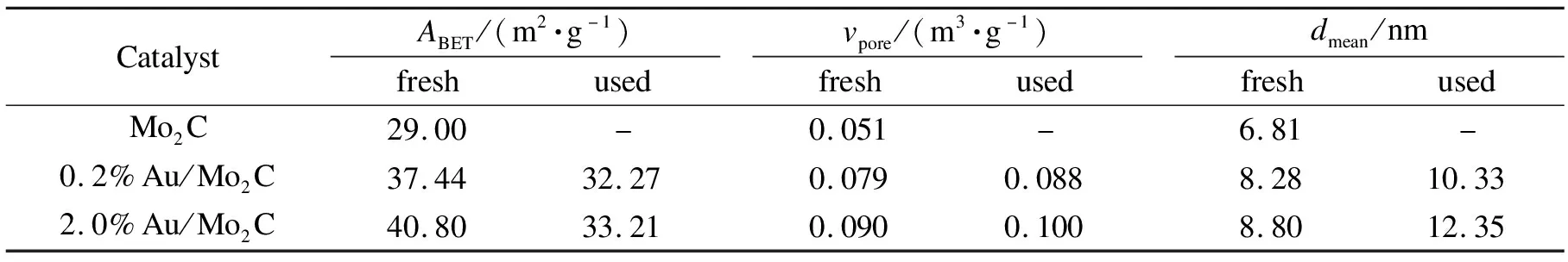
表1 不同负载量催化剂Au/Mo2C反应前后的孔性质
由表1可知,Au负载量≤2.0%时,负载后Au/Mo2C催化剂的比表面积、孔容和平均孔径均比Mo2C载体的有所增大,这是由于大量的Au以纳米簇的形式均匀地分散并包覆在Mo2C的表面上,在β-Mo2C的作用下没有发生聚集,并且形成大量二次介孔孔道。负载量为2.0%的Au/Mo2C催化剂其比表面积为40.80 m2/g,比负载量为0.2%的高,说明,此催化剂在Mo2C的表面分散了更多的Au纳米粒子。而它的孔容和平均孔径均分别为0.090 m3/g和8.80 nm比0.2%的催化剂大,说明形成的Au纳米粒子较大,因此,所形成的二次介孔更大一些。
另外,反应后催化剂的比表面积比反应前有所下降,其中,负载量为2.0%的催化剂比表面积下降的更多一些,说明催化剂中部分Au纳米粒子在高温反应后有一定程度地长大。这使得催化剂的平均孔径也有所增加,造成催化效果有所下降。而负载量为0.2%的催化剂的比表面积稍下降5.17 m2/g,孔容为0.088 m3/g,平均孔径为10.33 nm,对催化性能的影响不大。这一结论与评价结果相一致,说明此类催化剂经过高温反应后,仍具有良好的孔结构。图7为反应后0.2%Au/Mo2C催化剂的STEM照片及Mo和Au元素的扫描图。

图7 反应后0.2%Au/Mo2C催化剂的STEM照片及Mo和Au元素的扫描图
由图7可以看出,在选定的区域内,Au纳米粒子仍分散较好,未出现聚集现象,因此,较低Au负载量的催化剂对CO2加氢反应具有非常高的活性和良好的高温热稳定性。从催化剂成本来看,选择负载量为0.2%的Au/Mo2C催化剂作为稳定性实验的最佳催化剂。
实验平行制备三个0.2%Au/Mo2C催化剂,编号分别为样品1、样品2和样品3,在上面的反应条件下,反应温度为500 ℃,反应时间为7 h,考察催化剂的稳定性,结果见图8。
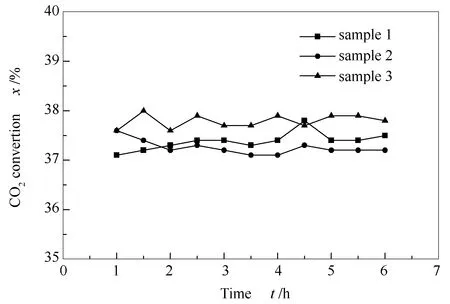
图8 CO2转化率随时间的变化
由图8可知,随着反应时间的延长,CO2转化率有轻微的上下浮动,但都维持在37.0%-38.0%,因此,证明了在达到平衡转化率的情况下,此催化剂具有良好的高温热稳定性。
3 结 论
XRD分析表明,通过程序升温碳化法可合成出纯相的β-Mo2C载体,同时,在碳化温度达800 ℃时,会有部分单质钼的生成,可提高反应的催化活性。当Au的负载量相对较低时,Au物种的分散性好,说明碳化钼对Au具有良好的锚定作用,抑制了金纳米粒子的生长;当Au的负载量相对较高时,Au可增加β-Mo2C的结晶度。
STEM表征再次证明,当Au负载量相对较低时,由于Au与β-Mo2C载体之间有较强的SMSI效应,β-Mo2C对Au有很好的锚定作用,抑制了其晶体的生长,使金纳米粒子以2 nm左右的原子簇形式被半包裹并均匀地分散在载体的表面上。经高温反应后仍保持良好的分散度和孔结构,因此,在RWGS反应中,表现出良好的CO2的加氢活性、CO的选择性和高温热稳定性。
由于低负载量Au/β-Mo2C催化剂的高活性和高温热稳定性主要来源于β-Mo2C对Au的锚定作用和本身的高活性,因此,提出碳化钼等过渡金属碳化物作为类贵金属化合物,有望成为一类非常有应用前景的新型催化材料。

