乳熟中期水稻茎中水溶性膳食纤维提取工艺研究
曲鹏宇 ,李志江 ,李丹 ,周义 ,张东杰
(1.黑龙江八一农垦大学食品学院,大庆 163319;2.黑龙江省农产品加工与质量安全重点实验室)
鲜食水稻是指在乳熟期至蜡熟初期收获的水稻。乳熟是农作物成熟过程的一个阶段,谷物经灌浆,营养物质逐渐积累,乳熟期的谷粒逐渐变硬谷壳呈绿色。蜡熟期,水稻籽粒内部成熟到一定程度,籽粒基本变硬,谷壳逐渐发黄但仍有浅绿色。在整个变化过程中水稻的不同部分是营养成分发生了巨大的变化[1-2]。黑龙江省作为我国主要的水稻生产基地,种植面积及产量均很丰富[3],将水稻和一些副产物进行开发利用,这也为黑龙江省水稻精深加工提供有力依据。
膳食纤维(Dietary Fiber)作为人类第七种营养素,受到了广泛的关注,可有效地提升膳食质量,对当前饮食结构改善有较好的促进作用。膳食纤维按照其水溶性特点不同,可以分为水溶性膳食纤维(Soluble dietary fiber,SDF)和水不溶性膳食纤维(Insoluble dietary fiber,IDF)两大类[4-5]。每个类别的成分都有不同的生理功效。不溶部分与水吸收和肠调节有关,而可溶部分与血液中胆固醇有关[6-7]。国内外对于可溶性膳食纤维研究较为广泛,但是对于鲜食水稻还未涉及,若能将鲜食水稻的加工副产物进行合理利用,将对以后稻米产品新品种开发和水稻增值利用提供理论和数据支撑。目前提取可溶性膳食纤维方法很多,化学法、酶法、二者结合法等[8-10],实验通过微波-酶结合方法进行鲜食水稻可溶性膳食纤维提取制备,并通过响应面优化提取制备工艺[11],为鲜食水稻水溶性膳食纤维的性质测定和产品的开发提供有利的参考价值和实验依据,拓展水稻深加工和营养利用前景。
1 材料与方法
1.1 试验试剂与材料
鲜食水稻的茎,黑龙江省鹤岗市萝北明山农场提供的龙粳31号。
盐酸、氢氧化钠、石油醚,95%乙醇(分析纯),辽宁泉瑞试剂有限公司;热高温α-淀粉酶液10 000 U·mL-1、蛋白酶液300~400 U·mL-1、淀粉葡萄糖苷酶溶液2 000~3 300 U·mL-1,上海源叶生物科技有限公司。蒸馏水,实验室超纯水系统自制。
1.2 试验仪器
GDE-CSF型意大利VELP膳食纤维测定仪,北京盈盛恒泰科技有限公司;TGL16B型台式离心机,上海安亭科学仪器厂制造;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;精密增力电动搅拌器,金坛市科兴仪器厂;高速多功能搅碎机,永康市速锋工贸有限公司;电子天平,奥豪斯仪器有限公司;超纯水系统,苏州江东精密仪器有限公司;数显恒温水浴锅,金坛市科兴仪器厂;DGG-9023A型电热鼓风干燥箱,上海森信实验仪器有限公司;电磁炉,广州美的生活电器制造有限公司;P70D20TP-C6微波炉,佛山市顺德区格兰仕微波炉电器有限公司;实验室pH计FE20,梅特勒-托利多仪器有限公司等。
1.3 试验方法
1.3.1 水稻茎水溶性膳食纤维提取工艺
试验流程
乳熟中期水稻茎→脱脂→粉碎→浸泡→加酶水解→灭酶→微波处理→沉淀、抽滤→浓缩→醇沉→离心→沉淀烘干。
1.3.2 操作要点
称取1.0 g的乳熟中期水稻茎样品,按照1∶30的料液比加入30 mL的蒸馏水,用玻璃棒搅拌至均匀调节其pH=6.0,加入0.2%的耐高温α-淀粉酶,置于GDE中在97℃下进行水浴培养,时间为20 min,将水浴好的样品进行静置放凉,之后调节pH=7.0加入0.2%(50 mg溶于1 mL蒸馏水中)的中性蛋白酶,在60℃下进行水浴,时间为30 min,放凉调节pH=4.5加入0.2%淀粉葡萄糖苷酶,同样在60℃水浴30 min。将酶解好的样品进行灭酶处理,将反应物转移至过滤装置中,滤液经浓缩后用4倍体积的95%进行醇沉24 h,离心,干燥得到水溶性膳食纤维。
1.3.3 微波处理
将脱脂粉碎好的水稻茎取1.0 g,按照1∶30的料液比加入30 mL的蒸馏水放入微波中进行微波处理,步骤同1.3.2。
1.4 单因素试验设计
参照近几年学者文献选择不同物料比、耐高温α-淀粉酶用量、耐高温α-淀粉酶酶解时间、微波功率为因素,测定各因素对提取茎水溶性膳食纤维的影响。试验涉及热高温α-淀粉酶、蛋白酶和淀粉葡萄糖苷酶,高温α-淀粉酶在文献中多次被选择,并且在前期预试验中发现蛋白酶和淀粉葡萄糖苷酶添加量没有显著性变化,蛋白酶和淀粉葡萄糖苷酶选择的添加量为0.2%。

1.4.1 物料比对提取SDF的影响
根据1.3.2的操作步骤,称取1.0 g的乳熟中期水稻茎,设置微波在450 W,淀粉酶酶解时间为20 min,淀粉酶添加量为0.2%等条件一定的情况下选择料液比分别为 1∶15、1∶20、1∶25、1∶30、1∶35 g·mL-1。
1.4.2 酶添加量对提取膳食纤维的影响
同1.4.1一致在其他条件一定下,耐高温α-淀粉酶添加量分别为0.1%、0.2%、0.3%、0.4%、0.5%。
1.4.3 酶解时间对提取SDF的影响
同1.4.1一致在其他条件一定下,耐高温α-淀粉酶的酶解时间分别为 10、20、30、40、50 min。
1.4.4 微波功率对提取膳食纤维的影响
同1.4.1一致在其他条件一定下,称取1.0 g的水稻茎样品,按照1∶30的料液比加入30 mL的蒸馏水,放入微波中在进行微波处理20 min。微波功率分别为 350、400、450、500、550 W 进行试验。
1.5 响应面试验
以单因素试验结果为依据,选取α-淀粉酶添加量(A),酶解时间(B),微波功率(C)为因素对乳熟中期水稻茎水溶性膳食纤维进行提取工艺优化的研究。根据Box-Behnken试验设计原理,采用三因素三水平的响应面分析,每组试验重复3次,通过显著性检验和回归分析得到最佳提取工艺参数,试验因素水平设计表如表1。

表1 响应面实验设计Table 1 Response surface experiment design
2 结果与分析
2.1 单因素试验结果
2.1.1 不同料液比对水溶性膳食纤维提取率的影响
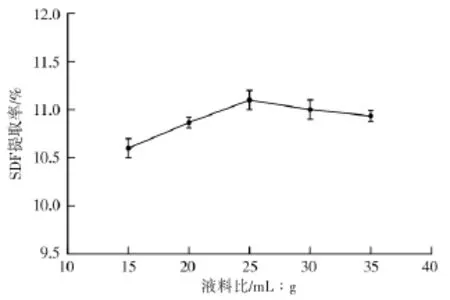
图1 物料比对SDF提取率的影响Fig.1 Effect of material ratio on SDF extraction rate
图1 为当其他条件一定时,随着料液比的增加,水稻茎的SDF提取率曲线是先增加后平缓下降的,在料液比为1∶25时水稻的 SDF得率平均率为11.1%,之后的曲线较为平缓,原因可能是随着料液比的增加物料与水的接触面积增加[12],水稻的SDF可以与溶剂充分结合使得溶解效果变好,得到的SDF提取率最大,但是当料液比过大时SDF的提取率却下降了,原因可能过大量的溶剂使水溶性纤维素遭到破坏因此选择1∶25为宜。
2.1.2 不同α-淀粉酶用量对水溶性膳食纤维提取率的影响
图2为随着α-淀粉酶用量的增加,SDF的提取率呈先上升后呈平缓下降的趋势,当α-淀粉酶用量为0.3%时,SDF得率最大值为11.0%,是因为酶用量不足时淀粉水解不完全,用量过高时膳食纤维中容易水解出半纤维素等活性物质[13],造成SDF提取率的下降。

图2 α-淀粉酶添加量对SDF提取率的影响Fig.2 Effect of α-amylase addition on SDF extraction
2.1.3 α-淀粉酶酶解时间对提取膳食纤维的影响
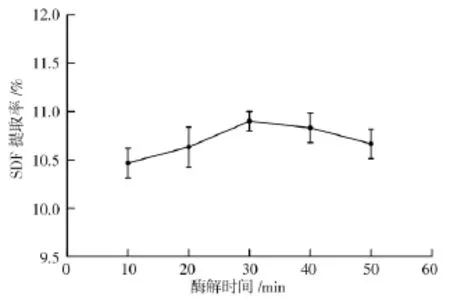
图3 酶解时间对SDF提取率影响Fig.3 Effect of enzymolysis time on SDF extraction rate
图3 试验结果可知,随着酶解时间的延长,膳食纤维的提取率先增加后下降,当酶解时间为30 min时,SDF的提取率达到最大值为10.9%,当酶解时间超过30 min后,得率逐渐下降。前期因为酶解时间不足造成反应不充分,部分的膳食纤维没有提取出来,而后期时间过长严重破坏膳食纤维细胞,可能使得其他活性物质也出来,因此酶解时间以30 min为宜。
2.1.4微波功率对提取膳食纤维的影响
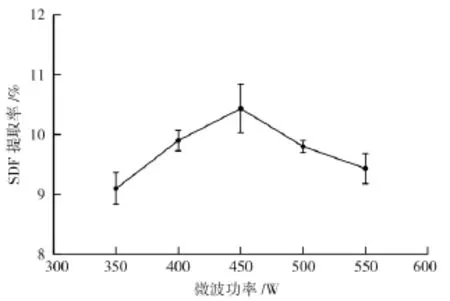
图4 微波功率对SDF提取率的影响Fig.4 Effect of microwave power on SDF
根据试验结果可知,随着微波功率的增加,水稻中SDF的提取率先增加后下降,当微波功率为450 W时,SDF的得率达到最大值为10.4%,微波的原理即为可以通过热效应来加快水稻茎中纤维素的降解,也可以将一些不溶性的膳食纤维进行转化,使得提取率大大增加提取率。当微波功率超过450 W后,提取率逐渐下降。可能是因为微波功率高温度升高破坏和水稻茎中SDF结构[14-15],使得其中一部分SDF分解为小分子物质[16],提取率降低。因此选择450 W最为适宜。
2.2 响应面试验结果与分析
2.2.1 响应面实验结果及回归方程方差分析
在单因素实验的基础上,以α-淀粉酶添加量(A),酶解时间(B),微波功率(C)为变量,提取率为因变量,利用Design Expert 8.0.6软件对表2中的数据进行分析,得到方差分析表如表3所示。
对表2的数据进行拟合,得到二次回归方程为:
Y=+11.74-0.087*A+0.15*B+0.39*C+0.000*A*B+0.18*A*C-0.10*B*C-0.26*A2-0.23*B2-0.56*C2
由表3可知,回归模型极显著(P=0.000 1<0.01),其相关系数系数R2=0.996 0,校正判定系数R2Adj=0.990 8,说明模型拟合程度好。失拟项不显著(P=0.839 5>0.05),说明试验误差较小,认为拟合方程比较好,其次从表可以看出模型A、B、C、AC和所有二次项都是极显著的BC项为显著,AB项为不显著。根据因素水平可以得到影响水稻SDF提取因素主次顺序即:A>B>C。
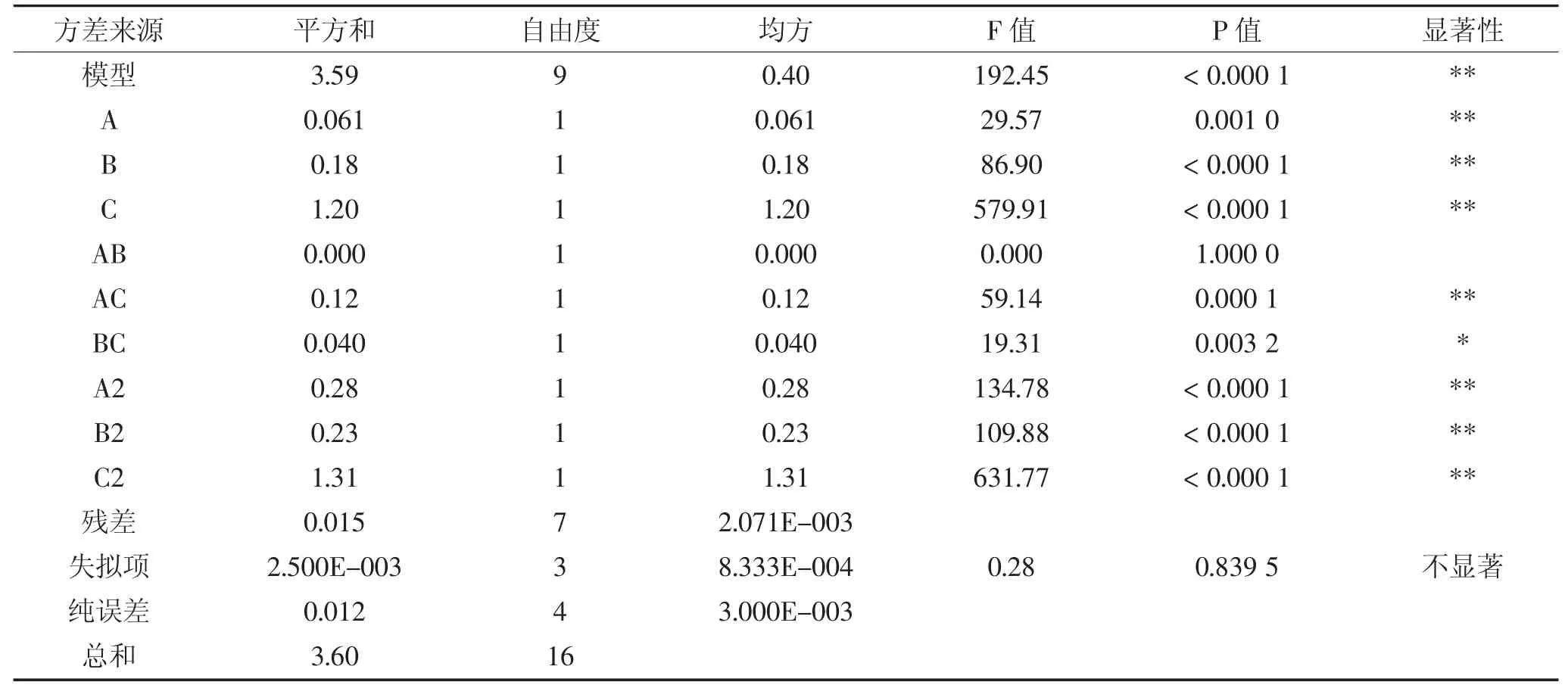
表3 回归方程方差分析表Table 3 Regression equation variance analysis table
2.2.2 响应面图
由图5可知,液料比(A)和微波功率(C)与之间的交互作用十分明显,其相应曲面陡峭,且等高线接近椭圆形。随着微波功率增加和液料比的增加,水稻茎中SDF溶出和扩散量也逐渐增加,在接近中心点时达到峰值。
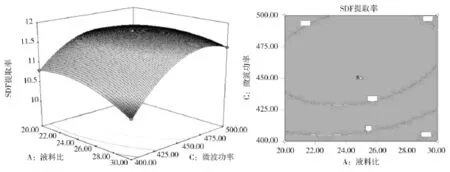
图5 AC因素对SDF提取率响应面图Fig 5 AC factor response to SDF extraction rate
由图6可知,微波功率(C)和酶解时间(B)响应曲面为陡峭,等高线呈椭圆形密集排列,表明其交互作用十分显著。即适当增大微波功率与酶解温度,有利于水稻SDF的充分溶出,加速提取进程,但微波功率及酶解时间过高,则会导致SDF结构破坏,得率逐渐下降。
2.2.3 验证试验
通过DesignExpert优化响应面分析,水稻茎中SDF提取最佳工艺参数是:物料比为1∶30,淀粉酶酶解时间为32 min,微波功率474 W。水稻茎SDF得率理论值为11.55%。为保证实验的可行性,将具体的工艺参数调整为微波功率470 W,酶解时间32 min物料比1∶30,并进行三次重复试验,最终得到的鲜食水稻茎SDF得率约为11.26%,与理论值较为接近一致。因此,此响应面模型对水稻茎中SDF提取得率准确可靠,具有参考价值。

图6 BC两因素对SDF提取率响应面图Fig.6 BC factor response to SDF extraction rate
3 讨论
实验采用微波辅助酶法提取水稻茎中的水溶性膳食纤维,在文献中可以了解到提取水溶性膳食纤维多数采用化学法或者酶法,化学法提取率很低。用碱法以及酸法所提取制得的膳食纤维色泽较差纯度不高,让膳食纤维活性遭到破坏,还会因为大量污水而对环境造成严重污染[17]。酶法能够明显降低膳食纤维的损失和对环境破坏,也能明显提高产品的提取率和产品质量,但是提取过程所花费的费用和时间较高[18-19]。通过实验也可以发现物理与酶结合的方法对提取率的影响很大。陈磊等[20]采用酶法从豆渣中提取SDF,最佳的工艺参数为粉碎目数60、料水比为1∶15、加入0.7%纤维素酶、提取时间为90 min、提取温度为50℃,pH=5,得到的提取率为8.05%。宋荣珍等[21]从生姜中提取SDF及IDF,采用的方法为物理与酶结合的方法SDF提取率高达28%,可以知道生姜中水溶性膳食纤维要比水稻茎中高很多。
4 结论
在单因素结果中,随着物料比的增加水稻SDF的提取率曲线先增加后平缓下降,在料液比为1∶25时水稻茎的SDF提取率最大为11.1%。当α-淀粉酶用量为0.3%时,SDF的提取率最大为11.0%。当酶解时间为30 min时,SDF的提取率最大为10.9%。当功率为450 W时,SDF的提取率最大为10.4%。通过响应面优化分析得到最佳的提取工艺参数,参数为:物料比为 1∶30,酶解时间 32 min,微波功率 470 W,最终得到的鲜食水稻SDF得率约为11.26%,与理论值11.55%相接近。从单因素和响应面分析选择的因素用量过高或者过低都会影响提取率的变化,过低水稻茎中的SDF溶出不完全,过高可能破坏水稻茎中的膳食纤维结构,使得其中物质分解成小分子物质,无法醇沉得到。
试验采用微波辅助酶法提取乳熟中期水稻水溶性膳食纤维,与之前单纯的化学法或者酶法相比此方法简单准确提取率较高并且无污染,方法可以在以后的提取试验中所采纳。试验团队以鲜食水稻为样品对水稻在不同成熟时期进行各种成分提取与检测,试验提取水稻中水溶性膳食纤维,也是为以后的检测及分析不同时期水溶性膳食纤维奠定了坚实基础。水稻中水溶性膳食纤维到底有何功能性价值将在以后的试验中逐一探讨。工艺为以后黑龙江省水稻副产物的开发利用及新型水稻水溶性膳食纤维的产品开发提供有利的参考价值和实验依据。

