β淀粉样蛋白在胞内的生成和代谢
石镜明,段红玉,张洁,孙正启
(1.西藏民族大学基础医学院形态学教研室,陕西 咸阳 712082;2.陕西中医药大学附属医院内分泌二科,陕西 咸阳 712000)
阿尔茨海默病(Alzheimer′s disease,AD)是老年性痴呆症中最常见的形式,全世界约有4 000万AD患者,约占老年痴呆的80%,预计到2050年,这个数量将翻三番[1-2]。β淀粉样蛋白(amyloid-β peptide,Aβ)可溶性寡聚体是导致AD发病的重要风险因素之一[3],而Aβ由β-分泌酶(β-secretase)、β位点淀粉样前体蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme-1,BACE1)和γ-分泌酶(γ-secretase)切割其前体蛋白形成[4]。其中,淀粉样前体蛋白(amyloid precursor protein,APP)是Ⅰ型膜蛋白,其N端位于细胞外,C端位于细胞内[5]。APP的水解可以分为两种途径:①抗Aβ生成途径,阻止Aβ产生,主要是α-分泌酶(α-secretase)解整合素金属蛋白酶(a-disintegrin and metalloproteinase,ADAM)和γ-secretase的水解作用;②Aβ生成途径,37-43肽的Aβ通过其前体蛋白水解处理产生,主要依赖于BACE1和γ-secretase 的水解作用[6]。尽管Aβ相关的研究已经进行了多年,但对于其胞内代谢的途径还存在一些争议,包括Aβ的产生部位究竟是内质网(endoplasmic reticulum,ER)还是高尔基体,以及Aβ产生后从膜上脱离还是进入细胞的内涵体或是继续循环等问题。现就Aβ在胞内的生成过程及代谢途径予以综述,为Aβ在AD的毒性机制研究提供一定的参考。
1 Aβ生成的亚细胞部位
在抗Aβ生成途径中,ADAM对APP进行水解,得到一个删节的APPα-C端片段(C-terminal fragment,CTF)(或C83)以及sAPPα(APP被α-secretase水解后产生的N端片段),随后这个α-CTF片段被γ-secretase在膜内酶切产生一个删节的Aβ肽被称为P3肽(Aβ17-42)[7],见图1(A)。在Aβ生成途径中,BACE1的激活将引起APP膜外片段sAPPβ(APP被β-secretase水解后产生的N端片段)的脱落,并产生APP C端片段β-CTF(或C99),β-CTF的裂解发生在生物膜的疏水环境中[8],经过γ-secretase裂解后,在细胞外液和脑积液中均可以发现Aβ[9],见图1(B)。然而,这些水解发生的亚细胞部位仍不完全清楚,APP的分泌途径也存在一定的争议。有研究认为,β-CTF及α-CTF被γ-secretase水解的部位在ER及反面高尔基体上[10];另有研究却认为,ER及反面高尔基体上并没有活性的γ-secretase[11]。
ADAM10水解APP产生的片段脱落主要发生在细胞表面并不生成完整的Aβ,因此文中对不完整的Aβ不加叙述。而BACE1是Ⅰ型膜蛋白,该蛋白自产生后作为一个不能发挥功能的酶原形式存在,在其成熟过程中,BACE1需要经历大量的翻译后共修饰,包括N-糖基化、二硫键的形成和棕榈化[12]。未成熟的BACE1前肽会在成熟的过程中被弗林蛋白酶及相关蛋白酶去除[13]。BACE1会富集在细胞膜的脂筏结构(lipid raft)中[14],见图2。由于BACE1与APP都富集到同一部位,很可能导致APP的水解。综上所述,ADAM10主要的活性部位位于质膜中。BACE1主要的活性部位是早期内涵体。γ-secretase活性部位主要是循环的内涵体、溶酶体和质膜。
1.1BACE1在内涵体内产生活性 BACE1作为一种天冬氨酸酶,它的活性具有酸性pH最佳值(约为4.5)[15],这与BACE1在内涵体中产生活性的结论相似。通过抑制溶酶体和内涵体中蛋白的降解,发现β-CTFs也聚集在内涵体和溶酶体中[16]。人们设计出更高效的BACE1抑制剂,可以在内涵体中抑制APP被BACE1水解,导致BACE1聚集在内涵体内;膜结合的BACE1抑制剂比非膜结合的BACE1抑制剂更有效;BACE1是目前公认的β-secretase的专门术语[17]。BACE1是膜结合的天冬氨酸蛋白酶,其活性位点位于腔/胞外空间,与胃蛋白酶家族具有结构相似性,除BACE1外,另一个同源的蛋白酶BACE2也被鉴定出来,但它的作用类似于ADAM,是一种非淀粉质酶[17-18]。BACE1是一种完全单一的β-secretase,因为剔除BACE1可以完全阻止Aβ的产生[19]。BACE1广泛表达,其中,在脑和胰腺内的表达量最大,其生理相关性目前还不清楚。APP在大脑中表达量很高,同时伴随着高水平的BACE1,使大脑成为高Aβ生成的主要组织,这就能解释为什么AD是脑部疾病。BACE1是一种重要的治疗靶点,因为它不仅抑制和降低Aβ水平,同时也防止包含整个Aβ的β-CTFs,而β-CTFs是形成Aβ的最终底物积累[20]。到目前为止,只有很少的生理学底物被证实与BACE1有明确的关联。剔除BACE1的小鼠仍可以繁殖,并没有表现出任何重大的行为、形态或发育缺陷[21]。

1A:抗Aβ生成途径由α-secretase和γ-secretase的水解作用完成。α-CTF(或C83):APP被α-secretase水解后产生的C端片段;sAPPα:APP被α-secretase水解后产生的N端片段;P3肽:Aβ17-42。1B:Aβ生成途径由β-secretase和γ-secretase的水解作用完成。β-CTF(或C99):APP被β-secretase水解后产生的C端片段;sAPPβ:APP被β-secretase水解后产生的N端片段。AICD:α-CTF被γ-secretase水解后产生的C端片段
图1 APP的两种水解途径

Nucleus:细胞核;ER:内质网;Golgi:高尔基体;Early endosome:初级内体;Recycling endsome:再循环内体;Lysosomes:溶酶体;Plasma membrane:细胞膜;γ-secretase:γ-分泌酶;ADAM10:解整合素金属蛋白酶10;BACE1:β位点淀粉样前体蛋白裂解酶1
图2 三种分泌酶在细胞内的活性部位分析
1.2γ-secretase产生活性的亚细胞部位 γ-secretase在跨膜结构域内水解APP得到完整的Aβ,γ-secretase的结构和功能曾被广泛讨论[22]。γ-secretase是由四个亚基组成的蛋白酶复合体[23],其中 Presenilin(PS)1或PS2在跨膜结构域内含有两个关键的天冬氨酸残基,它们是γ-secretase天冬氨酸蛋白酶活性催化域的一部分[24],另外的成分是Neistin(NCT)、APH-1A或APH-1B、PS增强子PEN-2,但NCT、APH-1和PEN-2的生物学功能仍不完全清楚[25],NCT可能是一种尺寸选择性的底物受体[26],但这个说法遭到一定的质疑[27]。γ-secretase的APP膜内处理并不局限于单个位点,似乎γ-secretase底物在其跨膜的内部会裂解几次,最终的γ-裂解位点不精确,因为在生理条件下,其裂解产物是37~43个氨基酸的Aβ[28]。这种差异对于AD病理学的理解最为重要,在这些产物中,Aβ42更容易形成低聚物,这种低聚物将影响记忆及脑神经细胞的存活率[29]。成熟的、具有酶活性的PS/γ-secretase没有定位于ER、高尔基体、高尔基体转运囊泡上,而主要定位于内涵体/溶酶体和细胞膜上,也包括吞噬体和自噬体内[30]。γ-secretase的亚基在ER/早期无组装或仅有部分组装结构,因此,早期γ-secretase没有酶活性。支持这些数据的主要观点包括:APP/C99/C83并没有在ER上被γ-secretase处理[31];通过免疫电镜显示,在高尔基体或反面高尔基体上不能观察到PS1,而在ER及质膜上却可以观察到;ER池内的PS1并未发生组装,而质膜池内的PS1已经组装,且具有活性[32];只有成熟的糖基化的NCT可以在激活的γ-secretase复合体中存在,未成熟的非糖基化的NCT则不会在激活的γ-secretase复合体中存在,γ-secretase结合的NCT很可能已经通过了高尔基体并主要分布于质膜上[31]。综上所述,γ-secretase具有不同的特征主要依赖于亚细胞的定位、pH及磷脂成分的改变,由此可见,γ-secretase比例的改变也是AD的病源基础。综上所述,γ-secretase对APP的裂解很可能发生在质膜以及内涵体/溶酶体上。
2 APP的分泌和代谢
APP在胞内的分泌途径如图3所示。在APP从ER到细胞膜的过程中,糙面ER合成的APP在ER和高尔基体内经过N-和O-连接的糖基化修饰,并在高尔基体进行酪氨酸磷酸化及硫酸化加工,再分泌至细胞膜;在过量表达APP的细胞内仅有10%的APP可以到达细胞膜上,大部分APP主要定位于高尔基复合体和反面高尔基体,未从细胞表面脱落的APP将在数分钟内从细胞膜上内化,这与APP的C端(也就是异构体APP695的682687残基)存在着“YENPTY”内化结构域相关[22]。随着内化的进行,APP被转运到内涵体进行各种分选代谢。
2.1非神经细胞内APP分选及Aβ的产生 APP的内化与二级结构“YENPTY”存在一定的关系,“YENPTY”的突变将会导致APP转运出现不同的结果,抑制APP的内化可以减少Aβ的产生[33]。此外,许多胞质内结合体也会为“YENPTY”的超二级结构提供结合位点,这些结合体包括Fe65、Fe65L1、Fe65L2、Mint 1、Mint 2、Mint 3、Dab1及c-Jun氨基端激酶等蛋白家族成员,过量表达Mint 1、Mint 2、Fe65将导致APP转基因小鼠脑内Aβ产生和沉积量的减少[34],暗示这类分子在APP代谢的生理过程中起调节作用。
在无极性的哺乳动物细胞内,抗淀粉质和淀粉质处理过程中,APP在ER中合成并经历折叠,随后进入高尔基体中进行修饰,再通过分泌囊泡顺行运输到达质膜,在质膜上,APP经过ADAM10处理后产生α-CTF(C83)以及sAPPα,C83经过γ-secretase处理,得到APP的胞内区域片段及P3蛋白,不能产生完整的Aβ肽[22],见图3(A)(B)(C);而淀粉质途径(将导致Aβ的形成)的过程如下,细胞表面未受到ADAM10裂解的APP,将与脂筏及BACE1通过BACE1“YENPTY”结构域介导内化,见图3(D),其进入内涵体被BACE1裂解,N端产生可溶性的片段称为sAPPβ,sAPPβ产生后从膜上脱离,见图3(E);C端产生的片段(β-CTF,C99)被拴在膜内;随后γ-secretase 将在溶酶体、细胞内的多囊体、内涵体以及细胞膜上对C99进行水解,产生APP的胞内区域以及不同长度的Aβ片段[5,11],见图3(F)。质膜也是γ-secretase水解C99的重要部位,见图3(G)。
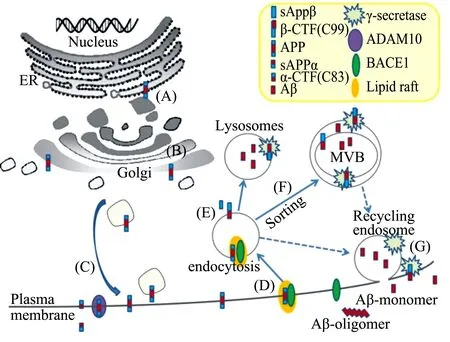
Nucleus:细胞核;ER:内质网;Golgi:高尔基体;Early endosome:初级内体;Recycling endsome:再循环内体;Lysosomes:溶酶体;Plasma membrane:细胞膜;MVB(multivesicular body):多囊体;endocytosis:内吞作用;Sorting:分类;Lipid raft:细胞膜上的脂筏结构;Aβ-monomer:Aβ单体;Aβ-oligomer:Aβ低聚体;γ-secretase:γ-分泌酶;ADAM10:解整合素金属蛋白酶10;BACE1:β位点淀粉样前体蛋白裂解酶1
图3 APP在细胞内的代谢过程
2.2APP在神经元内的分选途径 尽管非神经细胞对于认识APP的极性分泌和代谢起了重要的作用,例如,ADAM10主要分选至基底外侧质膜[35],但这些研究结果必须在神经元中得到论证,毕竟神经细胞被认为是体内产生Aβ的主要场所。神经元高度分化成胞体、轴突和树突三大部分,这三大部分均具有不同的功能,因此它们调节不同的蛋白质和脂质的运输,进一步细化分析,轴突和树突可以再分为许独立的空间(树突轴、树突小棘、轴突的轴和轴突突触前末梢等)。一个复杂的轨道系统(微管)、运输载体(驱动蛋白和动力蛋白)和目的标签(具体分选信号)以此来保证蛋白质各自精准地到达目的地,一旦干扰到这个运输系统将会影响APP代谢产物的运输,导致AD的发生[36]。
在神经细胞内,APP的加工受到严格调控,分泌酶与APP一起通过分泌途径沿着树突和轴突运输,并进入突触前小泡[37],BACE1和APP之间的相互作用发生在转运泡内,神经元的活性增强这些酶及其底物的再循环及在体内的汇聚。另一方面,活性的γ-secretase定位在末期的循环内体中[38]。与非神经细胞相似,γ-secretase经过囊泡转运到达质膜,再通过运输和转运等方式到达其活性的亚细胞部位。Aβ很可能在囊泡内产生,然后在胞内进行处理并到达前突触,见图4。γ-secretase在神经元亚细胞结构中的精细部位(轴突或胞体、树突内体/溶酶体以及树突或轴突自噬体等)以及在各部位之中产生的含量还有待确定[30]。

(A)APP由内质网(ER)转运至高尔基体;(B)高尔基体分离出包含APP的各种分泌囊泡;(C)囊泡可在神经元胞体与树突、轴突之间进行运输;Nucleus:细胞核;Golgi:高尔基体
图4 APP在神经细胞内的代谢过程
3 小 结
APP是Aβ生成的前体蛋白,是AD病理学的核心。从细胞生物学角度深入分析APP的水解过程,不仅能够说明Aβ产生的详细过程,还可以更好地分析治疗AD相关的分泌酶抑制剂。此外,了解三种水解酶的生物学特征,将为理解Aβ产生过程奠定一定的基础。Aβ的产生部位很可能位于内涵体、溶酶体或质膜上,Aβ在质膜上产生并与膜相互作用的机制研究也得到了阐述[39]。目前Aβ产生量较多亚细胞部位还有待阐明,未来依据APP的产生和分泌途径可能找到治疗AD的办法。

