靶向调控缝隙连接蛋白43对骨髓间充质干细胞成骨分化的影响
谢锡洪 张振伟 林泽金 林利忠
骨外科常常面临由外伤、肿瘤等原因引起的骨缺损问题,骨缺失修复方法成为骨外科关注的重点问题之一。骨髓间充质干细胞(bone marrow mesen⁃chymal stem cells,BMSCs)是骨髓中一类具有自我更新和多项分化能力的成骨干细胞,具有多向分化潜能,在不同诱导环境下能够分化为成骨细胞、软骨细胞、脂肪细胞、神经细胞等,具有易于获得、增殖能力强、易于体外培养和扩增等特点,因而可作为理想的骨组织工程种子细胞[1]。一系列的临床试验已经证实BMSCs能够促进体内新骨的形成[2,3]。因而,如何提高BMSCs 成骨分化潜能以及体内移植后骨形成能力,成为骨组织工程应用研究中亟需解决的关键问题。研究发现通过调控一些关键信号分子能够使BMSCs的增殖和分化能力大幅提升[4]。
缝隙连接(gap junction,GJ)是相邻两个细胞间形成的跨膜通道,其构成的细胞间隙连接通讯能够调节细胞间物质和信号的交换,在细胞的生长发育、分化、免疫应答等各种生理过程中发挥了至关重要的作用[5]。缝隙连接蛋白(connexon,Cx)是GJ 的基本结构和功能蛋白,6 个连接蛋白亚基围绕中央孔在相邻细胞膜上排列形成一个六聚体的跨膜通道,称为连接子(Connexon),当两个相邻细胞由连接子对接后形成缝隙连接。目前在哺乳动物体内发现有20 多种连接蛋白,其中Cx43 数量最为丰富、分布最为广泛,在细胞的物质交换以及电信号的传达过程中发挥了重要作用[6]。目前关于Cx43在人类肌肉骨骼系统中的生物学功能的研究相对较少,有研究显示Cx43在成骨分化和骨髓塑型中起到重要作用[7⁃10],但Cx43对BMSCs定向、增殖和分化等行为的调控机制有待进一步研究[8]。
材料与方法
一、实验动物和试剂
C57BL/6 小鼠购于广东省医学实验动物中心;293T 细胞购于中国科学院细胞库;DMEF/F12 培养基购于美国Gibco 公司;胰蛋白酶和胎牛血清购于杭州四季青公司;间充质干细胞成骨诱导分化培养基购于美国Cyagen 公司;Lipofectamine 2000 购于美国Invitrogen 公司;胶回收试剂盒、逆转录试剂盒、qRT⁃PCR试剂盒、质粒提取试剂盒购于大连TaKaRa公司;Western blot 试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)活性检测试剂盒购于上海碧云天公司;PTA2载体购自日本TOYOBO公司;T4 DNA连接酶购于加拿大Fermentas 公司;内切酶、普通Taq酶购于天根生化科技公司;嘌呤霉素(puromycin)、聚凝胺(polybrene)、BCA 蛋白检测试剂盒购于美国Sigma公司;慢病毒载体pHBLV⁃CMVIE⁃Puro购于上海汉恒生物公司;CD29⁃FITC、CD90⁃FITC、CD34⁃FITC、CD44⁃FITC、CD14⁃FITC 流式细胞抗体、大鼠Cx43单克隆抗体购于美国BD Pharmingen公司。
二、Cx43慢病毒载体的构建
GenBank 数据库中查找小鼠Cx43 基因序列,设计引物,在引物中引入酶切位点EcoRI和Ⅹba Ⅰ,上游引物:5′⁃CGGAATTCATGGGTGACTGGAGCG⁃3′,下游引物:5′⁃GCTCTAGAAATCTCCAGGTCATCAG⁃GC⁃3′,由上海生工生物技术有限公司合成。以Cx43 的cDNA 为模板进行PCR 扩增,PCR 扩增目的基因的反应条件为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,共30 个循环,72 ℃延伸7 min,回收后与克隆载体PTA2 连接获得重组载体质粒PTA2⁃Cx43。将PTA2⁃Cx43载体和慢病毒表达载体pHBLV⁃CMVIE⁃Puro 分别用内切酶EcoRI、Ⅹba Ⅰ进行酶切,产物经琼脂糖凝胶电泳,使用胶回收试剂盒回收目的基因片段和目的载体,然后将Cx43目的片段与线性化pHBLV⁃CMVIE⁃Puro载体进行连接,将合成的新载体命名为pHBLV⁃Cx43⁃Puro。
三、慢病毒包装及滴度测定
用含有10%胎牛血清的DMEM 培养基培养293T 细胞,当细胞密度在80%~90%时即可进行转染。用质粒提取试剂盒大量提制慢病毒质粒pH⁃BLV⁃Cx43⁃Puro 和辅助包装载体PSPAX2、PMD2G。采用Lipofectamine 2000 转染试剂将慢病毒质粒和辅助包装载体共同转染293T细胞,转染48 h和72 h后收集病毒上清液,经过滤器过滤后离心浓缩病毒。采用稀释计数法将LV⁃Cx43 进行稀释,稀释后的病毒加入293T 细胞,24 h 后用含有Puromycin(2 μg/ml)的培养基筛选,显微镜下计算病毒滴度。滴度(TU/ml)=细胞数×百分比×1(multiplicity of in⁃fection)×病毒稀释倍数×103。
四、BMSCs的分离及培养、鉴定
将C57BL/6小鼠(4~6周)颈椎脱臼处死,用75%的酒精浸泡5 min消毒,无菌条件下取出股骨、胫骨,剔除肌肉和筋膜组织,将骨骺端剪断后置于DMEM/F12培养基(不含血清)中,在一头插入0.45 mm规格的注射器,用DMEM/F12 培养基反复冲洗骨髓腔,PBS洗涤后离心,用200目不锈钢筛网过筛,将获得的细胞1 500 r/min 离心5 min;弃上清,用完全培养基(含10%胎牛血清、1%的青链霉素的DMEM/F12培养基)将细胞重悬。把骨头剪成1~3 mm3的小片,添加1 mg/ml胶原酶后在震荡培养箱中37 ℃孵化1~2 h。将分离的细胞接种于培养皿中,同时将消化好的小骨同时种入,置于37 ℃、5%CO2恒温培养箱中静置培养,待细胞融合至80%~90%时,用0.25%的胰蛋白酶消化,按1∶2 进行传代培养。取第三代细胞,消化后用PBS 洗涤,加入FITC 标记的CD29、CD44、CD90、CD14、CD34,用流式细胞仪检测细胞表面分子表达水平。
五、Cx43慢病毒转染BMSCs
取生长状态良好的第二代细胞,消化后接种于6 孔板(1×105/孔)中,24 h 后更换用新鲜培养基,polybrene 浓度为6 μg/ml。分别在实验组和对照组加入10 μl 重组慢病毒载体(滴度为1×108TU/ml)pHBLV⁃CX43⁃Puro(Cx43 组)和空载体pHBLV⁃CMVIE⁃Puro(空载体组),选用未转染的细胞作为空白对照。感染24 h后更换为完全培养基,继续培养48 h 后更换含puromycin(2 μg/ml)的完全培养基进行筛选,72 h后消化细胞进行后续试验。
六、qRT⁃PCR检测Cx43 mRNA的表达
用RNA 提取试剂盒分别提取空白对照组(BM⁃SCs 细胞)、Cx43 组、空载体组BMSCs 细胞中的RNA,鉴定后的RNA通过逆转录获得cDNA,以逆转录好的cDNA作为模板,以GAPDH为内参基因检测Cx43 mRNA的表达,Cx43 mRNA的表达情况用2-△△Ct值表示。
七、Western blot检测Cx43蛋白表达
收集细胞,按照总蛋白提取试剂盒提取细胞总蛋白,蛋白定量后,取三组细胞裂解液,上样SDS⁃PAGE凝胶电泳,继而转膜,使用5%脱脂奶粉封闭,1 h后加入相应一抗4 ℃孵育过夜,TBST洗膜3次后加入辣根过氧化氢酶偶联的二抗,孵育2 h 后TBST洗膜3次,加入ECL发光剂显色3 min后压片显影检测Cx43表达,用GAPDH作为内参,采用灰度分析比较各条带。
八、成骨相关基因以及ALP活性检测
将各组BMSCs 细胞以2×105个/ml 的密度分别接种于6 孔培养板中,培养至贴壁细胞达60%后弃原液,加入成骨诱导液进行诱导分化培养,每2 d换液1 次。成骨诱导分化7 d 后按照试剂盒说明书进行ALP 活性检测,ALP 活性(U/g prot)=[(测定管吸光度值/标准管吸光度值)×标准管对硝基酚量]/总蛋白克数。成骨诱导分化7 d、14 d后提取各组转染BMSCs细胞RNA,逆转录后进行qRT⁃PCR检测。按照qRT⁃PCR试剂盒说明书反应体系条件进行实验,设计Runt 相关转录因子2(runt⁃related transcription factor 2, Runx2)、锌指结构转录因子(Osterix/Sp7)、转录活化因子4(activating transcription factor 4,ATF4)、骨唾蛋白(bone sialoprotein, BSP)引物序列(表1),由上海生工生物技术有限公司合成引物,qRT⁃PCR检测Runx2、Osterix/Sp7、ATF4、BSP的表达情况。以GAPDH 为内参,成骨相关基因(Runx2、Osterix/Sp7、ATF4、BSP)表达情况用2-△△Ct值表示。

表1 成骨相关基因PCR引物序列
九、统计学分析
采用SPSS 22.0统计学软件(IBM公司,美国)进行数据分析,计量资料数据用均数±标准差(±s)表示,组间比较采用方差分析(F 检验),P<0.05 为差异有统计学意义。
结 果
一、Cx43慢病毒构建以及病毒滴度测定结果
构建的pHBLV⁃Cx43⁃Puro 中目的基因Cx43 长度为1 141 bp,经过PCR 和酶切后电泳鉴定符合目的基因片段大小(图1),将构建后的慢病毒载体进行测序发现序列与GenBank 目标序列一致,说明成功构建了pHBLV⁃Cx43⁃Puro载体。经过包装后得到病毒滴度为2×108TU/ml。

图1 慢病毒pHBLV⁃Cx43⁃Puro 鉴定结果 a:含Cx43 基因的pH⁃BLV⁃Cx43⁃Puro 载体PCR 鉴定结果;b:pHBLV⁃Cx43⁃Puro 酶切鉴定结果
二、BMSCs培养以及表型鉴定
刚获得的骨髓细胞呈现大小不均的圆形或者椭圆形(图2 a)。5 d 后细胞可达到90%的融合,传代后生长迅速,细胞呈现梭形或纤维状,形态均一(图2 b)。成骨诱导后部分细胞出现形状方面的转变,变为多角形、立方形等,可有较多伪足(图2 c)。
流式细胞仪分析细胞表面抗原显示CD29、CD44、CD90呈现阳性表达,而CD14和CD34呈现阴性表达,证实为BMSCs,结果见图3。
三、Cx43 慢病毒对BMSCs 中Cx43 mRNA 和蛋白表达的影响

图2 BMSCs细胞形态观察(×100) a:原代骨髓细胞;b:第3代BMSCs细胞;c:成骨诱导后的BMSCs细胞

图3 BMSCs细胞表面标记检测结果
将Cx43 慢病毒转染至BMSCs 细胞后,发现Cx43 组中Cx43 mRNA 的含量较空载体组和空白对照组显著升高,差异均有统计学意义(P 均<0.05),见图4 a;Western blot 结果表明Cx43 组中Cx43 相对表达量为1.17±0.17,显著高于空载体组0.54±0.13和空白对照组0.57±0.12,见图4 b,表明Cx43慢病毒感染后能够显著提高BMSCs细胞中Cx43的表达。
四、qRT⁃PCR检测成骨相关基因的表达
qRT⁃PCR 检测结果显示细胞培养7 d 和14 d后,Cx43 组成骨相关基因Runx2、Osterix/Sp7、ATF4和BSP的mRNA表达均明显高于空白对照组和空载体组,差异均有统计学意义(P均<0.05,见图5)。
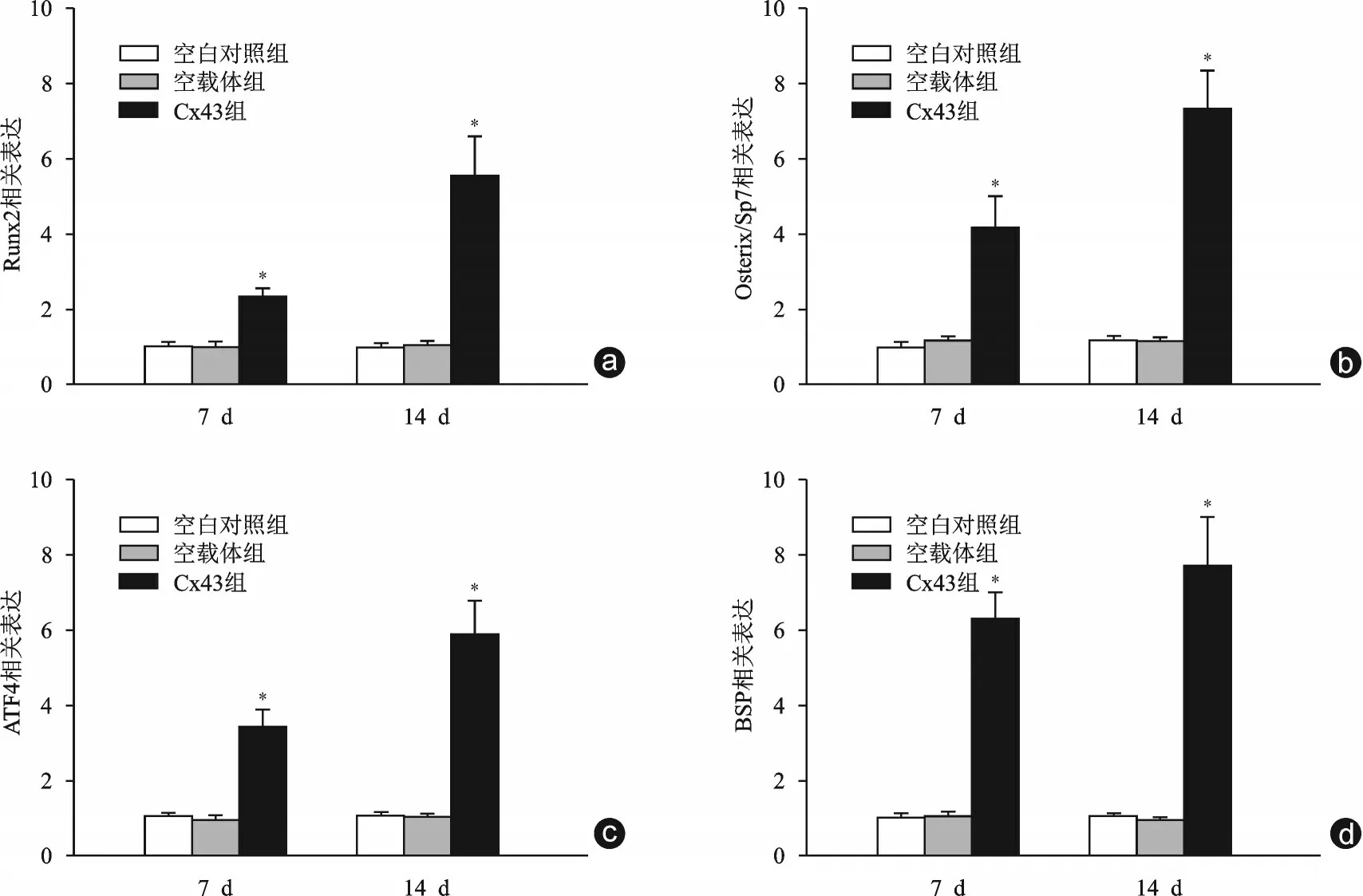
图5 不同组别中成骨相关基因Runx2、Osterix/Sp7、ATF4和BSP的表达比较(与空白对照组、空载体组比较,*P均<0.05)
五、ALP活性分析
成骨诱导7 d 后,Cx43 组ALP 活性显著高于空白对照组和空载体组,差异有统计学意义(P 均<0.05),见图6。
讨 论
在骨骼系统中Cx43 是表达最为丰富的缝隙连接蛋白,在成骨细胞、破骨细胞、骨细胞中均广泛表达[11]。研究发现Cx43 对成骨细胞的分化及功能具有调节作用。体外研究表明,miR⁃144⁃3p 和骨形成密切相关,Cx43 是miR⁃144⁃3p 的一个靶基因,miR⁃144⁃3p 通过对Cx43 的调控发挥作用[7]。动物实验发现整体敲除Cx43 后,可引起KO 小鼠成骨细胞功能障碍而不能存活,而条件性敲除成骨细胞Cx43的KO小鼠,出现成骨细胞分化障碍,虽然能够存活,但表现出骨渐进性增生[8]。此外Cx43 基因突变能够引起眼齿指发育不良症、颅骨干髓端发育不良症等疾病[9,10]。

图4 不同组别中Cx43 mRNA和蛋白表达比较(与空白对照组、空载体组比较,*P<0.05)

图6 BMSCs 培养7 d后各组细胞的ALP活性(与空白对照组、空载体组比较,*P均<0.05)
本研究中我们分离出小鼠BMSCs,发现细胞呈现纤维状、梭形,通过分析其细胞表型发现CD29、CD44、CD90 呈现阳性表达,而CD14 和CD34 呈现阴性表达,这与许多文献的报道的BMSCs 特征一致[12,13]。本研究构建了Cx43慢病毒,转染BMSCs后发现细胞中Cx43蛋白和mRNA表达显著升高,成功构建了Cx43慢病毒转染BMSCs过表达体系。
进一步的研究显示,在成骨诱导分化过程中,Cx43 过表达的BMSCs 细胞中,成骨因子Runx2、Osterix/Sp7、ATF4和BSP的表达显著增强,显著高于对照组和空载体组。Runx2、Osterix/Sp7、ATF4 和BSP 是成骨分化的重要调控因子,在骨发生和成骨细胞分化过程中发挥了重要作用,其表达升高提示Cx43的过表达能够诱导和促进成骨分化[14,15]。ALP是BMSCs向成骨细胞分化的早期标志性酶,通常分化过程的第1 周表达出现高峰[16],本研究显示Cx43过表达的BMSCs 细胞中ALP 活性显著高于空载体组和空白对照组。通过对ALP 活性和成骨相关基因的检测分析,说明Cx43过表达有利于BMSCs细胞成骨分化。这些结果表明Cx43 在BMSCs 向成骨细胞分化过程中具有积极地促进作用。
Cx43作为一个关键的细胞缝隙连接蛋白,其表达调控可能为骨损伤修复提供了新的方式,有着重要的意义。但是Cx43 调控在体内是否能够促进成骨分化仍然需要进一步的探索和研究。

