人体肠道中产尿酸氧化酶细菌的筛选、鉴定与酶学性质研究
张庆芳,王浚晨,于爽,刘春莹,迟雪梅,迟乃玉
(大连大学 生命科学与技术学院,辽宁省海洋微生物工程技术研究中心,辽宁 大连,116622)
尿酸是人体嘌呤代谢的最终产物,很难被排出体外,如果在体内大量积累会引发高尿酸血症,长期保持在高浓度将会进一步引发通风等疾病。随着人们生活水平日益提高,人们日常摄入的牛肉、海鲜等高嘌呤食品也不断增多,痛风的患病率逐年上升。尿酸氧化酶能够有效催化尿酸降解生成尿囊素和CO2,使之在人体内快速降解。而人体自身无法合成尿酸酶,只能靠外界的摄入。自然来源的尿酸酶最早在牛胃中发现[1],随后从微生物中发现的尿酸酶被陆续报道。依靠繁殖快、产量大等特点,微生物很快成为尿酸酶的主要来源。
尿酸酶因其能够快速降解尿酸的作用,很早便被用作医药用酶[2-4]。近年来,国内外针对尿酸酶的应用与研究也在不断深入。在临床检测上,尿酸酶可以用来制备尿酸检测试剂盒以供相关病患预防痛风等疾病;在临床治疗上,尿酸酶可以直接供高尿酸患者注射,有效降低尿酸浓度;在食品生产方面,尿酸酶亦可以用作食品添加剂专供高尿酸患者食用。根据早年报道,尿酸酶已经成功在乳酸菌、酿酒酵母等食用菌株中异源表达[5],对微生物发酵工业有重要意义。
人体每天排出的尿酸,2/3从尿液中排泄,另外1/3则由肠道分解消化[6]。肠道吸收尿酸由肠道菌群参与代谢调控,肠道微生态环境在人体微生态系统中最为庞大,其含有的细菌种类繁多[7]。痛风患者的肠道菌群,由于受到高浓度尿酸的影响,相对于正常人存在失调现象,主要表现为产尿酸酶菌株增多,乳杆菌和双歧杆菌减少[8]。本实验设计从痛风患者粪便中筛选得到产尿酸氧化酶细菌,并对其菌株种类进行16S rDNA鉴定,最后对其产生的尿酸酶进行酶学性质研究,旨在针对功能性尿酸酶的开发与研究做出突破,得到高产尿酸氧化酶菌株,为日后尿酸酶的发酵生产奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 材料与试剂
选择1名痛风患者新鲜粪便为样品;
尿酸、酵母膏、NaCl、MgSO4、K2HPO4、KH2PO4、琼脂、上海生工。
1.1.2 培养基
初筛培养基(g/L):尿酸5,酵母膏0.5,NaCl 0.5,MgSO40.5,K2HPO42.0,KH2PO40.5,琼脂20,pH 7.5;
复筛培养基(g/L):尿酸5,酵母膏0.5,NaCl 0.5,MgSO40.5,K2HPO42.0,KH2PO40.5,pH 7.5;
菌株保藏培养基(g/L):酵母膏3,蛋白胨5,NaCl 0.1,MgSO40.5,K2HPO42.0,KH2PO40.5,琼脂20,pH 7.5。
1.1.3 仪器与设备
HZC-250双层恒温振荡培养箱,北京佳源兴业科技有限公司;WS-300恒温培养箱,北京金达阳光科技有限公司;DK98-1水浴锅,北京泰泽嘉业科技发展有限公司;KL-14105鼓风干燥箱,上海康朗生物科技有限公司;HBS-1906A酶标仪,上海研卉生物科技有限公司;YXQ-LS-75A压力蒸汽灭菌锅,北京佳源兴业科技有限公司;Sorvall ST 8台式离心机,北京昊诺斯科技有限公司;ELITE 300电泳仪,北京铭泰佳信科技有限公司。
1.2 实验方法
1.2.1 菌株初筛
准备250 mL锥形瓶1个,取少量患者粪便置于瓶内,倒入100 mL无菌水振荡混匀。随后将混匀后的样品进行梯度稀释,分别涂布于初筛培养基上,37 ℃倒置培养,随时观察菌落形态与透明圈大小,挑选合适菌株进行复筛。
1.2.2 菌株复筛
将初筛得到的不同菌株分别接种于100 mL复筛培养基中,培养条件设置为37 ℃,120 r/min培育36 h,随后对菌液进行酶活检测,方法参考1.2.4,挑选出酶活最高的菌株。
1.2.3 菌株鉴定
1.2.3.1 形态学鉴定
将筛选得到的菌株接种于固体培养基(同初筛培养基)上,37 ℃划线培养24 h,得到单菌落;标记单菌落,并观察其菌落形状、大小及颜色;利用接种环挑取合适菌株,通过革兰氏染色,在光学显微镜(10×100)下观察其形状、排列及颜色,对其分类鉴定。
1.2.3.2 分子生物学鉴定
将筛选后的菌株进行16S rDNA基因扩增,通过琼脂糖凝胶电泳观察扩增产物条带大小,并对扩增产物进行基因测序,测序工作由上海生工完成;将测序结果经NCBI数据库,进行BLAST比对,利用软件MEGA5构建系统发育树。
1.2.4 酶活鉴定
1.2.4.1 制备粗酶液
将菌株置于发酵培养基(同复筛培养基)中培育36 h、37 ℃、120 r/min,取菌液12 000 r/min离心10 min,倒掉上清液,将湿菌洗涤3次以上。利用超声波破碎,参数设定为100 mL样品,功率300 W,破碎时间3 s,间隔时间2 s,总时间15 min。将破碎得到的产物12 000 r/min离心15 min,提取上清液即粗酶液。
1.2.4.2 酶活测定方法
取150 μL 4-AAP(30 mmol/L),100 μL TBHBA(1 mmol/L),50 μL过氧化物酶(15 U/mL),加入到25 mL比色管中,40 ℃预热10 min,再加入粗酶液100 μL,600 μL硼酸盐缓冲液(pH 8.4,0.1 mol/L),0.2 g尿酸,去离子水定容至20 mL,分装至96孔板,在540 nm处观察吸光度的变化[9]。空白对照为硼酸盐缓冲液。
酶活单位定义为37 ℃测定条件下,1 min催化产生1 μmol H2O2的酶量为1个酶活单位。
1.2.5 酶的分离纯化
离心破碎后得到粗酶液,通过70%饱和(NH4)2SO4进行盐析沉淀,4 ℃条件下过夜[10],随后经过透析袋,转移到10 kDa超滤管中离心超滤;将超滤后的酶液进行Sephadex G-100 凝胶过滤层析,在每个洗脱峰处进行收集,分别检测样管酶活,收集酶活连续升高至降低的所有样管即为纯化后的尿酸氧化酶;最后通过SDS-PAGE电泳检测纯化后的产物,观察分析其电泳条带,并测定酶活大小,计算纯化倍数。
1.2.6 酶学性质研究
1.2.6.1 最适作用温度
收集一定量酶液,分别检测10、15、20、25、30、35、40、45、50、55、60、65、70 ℃条件下各样品酶活,共计3组平行实验,最终测量结果最高值设定相对酶活为100%,计算剩余样品比活力。
1.2.6.2 酶的最适pH
将酶液分别置于pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0不同缓冲液中,检测各样品酶活,共计3组平行实验,最终测量结果最高值相对酶活设为100%,计算剩余样品比活力。
1.2.6.3 酶的热稳定性
将酶液分别置于20、30、40、50、60、70 ℃水浴锅中保温1 h,在37 ℃检测各样品残留酶活,共计3组平行实验,取最终测量结果最高值相对酶活设为100%,计算剩余样品比活力。
1.2.6.4 pH对酶稳定性的影响
将酶液分别置于pH 2.0~11.0(条件同1.2.6.2)缓冲液中,37 ℃保温1 h,检测各样品残留酶活,共计3组平行实验,取最终测量最高值相对酶活设为100%,计算剩余样品比活力。
1.2.6.5 金属离子对酶活的影响
在酶最适作用条件下,分别向酶液中加入Fe2+、Ca2+、K+、Mg2+、Cu2+、Zn2+、Mn2+等不同金属离子缓冲液[11],浓度设为5 mmol/L,测定不同金属离子对酶活的影响,共计3组平行实验。
2 结果与分析
2.1 菌株筛选
从5种产尿酸氧化酶菌株中筛选出1株酶活最高的菌株,参照1.2.4.2在37 ℃下检测其酶活达到15.18 U/mg,命名为JC-5。
2.2 菌株鉴定
2.2.1 形态学鉴定
如图1所示,菌落产生较大透明圈,呈白色圆形,边缘规则,表面光滑,未产生孢子,革兰氏染色呈红色,鉴定为革兰氏阴性菌。

A菌落形态;B-革兰氏染色图1 JC-5菌落形态及革兰氏染色Fig.1 JC-5 colony morphology and gram staining
2.2.2 分子生物学鉴定
将扩增出的16S rDNA基因片段进行琼脂糖凝胶电泳,结果如图2所示,在1 500 bp左右有明显条带。

M-Marker;1-16S rDNA图2 菌株JC-5 16S rDNA琼脂糖凝胶电泳Fig.2 Strain JC-5 16S rDNA agarose gel electrophoresis
随后对基因序列进行测序,测序工作由上海生工完成,测序后得到的基因大小为1 493 bp,与电泳结果一致。将测序得到的16S rDNA基因序列在GenBank基因库中进行BLAST比对,选择同源性在99%以上的菌株及不同属、种间相似度最高菌株基因序列,利用MEGA5构建系统发育树,结果如图3所示,菌株JC-5与彭氏变形杆菌Proteuspenneristrain 2203同源性最高,鉴定并命名为彭氏变形杆菌ProteuspenneriJC-5。
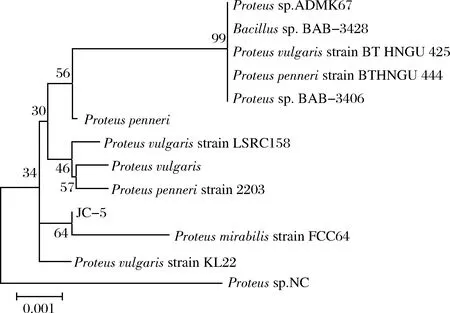
图3 菌株JC-5 16S rDNA基因序列系统发育树Fig.3 Phylogenetic tree of strain JC-5 16S rDNA gene sequence
2.3 酶的分离纯化
分离纯化结果如图4所示,提取部分粗酶液,加入70%饱和(NH4)2SO4过夜盐析后,进行透析超滤,再经过SDS-PAGE电泳得到明显蛋白条带。随后利用Sephadex G-100 凝胶过滤层析,在293 nm处检测吸光度变化,并检测吸收峰处的酶活,在25管检测到酶活,表示目的蛋白开始被洗脱下来,32管酶活达到最高,41管检测不到酶活,表明已被完全洗脱,收集此吸收峰内的产物即为纯化后的尿酸氧化酶。对得到的纯化产物进行SDS-PAGE电泳,结果如图5所示,25~32管所收集的样品在35 kDa左右有明显条带,33~40管开始出现杂条带,推测其分子质量约为35 kDa。对纯化后的样品进行酶活检测,酶总活力为51.48 U,详细结果参照表1,酶比活为66 U/mg,纯化倍数达到3.6。

M-Marker;1-粗酶液;2-粗酶液 (4 ℃过夜);3-超滤图4 粗酶液盐析-SDS-PAGE电泳Fig.4 Crude enzyme solution salting out-SDS-PAGE electrophoresis
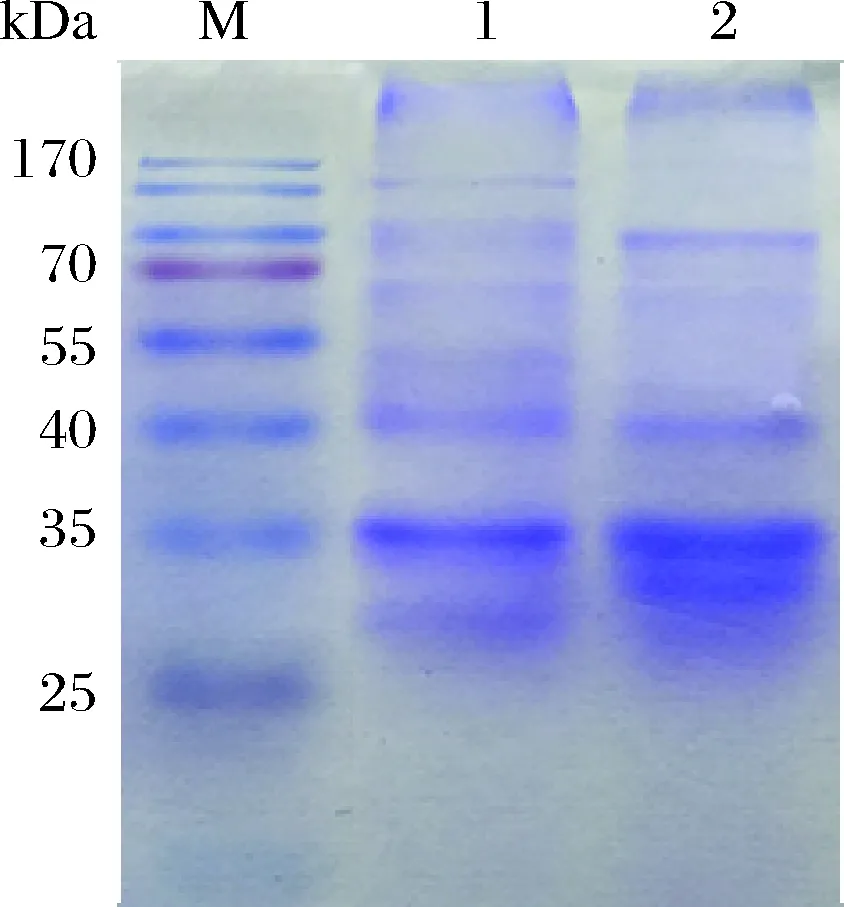
M-Marker;1-Sephadex G-100凝胶过滤层析(25~32管);2-33~40管图5 凝胶过滤层析-SDS-PAGE电泳Fig.5 Gel filtration chromatography-SDS-PAGE electrophoresis

表1 粗酶液分离纯化结果Table 1 Crude enzyme solution separation and purification results
2.4 酶学性质研究
2.4.1 酶最适作用温度及热稳定性
对酶最适温度的检测结果如图6所示,在35 ℃酶活达到最大,相对酶活定为100%,25~30 ℃时,相对酶活保持在80%左右,20 ℃酶活仍维持在50%,40 ℃开始酶活迅速下降,50 ℃相对酶活降至20%,60 ℃失活。针对该酶热稳定性的检测,由图7可知,在30 ℃处理1 h后该酶保持一定酶活且相对稳定,在20 ℃处理1 h后仍有75%相对酶活,50 ℃处理1 h后相对酶活仅有6.2%,表明该酶热稳定性较差。

图6 酶最适作用温度曲线Fig.6 Enzyme optimum temperature curve

图7 酶的热稳定性Fig.7 Thermal stability of the enzyme
2.4.2 酶的最适pH及稳定性
将酶置于pH 2.0~11.0的缓冲液中检测其酶活,结果如图8所示,在pH 8.0时酶活最大,相对酶活设为100%,随着pH降低或升高,酶活缓慢下降,碱性环境pH 9.0~10.0条件下,相对酶活在80%左右,pH 11.0时相对酶活为68%;在酸性环境中pH 4.0~6.0时,该酶相对酶活在70%左右,pH 2.0时仍有21%的相对酶活。针对其耐酸碱稳定性研究结果如图9所示,pH 8.0时检测值最大,相对酶活设为100%,在pH 4.0~6.0时,相对酶活维持在50%以上,表明该酶具有一定的耐酸性,pH 7.0~9.0时相对酶活保持在80%以上,pH 11.0时的相对酶活降至20%,表明该酶在弱碱性条件下更利于保存。
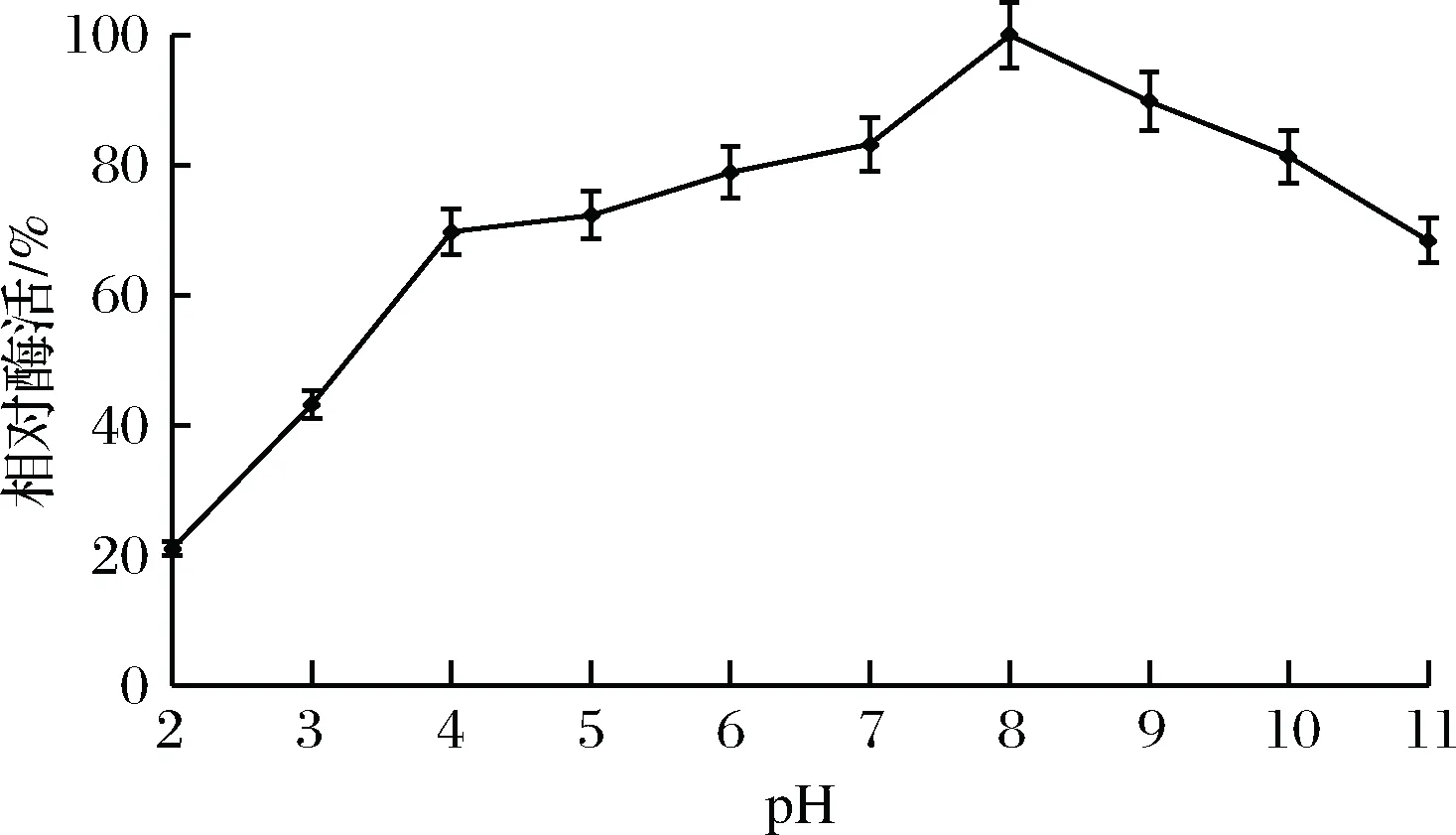
图8 酶的最适pH曲线Fig.8 Optimal pH curve of enzyme

图9 不同pH对酶稳定性影响Fig.9 Effect of different pH on enzyme stability
2.4.3 金属离子对酶活性的影响
结果如表2所示,Ca2+与Mn2+对酶有激活作用,Ca2+的激活作用较强,处理后的相对酶活达到132%,Fe2+、K+、Mg2+、Cu2+、Zn2+对酶活都有一定的抑制作用,Fe2+使酶活性降低50%。

表2 不同金属离子对酶活的影响Table 2 Effects of different metal ions on enzyme activity
3 结论
本实验从痛风病人肠道内筛选得到1株优产尿酸氧化酶菌株,命名为JC-5,通过16S rDNA测序,鉴定为彭氏变形杆菌。通过盐析、G-100 凝胶过滤层析等步骤分离纯化,该菌所产尿酸酶最终酶活达到66 U/mg。通过对其酶学性质研究,确认该酶最适作用温度为35 ℃,并在30~40 ℃保持一定热稳定性。该酶最适pH为8.0,在pH 7.0~9.0稳定性强。Ca2+与Mn2+对该酶有一定激活作用,Fe2+对酶抑制作用较强,与猪的肠道菌群所产酶的作用结果相似[12]。该酶在常温状态下热稳定性一般,在保藏与运输方面存在不足,未来可对其产酶基因进行修饰,用于工业化生产[13]。
4 讨论
变形杆菌主要存在于人体及动物的肠道内,以奇异变形杆菌(P.mirabilis)最为常见,而后是普通变形杆菌(P.vulgaris),彭氏变形杆菌(P.penneri)和摩尔根变形杆菌(P.morganii)相对较为少见[14]。奇异变形杆菌是引起人类食物中毒的主要菌株,一些还会造成泌尿感染、结石等疾病[15]。彭氏变形杆菌较为少见,一般在医院环境及患者身上筛选得到[16],与铜绿假单胞菌具有高度相似性(86%)。最早在1988年有报道表明,同其他变形杆菌一样,该菌株也能催化尿素形成CO2和氨,影响尿液的pH变化导致尿道结石等疾病[17]。除了能够产生尿素酶催化尿素反应外,变形杆菌在体内也可以产生大量尿酸酶用于降解尿酸,其在尿毒症患者体内降解尿酸的能力仅次于大肠杆菌[18]。
本实验从痛风患者粪便中筛选得到的产尿酸酶菌株通过系统发育树鉴定为彭氏变形杆菌(P.penneri),相对于其他种类变形杆菌,P.penneri可随呼吸道侵染人体或动物,进入食道及肠道,当抵抗力下降时容易被感染。该菌株带有一定的致病性,将来实验可以对该产酶菌株的生长、发酵特性及毒理学进行研究;也可以将该菌株进行诱变育种,提取其产酶目的基因进行进行基因克隆工业化生产。
目前国内外少有关于尿酸酶热稳定性的报道[19-20],本实验筛选菌株所产尿酸酶,最适温度处于人体体温范围,适合用于痛风病人的临床诊断与注射治疗[21, 5];在人体弱碱性环境中能够有效降解尿酸,未来在医药用酶的开发方面亦有着很大发展前景[22]。但其在低温环境下稳定性较差,不利于保存。张庆芳等[23]筛选的海洋来源菌株Z7所产低温尿酸酶可以在20 ℃仍保持较好稳定性,将来可以更多地筛选生长在严苛环境下的产尿酸氧化酶菌株,针对其耐寒性、耐热性及抗酸碱性作出研究;另一方面,将来可以对两种产酶基因进行修饰,起到功能互补的作用。

