与猪同群饲养山羊暴发伪狂犬病的确诊及山羊源伪狂犬病病毒JC株的分离鉴定
陶 松,刘 宁,姚 俊,朱刚毅,余桃樱,王兆美,陶政泽,刘保有,王生奎
(1.云南农业大学 动物科学技术学院,云南 昆明 650201;2.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224;3.云南省江川县动物疫病预防控制中心,云南 江川 652600;4.云南省贡山县农业和科学技术局,雁南 贡山 673500)
伪狂犬病病毒属于疱疹病毒科疱疹病毒亚科,又称猪疱疹病毒Ⅰ型,可引起牛、羊、猫、马等家畜和多种野生动物产生以发热、奇痒(猪除外)及脑脊髓炎为特征的急性致死性传染病[1]。该病毒可感染多种家畜和野生动物,是一种典型的并且难防控的自然疫源性疾病之一,猪是该病的自然宿主和储存宿主。猪感染伪狂犬病病毒后出现的症状因日龄不同而异,妊娠母猪感染后可引起流产,产木乃伊胎和死胎;哺乳仔猪感染出现神经症状,麻痹、衰竭死亡,死亡率几乎高达100%;成年猪一般为隐性感染,不表现临床症状,但病毒可在猪体内保存很长时间,导致成年猪长期处于带毒和排毒状态,是最为危险的传染源[2]。绵羊感染伪狂犬病病毒后初期体温升高,肌肉震颤,病羊常用前肢摩擦口唇和头部瘙痒处,瘙痒严重时病羊会狂躁不安,用头部猛烈的向坚硬物体摩擦,并啃咬瘙痒部皮肤,从而导致被毛粗乱、皮肤出血,继之病羊食欲减退,侧身倒卧,阴咽喉部麻痹而流出泡沫样唾液和浆液性鼻汁[1]。2015年11月,云南省江川县某养殖户家中与育肥猪同群饲养的136只黑山羊相继暴发以发热、烦躁不安、全身剧烈瘙痒及高死亡率为特征的疫情。发病无年龄、大小、性别差异,发病羊发热、食欲废绝、烦躁不安、全身剧烈瘙痒,导致其啃咬、角挑、摩擦自身身体使得局部体表脱毛、出血、创伤,部分个体出现腹泻,发病山羊最终衰竭而死。病理剖检可见肺脏出血,全身淋巴结肿大、出血,大脑水肿、充血、出血,为及时确诊病因,我们采集病死山羊内脏及大脑组织进行山羊关节炎/脑炎、狂犬病及伪狂犬病病毒野毒PCR检测,同时进行病毒分离培养、鉴定,并采集育肥猪血清样品进行伪狂犬病病毒gB及gE抗体检测,最终确诊了引起此次山羊疫情的病原为伪狂犬病病毒野毒,传染源为同群饲养隐性带毒猪。
1 材料与方法
1.1 样品病死山羊内脏组织(包括肺脏、脾脏、肝脏、肾脏、淋巴结)及大脑组织;16份育肥猪血清样品。
1.2 细胞BHK21传代细胞系由云南省热带亚热带动物病毒病重点实验室冻存。
1.3 主要试剂及仪器Gibic MEM细胞培养基、Gibic新生犊牛血清购自美国生命技术有限公司(Life Technologies);病毒DNA提取试剂盒(Viral DNA Kit)、病毒RNA提取试剂盒(Viral RNA Kit)购自美国OMEGA生物技术有限公司;2×Plus Taq酶、DL2000 DNA Marker、琼脂糖凝胶DNA回收试剂盒均购自天根生物技术(北京)有限公司;一步法RT-PCR试剂盒(One Step RT-PCR Kit)购自宝生物(大连)生物工程技术有限公司;实时荧光定量RT-PCR试剂盒AgPath-IDTMone-step RT-PCR Kit(AM1005)购自美国生命技术有限公司(Life Technologies)。倒置显微镜为ZEISS/Primo Vert显微镜;培养箱为THERMO SCIENTIFIC CO2培养箱;生物安全柜为ESCO/CLASS II TYPE A2;PCR 仪Gene Amp PCR System 9700、梯度PCR仪、Real-time PCR 7500 Fast System均购自美国 ABI(Applied Biosystems Inc.)公司。伪狂犬病病毒gE及gB抗体检测ELISA试剂盒购自美国IDEXX动物疫病诊断试剂有限公司。
1.4 试验动物成年昆明小鼠10只,家兔6只,山羊3只,均由云南省热带亚热带动物病毒病重点实验室实验动物中心提供。
1.5 引物伪狂犬病病毒野毒gE、gC及TK基因检测引物由云南省热带亚热带动物病毒病重点实验室设计。山羊关节炎/脑炎、狂犬病病毒检测引物参考相关发表文献合成[3-4],以上引物均由昆明硕擎生物科技有限公司合成。详细的引物、探针信息见表1。

表1 引物、探针信息表
1.6 病料的处理将内脏组织及大脑组织分别与1×MEM按照质量体积比1∶3的比例匀浆后反复冻融3次,然后4 500 ×g离心15 min,取上清置于-80℃冰箱内保存备用。
1.7 病毒核酸的抽提取上述经过前期处理的病死山羊内脏组织及大脑组织匀浆,4 500×g离心10 min 后,取上清液按美国OMEGA病毒基因组DNA、RNA提取试剂盒说明书操作,提取病毒核酸(RNA/DNA)样品放置于到-80℃保存备用。
1.8 狂犬病病毒、伪狂犬病病毒及山羊关节炎/脑炎病毒PCR检测运用云南省热带亚热带动物病毒病重点实验室建立的伪狂犬病病毒gE基因PCR检测方法,以及参考相关发表文献中的狂犬病病毒RT-PCR检测方法、山羊关节炎/脑炎病毒PCR检测方法[3-4],对送检病死山羊内脏组织及脑组织匀浆上清抽提的RNA及DNA样品进行检测。其中:(1)伪狂犬病病毒 PCR扩增反应体系为25 μL,反应组分分别为2×Taq Plus PCR Master mix 12.5 μL,上、下游引物(PRV-gE-810-F、R,10 μmol/L)各1 μL,模板DNA 4 μL,用无核酸酶的PCR级无离子水补足至25 μL总体积,混匀,短暂离心后上机。反应条件为95℃ 5 min,95℃ 40 s、58℃ 40 s、72℃ 90 s运行35个循环,72℃ 5 min。(2)山羊关节炎/脑炎病毒PCR检测方法按照25 μL体系进行,反应组分分别为2×One step RT-PCR buffer 12.5 μL,上、下游引物(CAF、R,10 μmol/L)及探针CAP(10 μmol/L)各1 μL,50×Detection Enhancer 0.5 μL,25× Enzyme Mix 1 μL,模板RNA 4 μL,用无核酸酶的PCR级无离子水补足至25 μL总体积,混匀,短暂离心后上机。反应条件为95℃ 2 min,95℃ 15 s、54℃ 30 s运行40个循环。(3)狂犬病病毒检测方法按照25 μL体系进行,反应组分分别为2×One step RT-PCR buffer 12.5 μL,25×PrimeScript 1 one step Enzyme Mix 1 μL,上、下游引物(Rabiesvirus-750-M1、M2,10 μmol/L)各1 μL,模板RNA 4 μL,用无核酸酶的PCR级无离子水补足至25 μL总体积,混匀,短暂离心后上机。反应条件为50℃ 30 min,72℃ 5 min,94℃ 40 s、59℃ 60 s、72℃ 60 s运行30个循环,72℃ 5min。以上PCR产物经琼脂糖凝胶电泳分析,对目的条带切胶回收、纯化,送昆明硕擎生物科技有限公司进行测序,所得序列登录NCBI GenBank进行比对分析。
1.9 病毒的分离培养取1.6中保存的样品上清液在无菌条件下经0.2 μm针头式滤头过滤除菌后,接种于25 cm2大小的BHK-21传代细胞单层培养瓶,同时设立正常细胞对照,37℃孵育90 min后,移除吸附液,换为含2%胎牛血清(FBS)的1×MEM,37℃培养5~7 d,期间每天观察细胞单层是否出现CPE。不管是否出现CPE,37℃培养7 d后收获细胞培养物,反复冻融3次后4 500×g离心15 min,取上清继续盲传5代以上。
1.10 病毒半数组织培养感染量(TCID50)的测定将上述细胞培养物反复冻融2~3次,低速离心取上清液,用无菌的MEM将病毒进行十倍倍比稀释,从10-1到10-10,将稀释好的病毒分别接种到已经长满BHK-21单层细胞的96孔板上,每个稀释度接种8孔,每孔100 μL,剩余的正常BHK-21细胞孔作为阴性对照,每孔加100 μL维持液,放置于37℃、5%CO2恒温箱中吸附1.5 h,每孔再加入100 μL 维持液,用胶带将96孔板封好,放置于37℃、5%CO2恒温箱中继续培养,每日观察细胞病变情况,一般要观察4~6 d,观察并记录细胞出现CPE的孔数。按照Kärber法的计算方法计算病毒液的TCID50。
1.11 山羊源伪狂犬分离毒株易感动物致病性试验将传代的第5代细胞培养物上清接种试验组健康家兔4只,腹侧皮下注射,每只0.5 mL。另外对照组2只家兔仅注射0.5 mL的生理盐水,2组家兔分别隔离饲养,每日观察临床发病表现并记录死亡情况。
购买昆明小鼠10只,其中试验组7只昆明小鼠接种传代的第5代细胞培养物上清,大腿外侧肌肉每只注射0.1 mL。对照组3只仅接种同等剂量的生理盐水,2组昆明小鼠分别隔离饲养,每日观察临床发病表现并记录死亡情况。
1.12 山羊源伪狂犬病病毒分离毒株本动物回归试验将传代的第5代细胞培养物低速离心取上清,肌肉注射试验组2只山羊(1 mL/只)。另外对照组的1只山羊肌肉注射同剂量的生理盐水。2组山羊分开隔离饲养,每日观察山羊的临床表现及死亡情况,死亡后解剖观察病变及取脑及内脏组织做PCR检测。
1.13 山羊源伪狂犬病病毒分离株gE、gC及TK基因序列分析以提取的山羊源伪狂犬病病毒株基因组DNA为模板,采用云南省热带亚热带动物病毒病重点实验室设计的gE、gC及TK基因特异引物,对gE、gC及TK全基因组进行扩增(反应体系见表2),反应条件为:①PRV gE全基因组的扩增程序:95℃ 5 min,95℃ 1 min、62℃ 1 min、72℃ 2 min(35次循环),72℃ 10 min;②PRVgC全基因组的扩增程序:98℃ 5 min,98℃ 55 s、59℃ 55 s、72℃ 2 min(35次循环),72℃ 10 min;③PRVTK全基因组的扩增程序:98℃ 5 min,98℃ 40 s、59℃ 40 s、72℃ 80 s(35次循环),72℃ 7 min。将扩增的PCR产物进行克隆构建质粒,并送昆明硕擎生物科技有限公司进行测序,利用DNAStar分析软件对测得的序列进行人工拼接、校对,并与云南猪源伪狂犬病病毒的流行毒株及NCBI GenBank中的参考堵住进行序列比对分析。

表2 伪狂犬病病毒gE、gC及TK全基因组PCR体系
1.14 伪狂犬病病毒gE、gB抗体检测采集16份与山羊同群饲养的育肥猪的血清样品,应用美国IDEXX伪狂犬病病毒gE、gB抗体检测试剂盒检测其感染伪狂犬病病毒野毒及免疫抗体情况,操作方法按试剂盒说明书进行。ELISA板显色、终止后,选用650 nm 单波长读取D值,同样按照试剂盒说明书上的计算方法及判定标准进行结果判定。
2 结果
2.1 狂犬病病毒、伪狂犬病病毒及山羊关节炎/脑炎病病毒PCR检测结果送检病死山羊内脏组织样品经狂犬病病毒RT-PCR及山羊关节炎/脑炎病毒real-time PCR检测,结果均为阴性,伪狂犬病病毒PCR检测成功扩增出810 bp预期大小的PRVgE(US8)基因目的条带(图1)。经测序及序列分析后确定为伪狂犬病病毒,测出的PRVgE(US8)基因序列与NCBI GenBank中的伪狂犬病病毒(猪疱疹病毒1型)参考毒株序列对比分析结果显示,与2014年的Qihe547(KU056477)株、2013年的HLJ8(KT824771)株、2012年的HNX(KM189912)及HeN1(KP098534)株等多株参考毒株的gE(US8)基因核苷酸序列同源性均达99%。
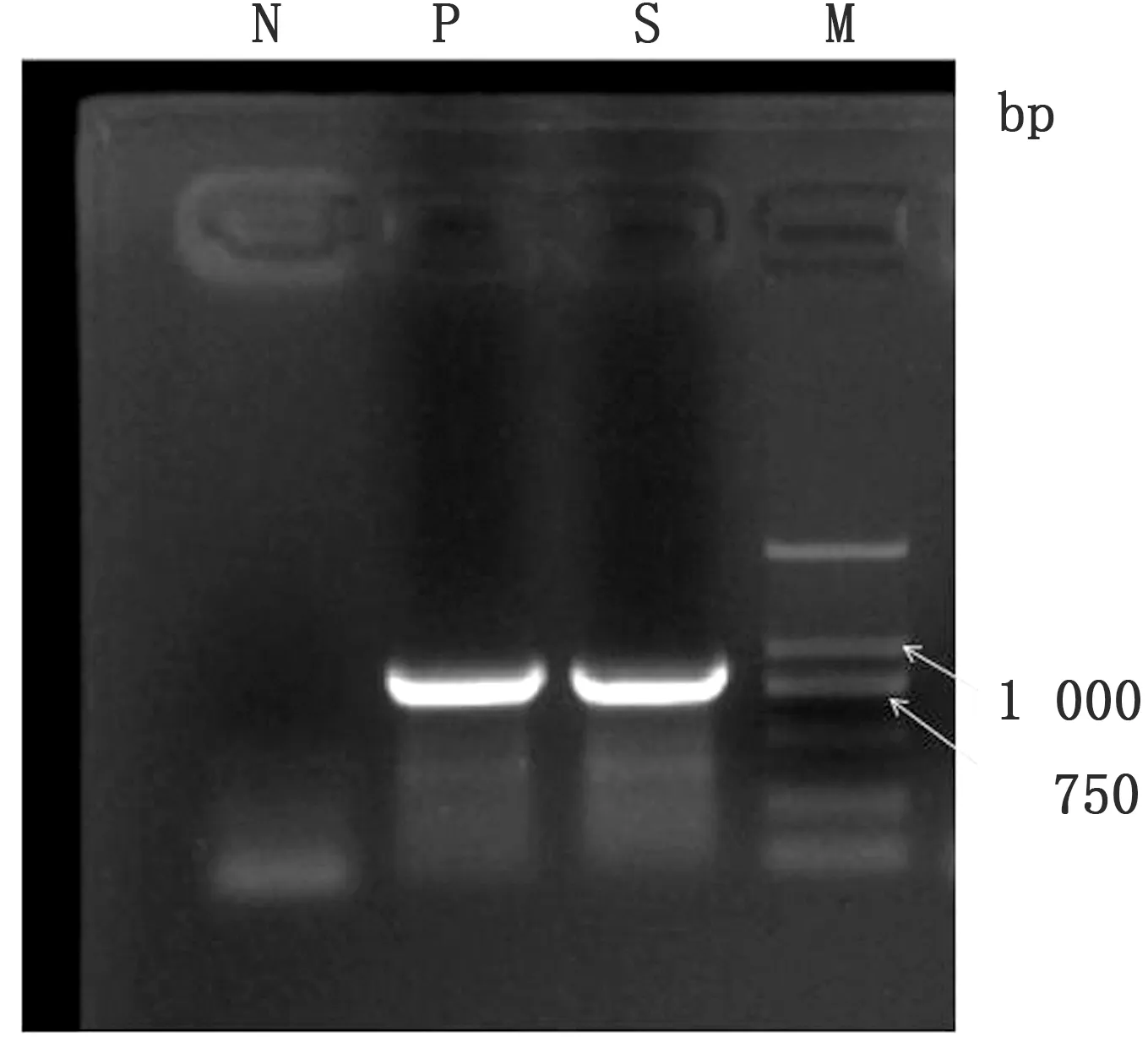
图1 伪狂犬病病毒野毒PCR扩增结果 S.病死山羊组织样品;M.DL2000 DNA Marker;P.阳性对照;N.阴性对照
2.2 病毒分离培养结果病料接种BHK-21细胞第1代培养2 d后,细胞单层局部即出现细胞病变(CPE),传代至第2代以后,细胞病变(CPE)越发明显且变得具有规律性,CPE出现提早到接种后14 h,CPE具体表现为细胞皱缩、变圆并融合为巨细胞,随着培养时间的推移,融合的巨细胞最后破碎、崩解、脱落(图2)。
2.3 病毒TCID50测定结果lgTCID50=L-d(s-0.5)其中,L表示最高稀释度的对数;d表示稀释对数之间的差;s表示阳性孔比率总和。lgTCID50=-1-1(6.875-0.5)=-7.375,TCID50=10-7.375/100 μL(表3)。
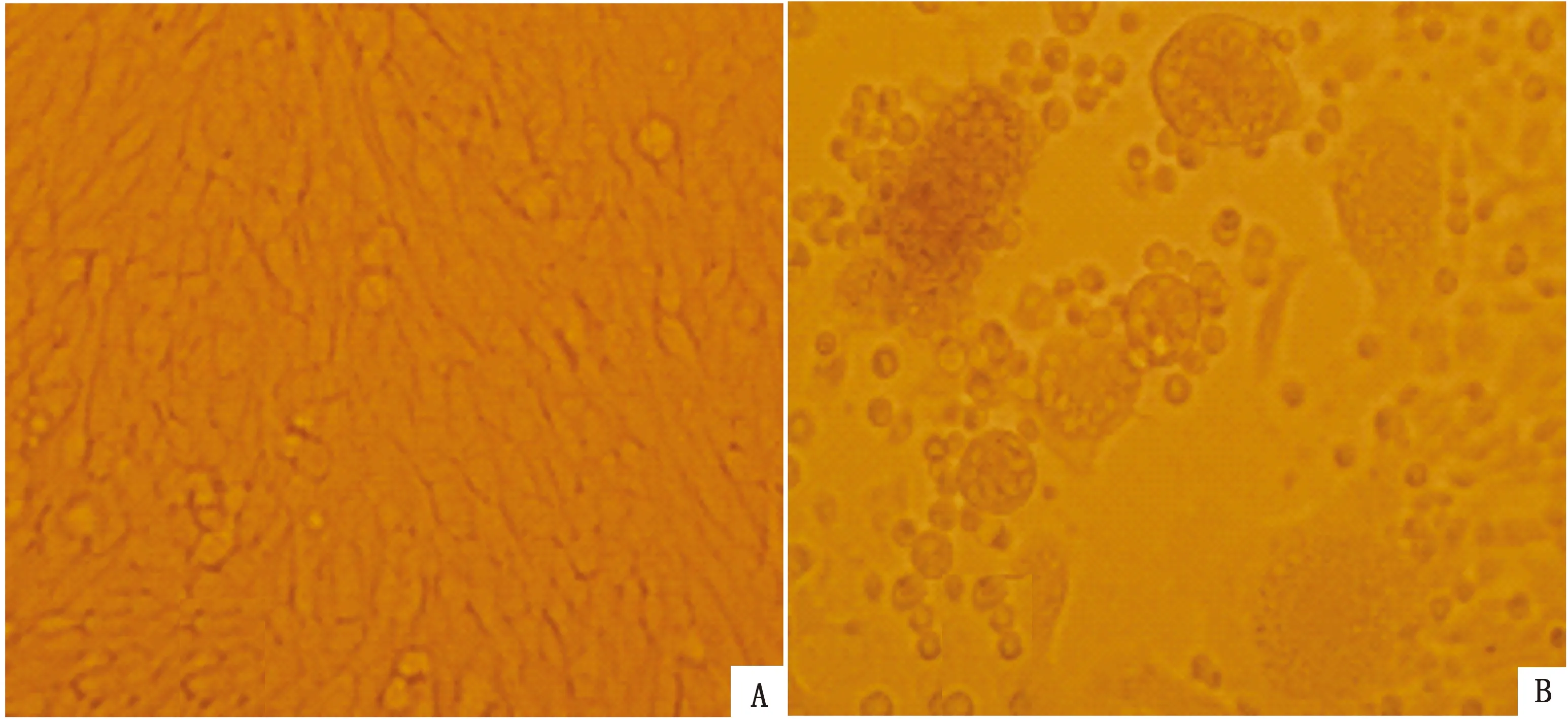
图2 病毒分离培养结果 A.正常细胞对照(更换维持液后2 d) B.病料样品接种BHK-21后出现的CPE (接种后2 d)
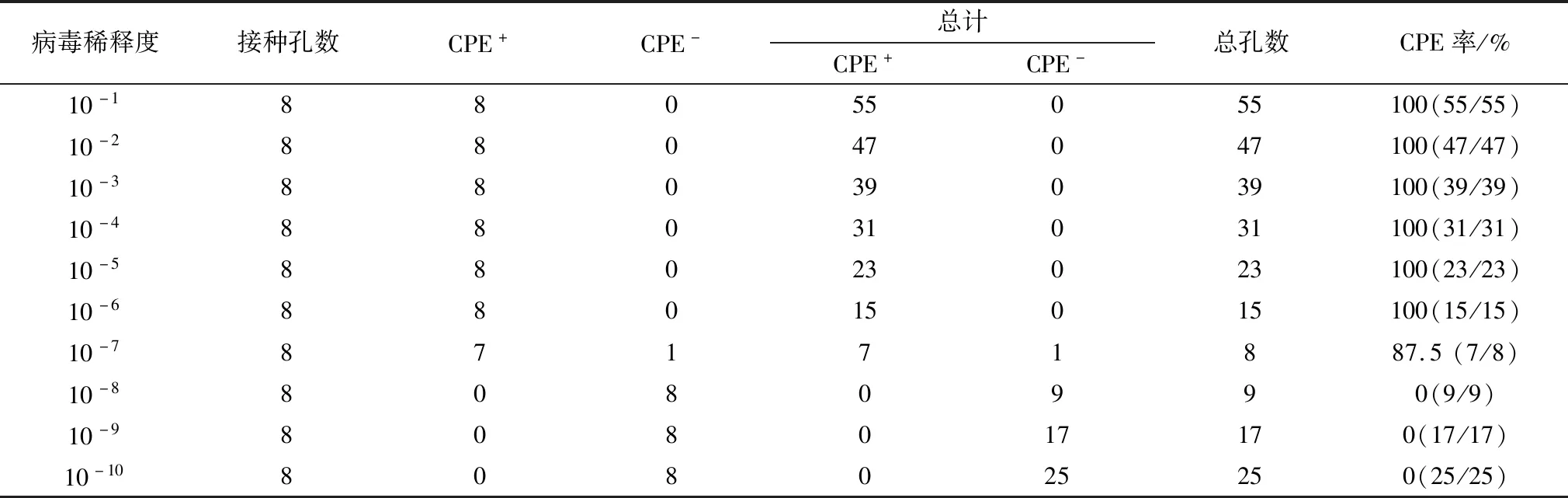
表3 分离病毒毒株TCID50测定结果
注:CPE+表示出现细胞病变,CPE-表示没有出现细胞病变
2.4 易感动物接种结果接种病毒液的家兔于接种2 d后开始发病,主要表现为烦躁不安,食欲减退。3 d左右出现典型的伪狂犬病奇痒症状,不停的抓咬注射部位,致使注射部位被毛脱落,皮肤潮红、出血,有红色肌肉暴露。4~5 d出现四肢麻痹,身体不时抽搐,有较明显的神经症状,最后全部死亡,而注射生理盐水的对照组无任何临床症状(图3)。
昆明小鼠接种病毒液1~2 d后,出现聚堆,饮食欲减退的临床表现。3 d后出现典型的伪狂犬病奇痒症状,小鼠不停的啃咬注射部位,致使接种部位被毛脱落、肿胀、出血,甚至皮肤及肌肉组织被啃咬掉。第4天试验组小鼠全部死亡,而对照组无任何临床症状(图4)。
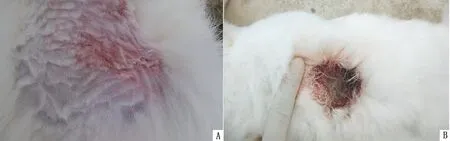
图3 山羊源伪狂犬野毒JC株攻击死亡的家兔尸体 A.接种部位被毛被啃食脱落、皮肤出血;B.接种部位被毛被啃食,裸露出肌肉组织
2.5 本动物回归试验结果试验组2只山羊接种病毒液2 d后,出现41℃以上发热,精神萎顿,饮食欲废绝,3 d后并伴随有共济失调、角弓反张等典型神经症状(图5A,B,C),并伴发腹泻。4~5 d内试验组2只山羊均死亡(图5D),病理解剖可见肺脏、淋巴结肿大,出血,脑膜水肿、出血。对照组山羊无任何临床症状,病理解剖内脏器官未见异常。
2.6 病毒PCR鉴定结果及序列分析伪狂犬病病毒山羊源毒株JC株与猪源毒株FY、LL、XD及XSBN株gE基因序列比对结果提示,山羊源JC毒株gE基因序列仅在290位置处有1个碱基C的插入,在1 469~1 471位置处有3个碱基GAC的缺失(图6)。基于gE基因序列构建的进化树也显示,山羊源毒株JC株与猪源毒株FY、LL、XD株同处于一个进化分支(图7)。

图4 昆明小鼠攻毒试验结果

图5 本动物回归试验结果 A~C.回归试验山羊发病后出现的神经症状;D.发病死亡山羊尸体
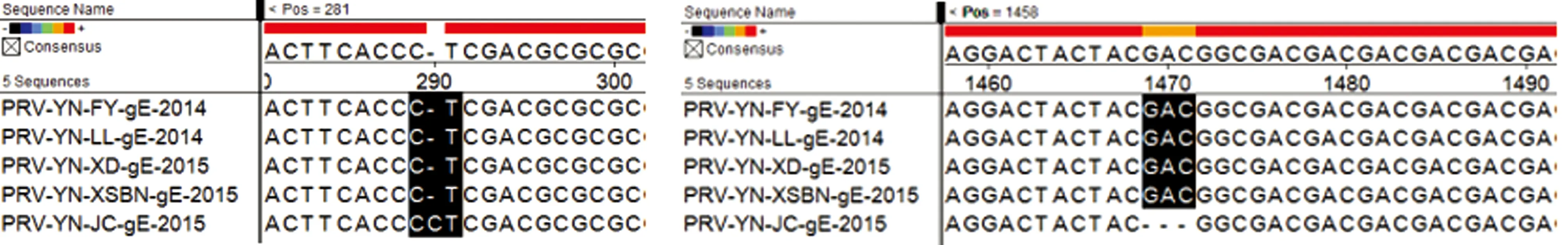
图6 JC株与猪源毒株FY、LL、XD及XSBN株gE基因序列比对结果

图7 基于gE基因序列构建的进化树
伪狂犬病病毒山羊源JC毒株与猪源毒株30938、LL、XD及XSBN株gC基因序列比对结果提示,山羊源毒株gC基因序列仅在58位置处有1个碱基的变异(G→A),其余碱基序列完全相同(图8)。

图8 JC株与猪源毒株30938、FY、LL、XD及XSBN株gC基因序列比对结果
伪狂犬病病毒山羊源毒株JC株与猪源毒株30938、LL、XD及XSBN株TK基因序列比对结果提示,其序列完全相同,同处于一个进化树分支(图9)。

图9 基于TK基因序列构建的进化树
2.7 伪狂犬病病毒gE、gB抗体检测结果16份猪血清样品伪狂犬病病毒gE、gB抗体检测结果均为阳性,检测结果提示猪群曾经受到伪狂犬病病毒野毒感染或者仍然为带毒猪群。
3 讨论
伪狂犬病病毒感染范围广,致病性强,可致多种家畜和野生动物感染,猪是伪狂犬病病毒的自然宿主,一旦感染可终身带毒,并不断向周边环境排放病毒[1,5]。1948年,我国最早从患猫体内检测出伪狂犬病病毒,在20世纪60年代该病呈地方性流行,20世纪70年代疫情呈蔓延趋势,我国政府从匈牙利引入Bartha-K61疫苗株,有效遏制了伪狂犬病疫情。20世纪70年代至2011年间,我国主要依赖gI/gE双基因缺失弱毒活疫苗Bartha-K61株对伪狂犬病进行有效防制,但2011年以来,不断有Bartha-K61株免疫猪群暴发伪狂犬病疫情的报道,最早从华北地区开始,随后从北到南,迅速席卷全国。流行毒株分离鉴定、病原学及血清学研究表明,该病出现了毒力较强的变异毒株的流行[6-10]。目前,我国伪狂犬病病毒存在2个基因型,Ⅰ和Ⅱ型,引起临床发病的主要是Ⅱ型,而市场提供的主流疫苗产品Bartha-K61株主要对基因Ⅰ型具有理想的保护率。随着伪狂犬变异毒株的出现及流行,我国市场上不断有新的伪狂犬病疫苗产品推出,诸如灭活疫苗鄂A、闽A及C株,gE/gI/TK三基因缺失弱毒活疫苗SA215株。我国市场除了以上疫苗产品外,还有TK/gG双基因缺失HB-98株,TK/gG/gE三基因缺失HB2000株。
当前,我国对该病的防控措施及策略主要还是依赖疫苗免疫和净化。疫苗种类主要有灭活疫苗、自然缺失弱毒活疫苗、基因工程缺失弱毒活疫苗,无论使用灭活疫苗还是基因缺失疫苗,都能够对猪群疫苗免疫及野毒感染进行鉴别,使得伪狂犬病的净化成为可能。《国家中长期动物疫病防治规划(2012-2020)》提出,伪狂犬病是种猪场重点净化的疫病,规划要求到2020年全国所有种猪场达到净化标准。因此,具有条件的种猪场可实施该病的净化。
由于伪狂犬病对生猪养殖危害较大,因此,在我国无论是规模化猪场还是生猪养猪散户,均对伪狂犬病疫苗的免疫接种工作比较重视,免疫覆盖率均较高,但对其他种类家畜譬如山羊、绵羊、牛、马、兔等极少进行免疫。在广大农村,由于饲养场所及圈舍空间的限制,往往把不同种类的家畜混群饲养或者关在同一圈舍饲养,这样往往就极易造成带毒免疫猪群排毒感染其他种类家畜暴发伪狂犬疫情,造成重大的经济损失。本试验中的伪狂犬病典型疫情案例显示,由于养殖户饲养场所的限制,将黑山羊与育肥猪群混群饲养,最终导致伪狂犬病带毒免疫猪群(gE及gB抗体均为阳性)通过接触或粪尿及呼吸道气溶胶等排放野毒感染未免疫伪狂犬病疫苗的黑山羊群而发病。从死于典型伪狂犬病剧烈瘙痒病症的山羊内脏组织分离出的伪狂犬病病毒野毒株基因序列分析结果也显示,该山羊源JC株与云南省近年来流行的猪源伪狂犬病病毒毒株的同源性均非常接近,仅仅存在少数几个碱基的变异,从而进一步证实了引起此次山羊伪狂犬病疫情的毒株来源于同群饲养的猪。该山羊源毒株JC的毒力强大,其在BHK-21传代细胞上的TCID50达到了10-7.375/100 μL,并且在体外能够稳定增殖。用BHK-21细胞培养液接种家兔和昆明小白鼠均能引起典型的伪狂犬病症状。

