塞尼卡病毒VP1与VP3蛋白原核表达及蛋白纯化
张金勇,张 赫,孙文超,肖朋朋,南福龙,4,韩继成,解长占,哈 卓,庄忻雨,许 汪,鲁会军*,金宁一*
(1.吉林农业大学 动物科技学院,吉林 长春 130118;2.军事科学院 军事兽医研究所,吉林 长春 130122;3.温州大学 病毒学研究所,浙江 温州 325035;4.吉林大学 动物医学学院,吉林 长春 130062)
塞尼卡病毒(Seneca Valley virus,SVV)也被称为A型塞内卡病毒(Senecavirus A,SVA),该病毒最早由美国的研究人员从污染的人胚胎视网膜细胞(PER.C6)中分离出来,命名SVV-001[1]。SVV可作为一种溶瘤候选药物进行研发,SVV-001治疗小细胞肺癌(small-cell lung cancer,SCLC)已经完成了临床Ⅰ期研究[2]。
2007年,加拿大首次报道猪感染SVV,随后在美国部分猪场检测到SVV[3]。近年来,SVV在美国、巴西、加拿大、泰国、哥伦比亚、越南等国家小范围流行[4-8];我国于2015年在广东省某猪场首次确诊猪群感染SVV,并分离CH-01-2015病毒毒株[9-10],随后陆续在湖北、黑龙江、福建、河南、甘肃等省份检测并分离出SVV病毒毒株[7,11];研究人员对我国2016-2018年的部分省份进行回顾性研究发现,辽宁、山东、云南、湖南、新疆、湖北、广西、四川、贵州、上海等多个省份均出现猪群感染SVV[7]。塞尼卡病毒病临床症状与猪口蹄疫、猪水疱病、猪水疱疹病以及水疱性口炎临床症状极为相似;急性主要表现为鼻镜、口腔、舌、蹄冠部等部位出现皮肤或者黏膜出现水疱,轻者表现为发热、嗜睡、厌食等临床症状,临床症状可持续2~14 d[12-14];此外,5日龄以内新生仔猪对该病毒较为敏感,病死率可达70%[6,15]。
SVV属于小RNA病毒科塞尼卡病毒属的唯一成员;该病毒为单股正链RNA病毒,基因组全长约7.3 kb,由5′非编码区域(untranslated region,UTR)、1个开放阅读框(open reading frame,ORF)、3′非编码区域(untranslated region,UTR)以及poly尾巴组成,构成小RNA病毒科L-4-3-4标准结构布局[1,16]。其中,SVV的开放阅读框(长度约2 180个氨基酸)在自身蛋白酶的作用下可以裂解为前导蛋白L以及P1、P2、P3。P1主要编码病毒衣壳结构蛋白,在蛋白酶的作用下进一步裂解为VP0、VP3、VP1,成熟的VP0裂解为VP2与VP4;P2与P3编码与病毒复制的相关蛋白,在蛋白酶的作用下依次裂解为2A、2B、2C、3A、3B、3C以及3D[16-17]。SVV的衣壳结构蛋白较为保守,且含有主要的抗原表位,能够与宿主细胞结合产生特异性免疫应答,其已经作为SVV诊断的主要诊断靶抗原进行研究。
本试验拟通过原核表达系统成功表达并纯化SVV VP1与VP3蛋白,为下一步单克隆抗体与多克隆抗体制备、相关ELISA检测方法以及基因工程相关疫苗等研究奠定基础。
1 材料与方法
1.1 菌种、质粒Trans1-T1、E.coliBL21 (DE3)化学感受态细胞购自北京全式金生物技术有限公司;原核表达载体pET32a(+)由本实验室保存。
1.2 主要试剂BamHⅠ、XhoⅠ限制性内切酶均购自Thermo Scientific公司; IPTG购自Sigma公司;鼠源His单克隆抗体、HRP标记的山羊抗鼠IgG抗体购自碧云天公司;DL2000 DNA Marker、T4DNA连接酶、ExTaq PCR酶均购自TaKaRa公司;Blue Plus Marker、His标签镍离子蛋白纯化柱均购于北京全式金公司;DL5000 DNA Marker购自诺唯赞生物科技有限公司。
1.3 引物设计参照SVV CH-01-2015病毒毒株序列(GenBank登陆号:KT321458.1)及本研究所需的酶切位点,设计SVV VP1与VP3引物(表1),引物由吉林省库美生物科技有限公司合成。
1.4 目的基因获取与扩增参考SVV CH-01-2015病毒毒株序列(GenBank登录号:KT321458.1),将VP1与VP3基因片段交由上海捷瑞生物工程有限公司合成。以获取的SVV cDNA为模板扩增VP1与VP3片段。PCR反应体系为25 μL体系:在PCR管中依次加入ddH2O 13.75 μL, 10×Ex Taq Buffer 2.5 μL,2.5 mmol/L dNTPs Mixture 2.5 μL、10 μmol/L上游引物、下游引物各1 μL ,模板4 μL、Ex Taq酶 0.25 μL;SVV VP1与VP3基因的扩增条件为:95℃预变性5 min;94℃变性30 s,66℃退火30 s,72℃延伸45 s,35个循环;72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳,回收目的片段备用。

表1 扩增SVV VP1与VP3所需引物
注:下划线部分为酶切位点,括号内为酶切位点名称
1.5 重组表达质粒pET32a-VP1与pET32a-VP3的构建使用BamHⅠ/XhoⅠ分别双酶切VP1片段、VP3片段以及pET32a质粒,纯化回收目的片段。分别将VP1与VP3连接至pET32a目的载体,对获得的质粒分别命名为pET32a-VP1、pET32a-VP3,并进行双酶切鉴定,鉴定正确的质粒送往吉林省库美生物科技有限公司进行测序。将鉴定正确的pET32a-VP1、pET32a-VP3转化至E.coliBL21(DE3) 感受态,挑取单克隆菌落,震荡培养12~14 h 后,保存菌液并提取质粒鉴定。
1.6 VP1与VP3重组蛋白诱导表达复苏保存的pET32a-VP1、pET32a-VP3重组菌液,37℃、200 r/min振荡培养至菌液D600为0.4~0.6时,加入IPTG进行诱导表达,收集菌液超声处理后,以10%的分离胶进行SDS-PAGE试验。
1.7 Western blot试验使用1.6蛋白样品,以10%的分离胶进行SDS-PAGE,将蛋白转移至硝酸纤维素膜,5%脱脂乳封闭2 h,鼠源His抗体孵育过夜,TBST洗涤3次,5 min/次,使用HRP标记的山羊抗小鼠二抗室温孵育40 min,TBST洗涤3次后,5 min/次,显影。
1.8 VP1与VP3重组蛋白表达形式分析复苏保存的pET32a-VP1、pET32a-VP3重组菌(参照1.6方法),加入IPTG进行诱导表达,收取菌液,经超声破碎后,5 000 r/min离心10 min,收取上清,取适量的PBS重悬沉淀,分别取上清、细菌包涵体制备样品,用10%的分离胶进行SDS-PAGE试验。
1.9 VP1与VP3重组蛋白表达条件优化
1.9.1时间条件优化 向试管中加入等量的VP1或VP3重组菌,37℃、200 r/min振荡培养至菌液D600为0.4~0.6时,加入等量的IPTG进行诱导。分别于诱导0,1,2,3,4,5,6,7,8 h取等量的菌液,制备蛋白样品,以10%分离胶进行SDS-PAGE试验,分析诱导表达的最佳时间。
1.9.2诱导剂浓度优化 向试管中加入等量的SVV VP1或VP3表达菌,37℃、200 r/min振荡培养至菌液D600为0.4~0.6时,分别加入0,0.2,0.4,0.6,0.8,1.0 mmol/L的IPTG诱导剂,诱导5 h后,收集菌液,制备蛋白样品,用10%分离胶进行SDS-PAGE试验,分析最佳诱导剂浓度。
1.9.3诱导温度优化 向试管中加入等量的VP1或VP3重组菌,振荡培养至菌液D600为0.4~0.6时,加入0.6 mmol/L的IPTG诱导剂,分别置于25,37℃诱导5 h,收集菌液,制备蛋白样品,用10%分离胶进行SDS-PAGE试验,分析最佳诱导温度。
1.10 SVV VP1与VP3蛋白纯化复苏VP1或VP3重组菌,转移至300 mL培养基中,于37℃条件下震荡培养至菌液D600为0.4~0.6时,加入0.6 mmol/L 的IPTG诱导剂,培养5 h,收集蛋白。参照说明书利用Ni2+-NTA金属螯合蛋白质纯化柱进行纯化,制备蛋白样品,用10%分离胶进行SDS-PAGE试验,分析蛋白纯化效果。
2 结果
2.1 SVV VP1与VP3基因扩增利用VP1与VP3引物分别扩增出约792,717 bp的产物,与预期大小一致(图1)。
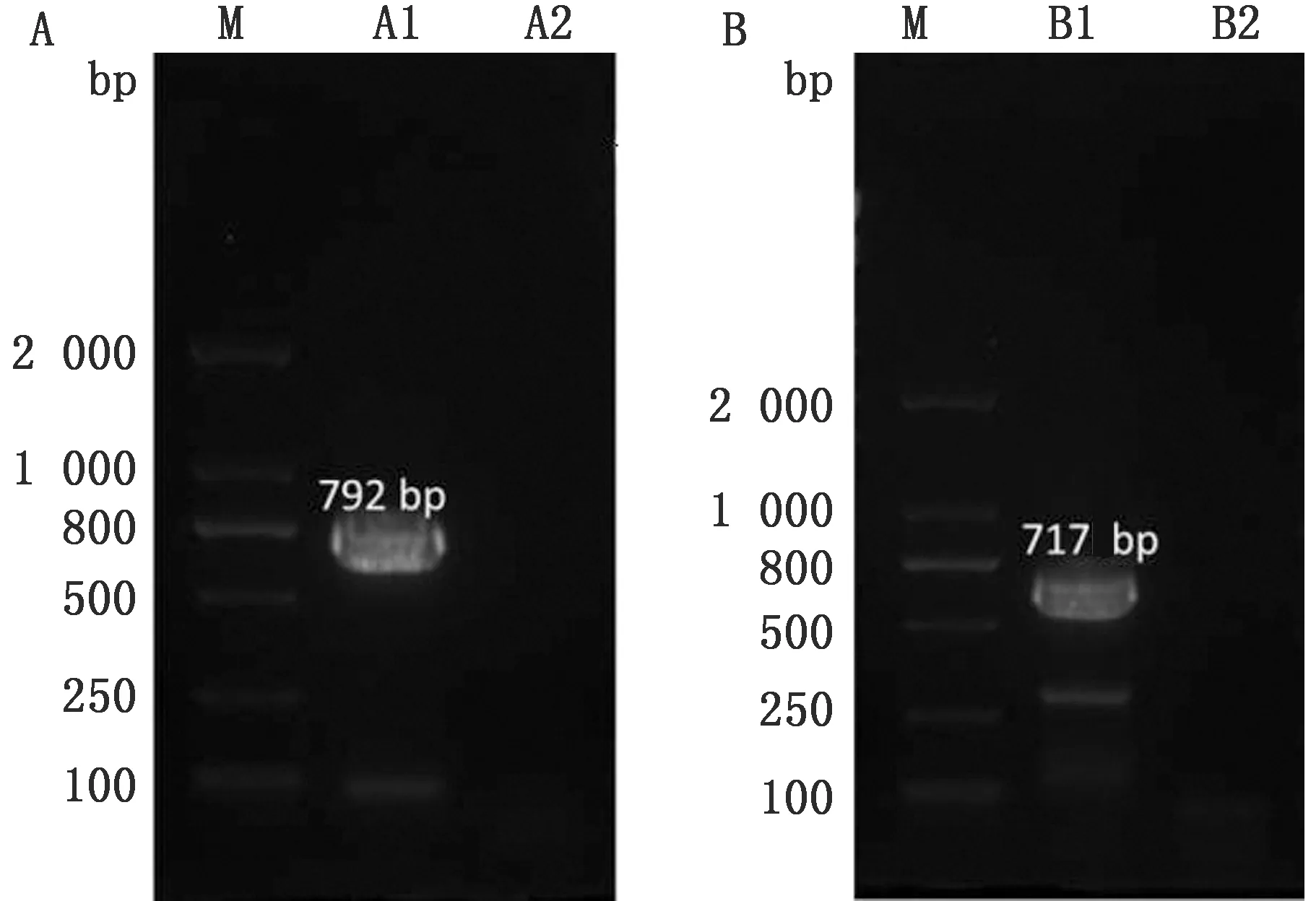
图1 SVV VP1(A)与VP3(B)基因扩增结果 M.DL2000 DNA Marker;A1:VP1 PCR产物;A2.阴性对照;B1.VP3 PCR产物;B2.阴性对照
2.2 重组表达质粒pET32a-VP1与pET32a-VP3的构建及鉴定将SVV VP1与VP3基因片段克隆至pET32a载体,获取质粒后,经BamHⅠ/XhoⅠ分别双酶切pET32a-VP1与pET32a-VP3进行鉴定,VP1与VP3基因片段成功克隆至pET32a载体(图2)。
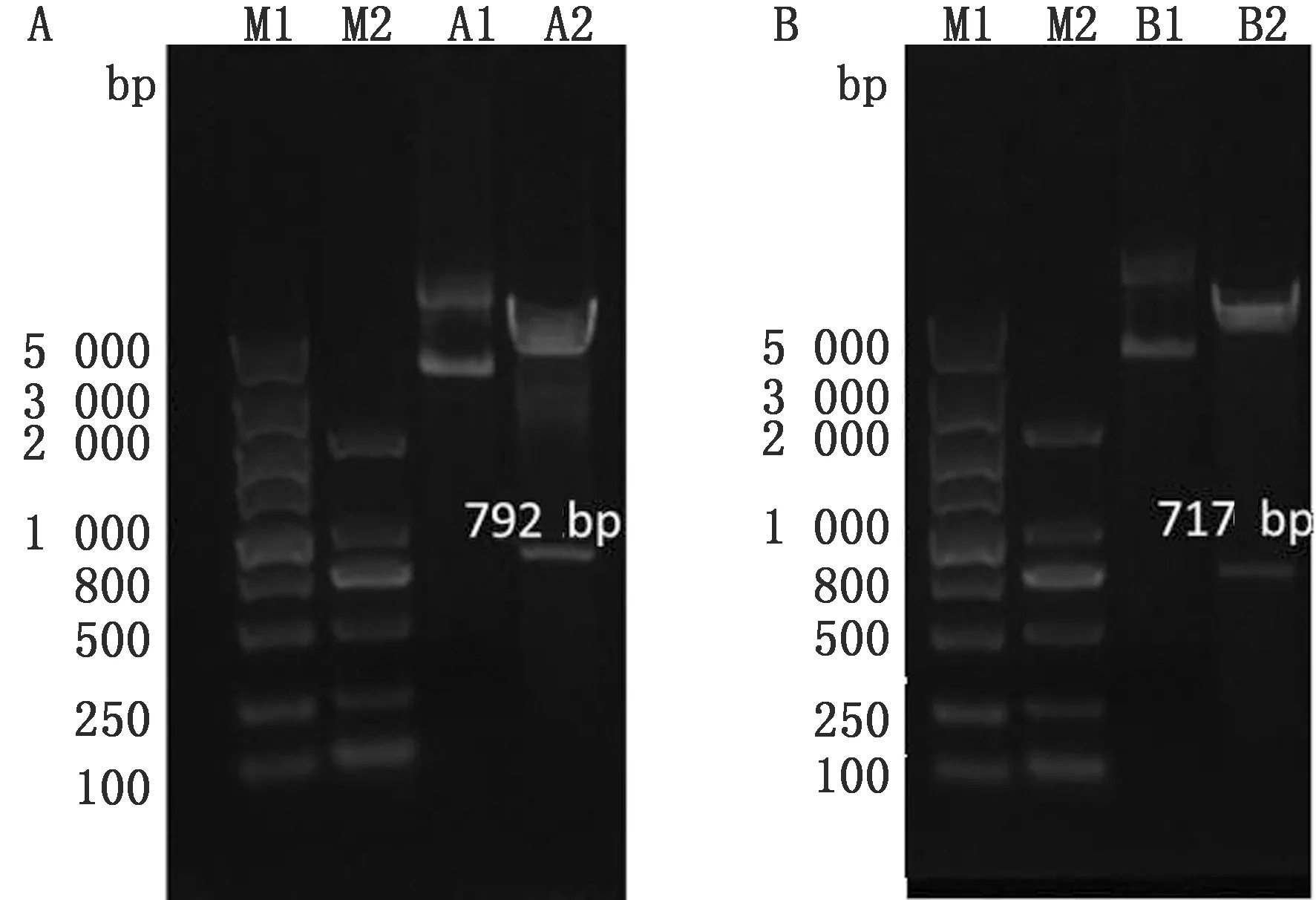
图2 重组质粒pET32a-VP1(A)与pET32a-VP3(B)酶切鉴定 M1.DL5000 DNA Marker;M2.DL2000 DNA Marker;A1.pET32a-VP1重组质粒;A2.pET32a-VP1质粒酶切产物;B1.pET32a-VP3重组质粒;B2.pET32a-VP3质粒酶切产物
2.3 VP1与VP3重组蛋白诱导表达收取诱导后的菌液,SDS-PAGE试验结果表明pET32a-VP1重组菌经诱导后在约50 000处有明显条带,pET32a-VP3重组菌经诱导后在约48 000处有明显条带(图3);Western blot试验结果表明2种重组菌均可见单一目的条带(图4)。
2.4 VP1与VP3重组蛋白表达形式分析分别收取pET32a-VP1与pET32a-VP3重组菌,分别获取破碎细菌后的上清与包涵体, SDS-PAGE结果表明,2种重组菌均以包涵体的形式表达蛋白(图5)。
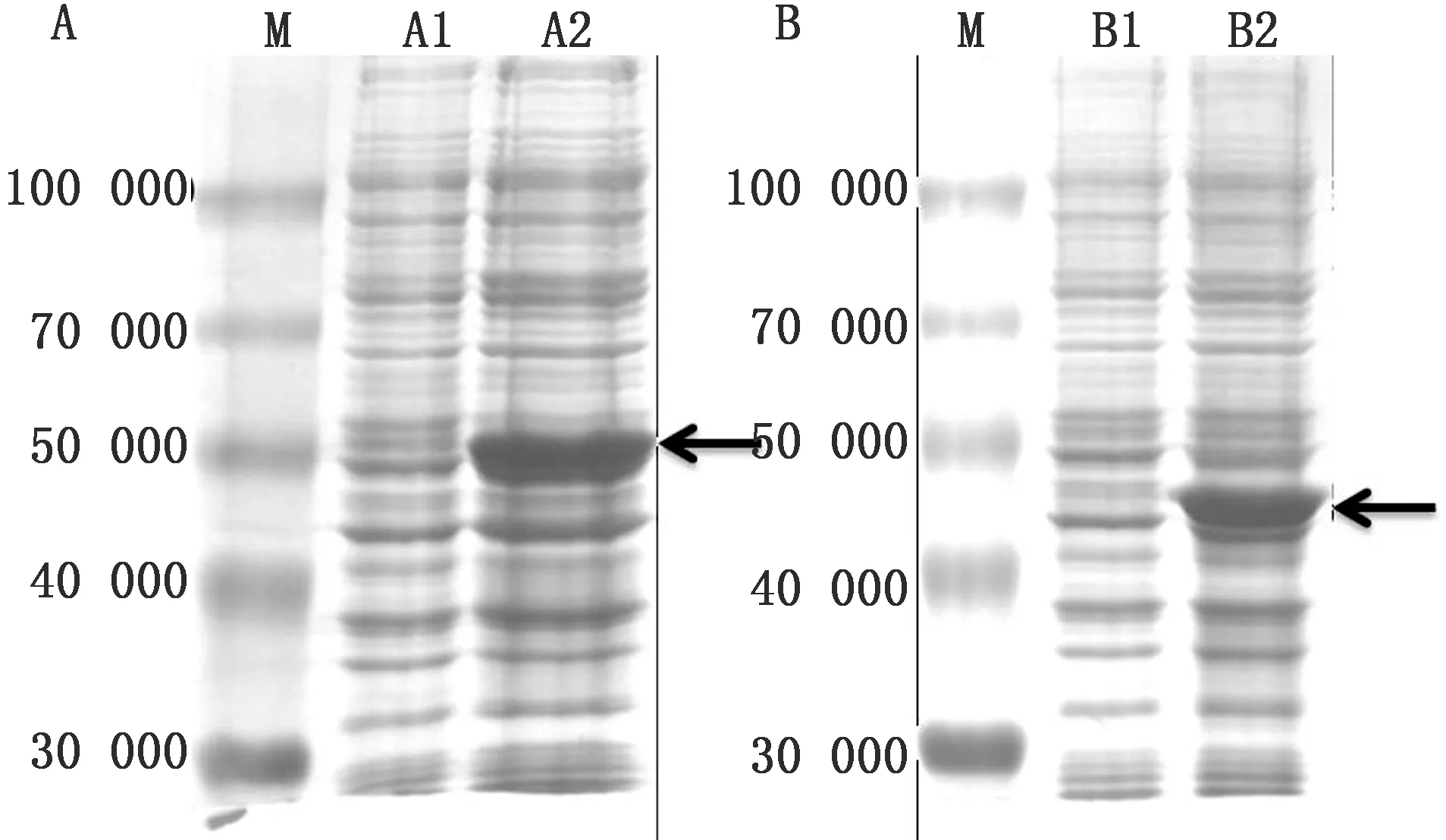
图3 SVV VP1蛋白(A)与VP3蛋白(B)表达SDS-PAGE验证 M.Blue Plus蛋白Marker;A1.pET32a空载蛋白;A2:pET32a-VP1蛋白;B1.pET32a空载蛋白;B2.pET32a-VP3蛋白
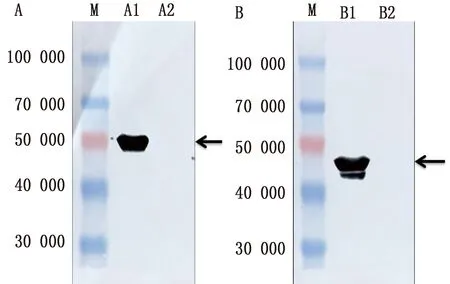
图4 SVV VP1蛋白(A)与VP3蛋白(B)表达Western blot验证结果 M.Blue Plus蛋白Marker;A1.pET32a-VP1;A2.pET32a空载体;B1.pET32a-VP3;B2.pET32a空载
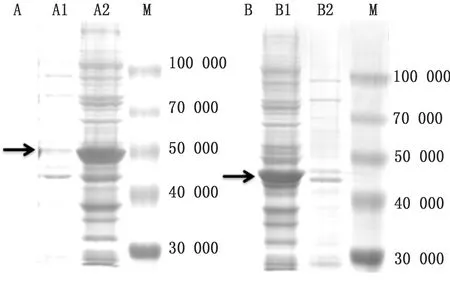
图5 SVV VP1蛋白(A)与VP3蛋白(B)表达形式验证结果 M.Blue Plus蛋白Marker;A1.pET32a-VP1重组菌上清;A2.pET32a-VP1重组菌包涵体; B1.pET32a-VP3重组菌上清;B2.pET32a-VP3重组菌包涵体
2.5 VP1与VP3重组蛋白表达条件优化
2.5.1优化诱导时间 于诱导后0、1、2、3、4、5、6、7、8 h取等量的菌液,制备蛋白样品,进行SDS-PAGE试验,结果表明:pET32a-VP1与pET32a-VP3重组菌均在诱导5 h后表达量最高(图6)。
2.5.2优化诱导剂浓度 向等量重组菌加入0,0.2,0.4,0.6,0.8,1.0 mmol/L IPTG诱导剂,SDS-PAGE试验结果表明pET32a-VP1与pET32a-VP3重组菌均在诱导剂浓度大于等于0.6 mmol/L时表达量最高(图7)。
2.5.3优化诱导温度 将重组菌分别置于25,37℃诱导5 h, SDS-PAGE试验结果表明pET32a-VP1与pET32a-VP3重组菌均在37℃表达量较高(图8)。
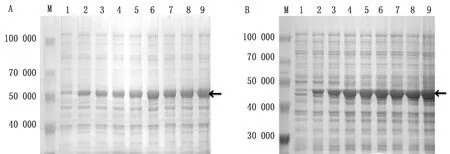
图6 SVV VP1蛋白(A)与VP3蛋白(B)诱导表达时间分析结果 M.Blue Plus蛋白Marker;A1~A9,B1~B9.诱导时间分别为0,1,2,3,4,5,6,7,8 h
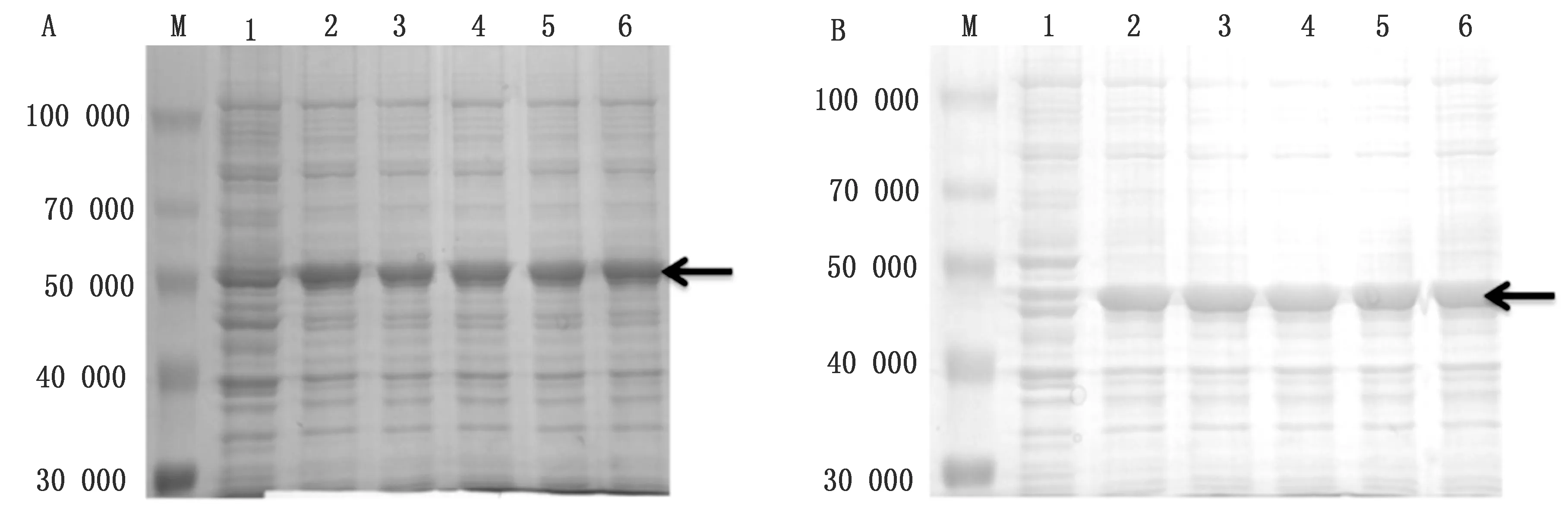
图7 SVV VP1蛋白(A)与VP3蛋白(B)诱导剂浓度分析结果 M.Blue Plus蛋白Marker;A1~A6,B1~B6.诱导浓度分别为0,0.2,0.4,0.6,0.8,1.0 mmol/L
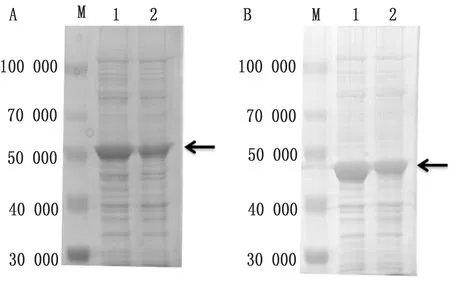
图8 SVV VP1蛋白(A)与VP3蛋白(B)诱导剂温度分析结果 M.Blue Plus蛋白Marker;A1.37℃诱导pET32a-VP1重组菌;A2.25℃诱导pET32a-VP1重组菌;B1.37℃诱导pET32a-VP3重组菌;B2.25℃诱导pET32a-VP3重组菌
2.6 VP1与VP3重组蛋白纯化大量培养pET32a-VP1与pET32a-VP1重组菌,收集蛋白样品,参照Ni2+-NTA金属螯合蛋白质纯化柱说明书对蛋白进行纯化,结果表明成功纯化VP1与VP3重组蛋白(图9)。
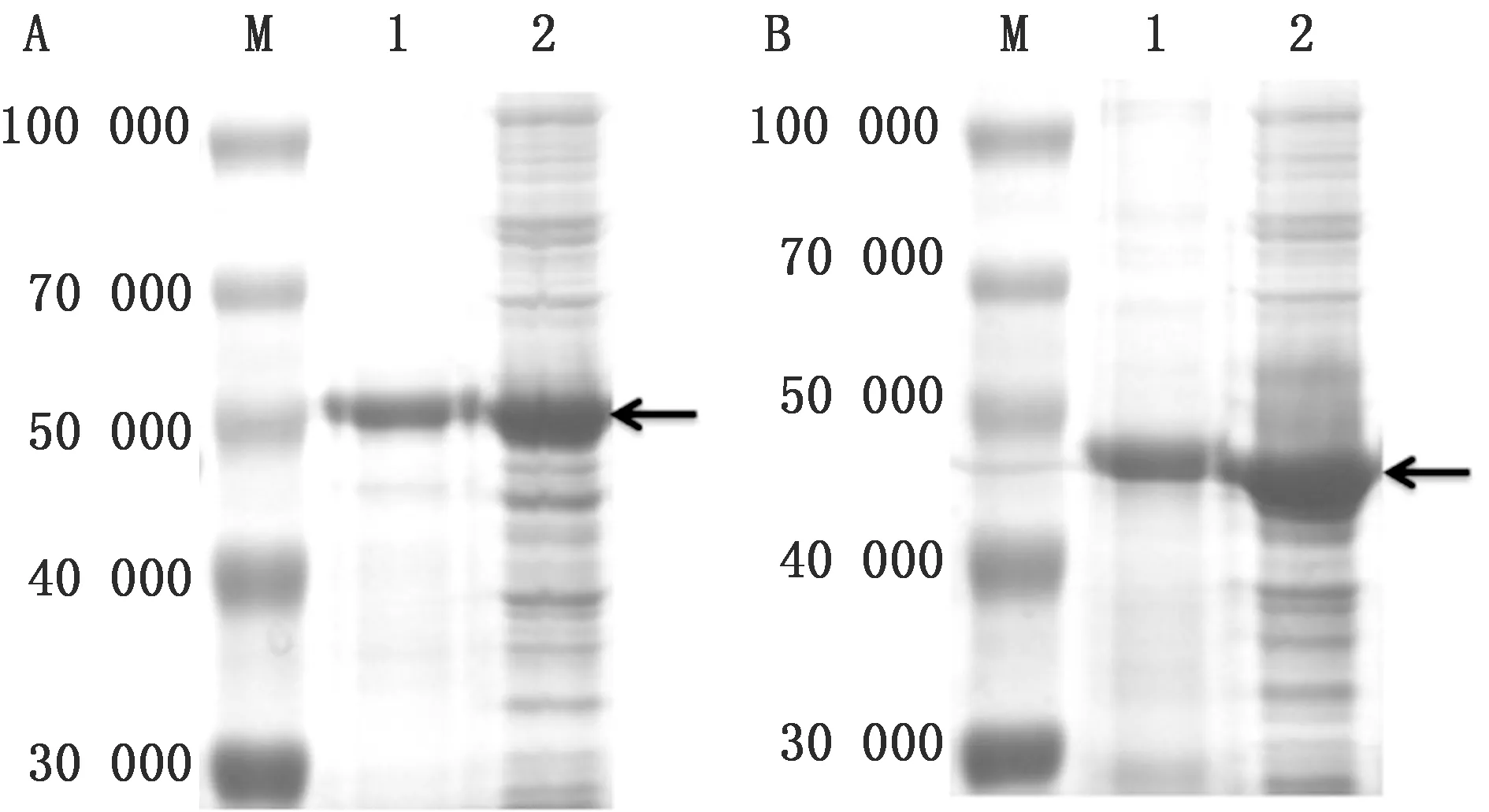
图9 SVV VP1蛋白(A)与VP3蛋白(B)蛋白纯化分析结果 M.Blue Plus蛋白Marker;A1.pET32a-VP1重组菌蛋白纯化后;A2.pET32a-VP1重组菌蛋白纯化前;B1.pET32a-VP3重组菌蛋白纯化后;B2.pET32a-VP3重组菌蛋白纯化前
3 讨论
自2007年首次于加拿大猪群分离到该病毒株以来,全球已经有多个国家相继报道SVV感染猪群的病例[7]。2015年以来,多个国家相继报道SVV流行与小范围暴发,作为一种新发传染病,已经造成了巨大的经济损失。研究表明,SVV在感染的猪群中可存在7~21 d,临床症状持续12~14 d,病毒血症持续1~10 d[18]。SVV与其他猪原发性水疱病症状基本类似,临床上很难诊断。截止目前为止,尚未见研究证实SVV存活的环境以及其传播方式的报道;然而,研究人员在小鼠肠道以及粪便中、家蝇中均检测到SVV,表明这些物种可能会携带病原进行传播[19]。我国自2015年首次发现并分离SVV毒株以来,已经有多个省份报道检测到SVV;研究人员对2016-2018年的部分省份样品进行回顾性检测,发现我国的部分省份早在2016年即已经存在SVV感染猪群[7]。
研究人员使用pET24b系统表达SVV VP1、VP2、VP3蛋白,并建立间接ELISA方法,研究显示使用VP2蛋白包被建立的ELISA方法优于VP1与VP3蛋白包被建立的ELISA方法[20]。SVV VP1、VP3蛋白含有多个抗原表位,是新型疫苗研发的首选蛋白区域[21],尚未见研究利用SVV VP1、VP3表达的蛋白建立中和等检测方法的报道。本试验将SVV VP1与VP3的基因片段克隆至pET32a(+)载体,利用大肠杆菌表达系统对SVV VP1与VP3区域蛋白进行表达,结果显示分别以包涵体的形式表达出约50 000,48 000的重组蛋白;并对两者的表达条件进行优化。利用Ni2+-NTA金属螯合蛋白质纯化柱对原核表达系统表达的SVV VP1与VP3蛋白进行纯化,成功纯化出SVV VP1与VP3蛋白。SVV VP1与VP3蛋白的表达与纯化,为下一步研究SVV单克隆及多克隆抗体的制备、新型疫苗研发及血清学检测方法等奠定基础。

