一把“剪刀”就能灭整个物种?
楚云汐

疟疾是由携带疟原虫的蚊子叮咬而引起的一种疾病,是当今人类的最大杀手之一。为将疟疾病人从痛苦中拯救出来,科学家与之死磕了数十载。我国科学家屠呦呦研制出的青蒿素就是一种非常有效的疟疾治疗药物。
不过,虽然科学家采用药物疗法已取得了一定成绩,使得疟疾的死亡率大幅降低,但是,这些方法却不能完全消灭疟疾。在一些地区,疟疾依然十分猖獗。据世界卫生组织统计,在撒哈拉沙漠以南的非洲贫困地区,每年都有将近2亿人染上这种疾病,数十万人因此丧命,且70%以上都是未满5岁的幼童。
消灭疟疾,让其从地球上彻底消失成了一些科學家追求的终极目标。
CRISPR剪刀修剪蚊子
由于撒哈拉地区疟疾的主要传播媒介是冈比亚按蚊,一些生物学家打起了改造蚊子的主意,致力于培育不会传播疟疾的蚊子。他们想用这种方法切断疟疾传播的途径,从而终止疟疾的发生。
这个主意听起来不错,但要实现谈何容易?
让蚊子不携带疟疾是非常困难的。所以,科学家需要从奇妙的生物体自身来寻找灵感。
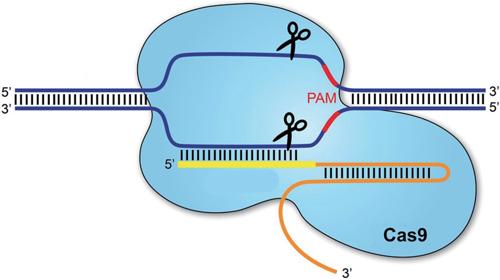
在遗传学的发展中,科学家发现了一些“自私的基因”。这种基因会用尽一切手段,想方设法在生物体中保存下来,存在于细菌中的一种叫CRISPR/Cas9-gRNA的基因组就是一种“自私的基因”。
CRISPR像一把剪刀,能够在一个RNA分子的指示下,对任何目标基因组进行修剪。利用它,科学家可以剪下一段基因,再换上一段新的,甚至可以对基因中的单个碱基进行编辑。比如,可以利用CRISPR减掉蚊子基因中的一段,然后再换上抗疟的基因这样的外源基因,这样就把一只普通蚊子转变成了一只新型的抗疟蚊子。
2012年,这种CRISPR的基因修改工具进入了人们的视野。研究者发现,可以将CRISPR用作一种快速、精准、简单地修改基因的工具。而且,与其他基因编辑技术相比,CRISPR能使基因组更有效地发生变化。这个工具几乎适用于所有物种。
多亏了CRISPR,生物学家终于有了几只不带疟疾的转基因蚊子。可别高兴得太早,仅仅几只而已。将野外成千上万的携带疟疾的蚊子全部变成这种健康的转基因蚊子,才算是解决问题。那么,该如何做呢?
起初,生物学家想顺其自然。简单地说,就是在自然环境中,释放一群不带疟疾的转基因蚊子,然后不去干预,被动地等待转基因蚊子自我繁殖,使野外蚊群全部转化为新型蚊种。

冈比亚按蚊

基因驱动
可是,要达到全部转化为新型蚊种的效果,几只不带疟疾的转基因蚊子很难做到。因为它们的后代还是有不带转基因蚊子,要真正产生效果,至少需要释放10倍数量的转基因蚊子。也就是说,如果一座小镇上有1万只携带疟疾的蚊子,那么,要将当地的蚊子全部改变成不携带疟疾的蚊子的话,生物学家至少需要再向小镇释放10万只转基因蚊子。这个数量太惊人了,即使能达到预期效果,小镇上多了10多倍的蚊子,随之而来的恐怖的蚊虫叮咬问题,想必小镇居民也一定不会同意。
既然顺其自然的方法行不通,那就得另辟蹊径了。
更强大的基因驱动
2016年,美国哈佛大学的一名叫做凯文·恩斯福尔特的生物学家在使用CRISPR工具进行基因编辑时突发奇想,想试试如果将CRISPR加入到转基因蚊子的基因中,即让转基因蚊子的基因带有CRISPR这把剪刀,让其继续遗传下去会产生什么结果。
我们知道,按照生物学基本定律孟德尔遗传学,当雌雄两体进行交配时,其后代会继承父母各自一半的基因。也就是说,当一只基因是aa的白眼蚊子与另一只基因是aB(B为抗疟基因)的红眼蚊子亲密接触时,它们的后代将有以下几种基因组合类型:aa、aB、aa和Ba。
如果像凯文·恩斯福尔特想的那样,B上不仅有抗疟基因,还有剪刀CRISPR,那么,由于CRISPR的对位剪切作用,无论是aB,还是Ba最终都会变成BB。这意味着,具有剪切基因能力的转基因B的后代全部被剪成了有抗疟基因并携带剪刀的蚊子,而不带剪刀的转基因蚊子的后代是一半对一半。这样一代代遗传下去,转基因B最终将替换掉全部a基因,占据绝对的主导地位。一句话,在转基因上加上CRISPR,我们就获得了永久的基因修改工具,转基因终有一天会主导整个物种。
当美国生物学家安东尼·詹姆斯将2只带CRISPR的抗疟基因的红眼蚊子放进一个装有30只白眼蚊子的试验盒中,让它们自由繁殖两代时,3800只蚊子后代全部变成了红眼!传播速率难以置信的快,这正是此装置的精妙绝伦之处。
由于恩斯福尔特创造的CRISPR基因装置驱动了性状的快速传播,这种基因处理方法被称为“基因驱动”。它打破了孟德尔的遗传定律,将不可能变成了可能。
亦喜亦忧
基因驱动是十分强大的的基因工程技术工具,它的使用前景异常诱人。
我们可以利用基因驱动的方法来使得整个物种发生变化。只要在1%的疟蚊身上使用含有抗疟疾基因的基因驱动装置,生物学家预计在短短一年之内,所有疟蚊就能获得新的基因,然后成为无害蚊子,即疟疾在一年之内可以被根除。人类将会从这项越来越成熟的技术中获益匪浅。
另外,如果你想消灭入侵物种,比如美国五大湖中的亚洲鲤鱼,只要使用基因驱动让鱼群只繁殖雄性后代就能做到。几代之后雌性鲤鱼将不复存在,这样鲤鱼种群便会随之消失。一言不合就灭掉整个物种,理论上是可行的,可以用基因驱动的方法来灭掉对本地物种有威胁的入侵物种。
然而,基因驱动不光具备改造世界的能力,同样具有毁灭世界的能力。所以,它也有令人担忧的一面。
利用基因驱动改变的诸多新性状,传播效率非常高,会飞速地让每个个体都染上新性状,以至于不经意间逃出实验室的样本都可能在短时间内引起野外整个种群的巨大改变。
这样可能会产生严重后果,比方说一些携带只繁殖雄性后代基因驱动的亚洲鲤鱼,偶然从美国五大湖被带回了亚洲的情形,这可能会让整个亚洲鲤鱼种群灭绝。鉴于现在世界频繁而紧密的交流程度,此类情况是很有可能发生的,当初物种入侵不就是这样出现的吗?
另外,基因驱动不一定被限制在科学家所谓的靶物种上,因为相似的物种之间偶尔会彼此进行杂交。如果发生了杂交,那极有可能基因驱动会突破物种限制,使得亚洲鲤鱼影响到其他类型的鲤鱼。
更为可怕的,这种能培育含有基因驱动的有机体的技术,实施门槛特别低,世界上任何一个实验室的研究人员都能完成。本科生可以做,甚至在设备齐全的情况下,有天赋的高中生也可以做。这就相当可怕了。
魔高一尺道高一丈
有趣的是,许多科学家在看待基因驱动时都显得比较宽容,极少人视基因驱动为洪水猛兽,因为它也有自己的局限。
首先,基因驱动的方法只能用于有性生殖的物种,性状只有不停繁衍才会被广泛传播,这意味着它对繁衍周期长的物种杀伤力要小得多。换句话说,在短时间内,这种方法只会让繁殖周期比较短的物种灭绝,比如对昆虫或者类似于鼠类或者鱼类的小型脊椎动物等,而对于大象或者人类这样繁衍周期长的哺乳动物,则需要更长时间,比如数百年才会达到同样的目的。
其次,即使已经有了CRISPR,想要制造一个真正可以引发物种灭绝的遗传性状,也不是件简单的事。
如果有一天,一个恐怖分子考虑制造一种果蝇,让它们以新鲜水果而并非腐烂水果为食,打算以此摧毁某国的农业。那么,他先要搞清楚控制果蝇择食的是哪个基因,而这就已经是非常复杂的科研项目了。不仅如此,他还要用修改内部基因的方法去改变果蝇外在的习性,这将是更加复杂的研究项目,失败几率相当大,很可能倾尽所有之后,白忙一场,因为基因控制行为的机制无比复杂。与其如此麻烦,这个恐怖分子还不如直接炸毁目标来得痛快。
现在,世界上许多组织已经开始规范基因驱动的实验行为,并制定相应的约束措施。科学家在做实验时一直异常小心,并且他们开始想新的方法来降低基因驱动的危险系数,比如用一些方法让基因驱动进行自我调控,或者设定基因驱动的“自毁程序”,使其在几代之后自动消失。
虽然行动意味着危险,但是原地踏步或许更加致命,因为即使我们不变,外部环境也在渐渐变化。你說呢?
——“零疟疾从我开始”

