上皮-间质转化诱导转录因子在肺癌诊断和预后预测中的作用
复旦大学附属肿瘤医院麻醉科,复旦大学上海医学院肿瘤学系,上海 200032
肺癌是全球人群中发病率最高的肿瘤(占所有肿瘤的11.6%),其死亡率也位居各类肿瘤之首(占18.4%)[1]。目前,手术治疗仍是中早期肺癌治疗的首选方法,但仍有许多患者丧失手术机会或在术后出现复发和转移,因而早发现、早诊断、早治疗在肺癌的诊治中至关重要。对于部分无法手术或术后出现复发和转移的患者,分子靶向治疗作为新的治疗手段取得了良好的效果,正越来越受到重视。与传统化疗相比,靶向药物具有特异性强、疗效明显、不良反应较少等优点[2]。然而,靶向药物仅适用于目标基因有突变的患者,且治疗一段时间后,大多数患者对靶向药物产生耐受。这表明,肺癌复发转移的机制异常复杂,有必要进一步探索肺癌细胞的迁移和侵袭机制,以寻找更好的生物标志物,为肿瘤治疗、靶向药物的研发提供理论支持。
近年来,越来越多的研究发现,上皮-间质转化(epithelial-mesenchymal transition,EMT)介导了肿瘤的转移、复发和肿瘤耐药[3]。在EMT过程中,表皮表型的肿瘤细胞失去细胞极性和细胞间的紧密连接,转化为没有细胞极性且迁移侵袭能力较强的间质表型。此外,EMT还受到Twist家族BHLH转录因子1(Twist family BHLH transcription factor 1,Twist1)、Twist2、Snail超家族锌指转录因子(Snail family zinc finger,SNAI)1、SNAI2、锌指E盒同源结合蛋白1(zinc finger E-box binding homeobox 1,ZEB1)、ZEB2等转录因子的调控,它们常被视作EMT的生物标志物,可统称为EMT诱导转录因子(EMT-inducing transcription factor,EMT-TF)[3]。研究发现,EMT还可激活肿瘤干细胞,导致耐药[4]。因此研究EMT-TF在肺癌中的作用有助于肺癌的病理诊断与预后分析。
Twist1和Twist2是碱性的螺旋-环-螺旋蛋白(basic helix-loop-helix protein,bHLH)家族中的两个重要转录因子。在多种肿瘤中,Twist1呈现高度甲基化,且表达明显增加[5],它可通过调控EMT促进肿瘤的增殖和转移[6]。此外,Twist1还可通过诱导EMT、激活肿瘤干细胞,致使多种肿瘤对靶向药物发生耐受[7-9]。然而,与Twist1相反,Twist2对肿瘤有明显的抑制作用,它在多种肿瘤组织中,无论是mRNA水平还是蛋白水平都有明显的下降[10]。ZEB家族在激活肿瘤干细胞、调控肿瘤细胞凋亡、促进肿瘤血管生成和化疗药耐药等方面发挥着重要作用,因而有可能成为肿瘤诊断、预后分析以及治疗的靶点[11]。ZEB家族有两个重要转录因子ZEB1和ZEB2,它们主要在细胞核内发挥作用。SNAI是保守的锌指家族的转录因子之一,它对果蝇中胚层的形成至关重要[12]。SNAI在转录水平受到很多生长因子和信号分子的调节,这些因子通过结合SNAI基因的启动子区域发挥调控作用[13-14]。SNAI1能够与组蛋白去乙酰化酶HDAC1/2相互作用,通过改变染色质的局部结构,抑制E-cadherin的表达,进而调节EMT[15]。随着研究的深入,人们越来越关注EMT-TF在肿瘤转移复发中的作用,但目前有关EMT-TF与肿瘤分期、预后预测方面的研究很少,因此我们期望利用肿瘤在线数据库,筛选对肺癌诊断、分期和预后预测方面有一定价值的转录因子。
1 材料和方法
1.1 Oncomine Database分析、GEPIA和Lung Cancer Explore
Oncomine Database数据库中共有肺癌数据集74个,包括6 289个样本,我们通过Oncomine Database分析EMT TF在不同肿瘤中的表达水平,进而分析EMT TF在肺癌组织和正常组织中的表达差异(cut-off值:P=0.01,fold change of 2)。GEPIA公共在线数据库包含TCGA数据库中9 736例肿瘤标本以及GTEx数据库8 587例正常组织样本[16]。我们应用GEPIA比较了EMT-TF基因在肺癌(肺腺癌和鳞状细胞癌)和正常组织中的表达差异,同时还将分析EMT-TF mRNA表达水平与肿瘤临床病理学分期的相关性。
1.2 Kaplan-Meier Plotter
Kaplan-Meier Plotter能够检测近54 000个基因对21种肿瘤生存预后的影响[17]。我们应用Kaplan-Meier Plotter Lung Cancer数据库分析EMT TF mRNA水平对肺癌患者5年生存率的影响,例如总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)、进展后生存期(post-progression survival,PPS)。
1.3 STRING和Mentha数据库
STRING数据库收集了目前研究的蛋白质间的相互作用,我们通过多基因分析筛选了EMTTF的蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络。Mentha数据库的数据来自于依附IMEx联盟的人工管理的PPI数据库,聚集的数据为科研工作提供了一系列工具,在PPI网络的背景下分析选定的蛋白质。通过Mentha数据库,分析EMT-TF相互作用的系数以及与之作用的分子。
2 结果
2.1 EMT-TF在肺癌组织中的表达水平
应用ONcomine数据库,我们对比了多种肿瘤组织和正常组织中EMT-TF的转录水平(图1),并将肺癌有关的结果单独归纳于表1。在Hou肺癌数据库中,鳞癌、腺癌组织中Twist1 mRNA水平分别是正常组织的7.7倍和2.54倍,其差异有统计学意义(P<0.01)[18]。在包括Hou等[18]报道的数据库在内的4个肺癌数据库中,鳞癌SNAI2转录水平均显著高于正常组织:Yamagata数据库中,SNAI2转录水平增加2倍[19];Wachi等[20]和Hou等[18]报道,SNAI2转录水平增加3倍多;Garber数据库中[21],SNAI2转录水平增加4倍多,差异均有统计学意义(P<0.05)。
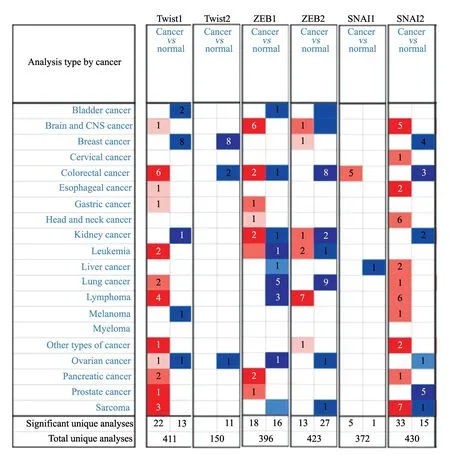
图1 EMT-TF在不同肿瘤中的转录水平Fig.1 Transcription level of EMT-TF in different types of cancer
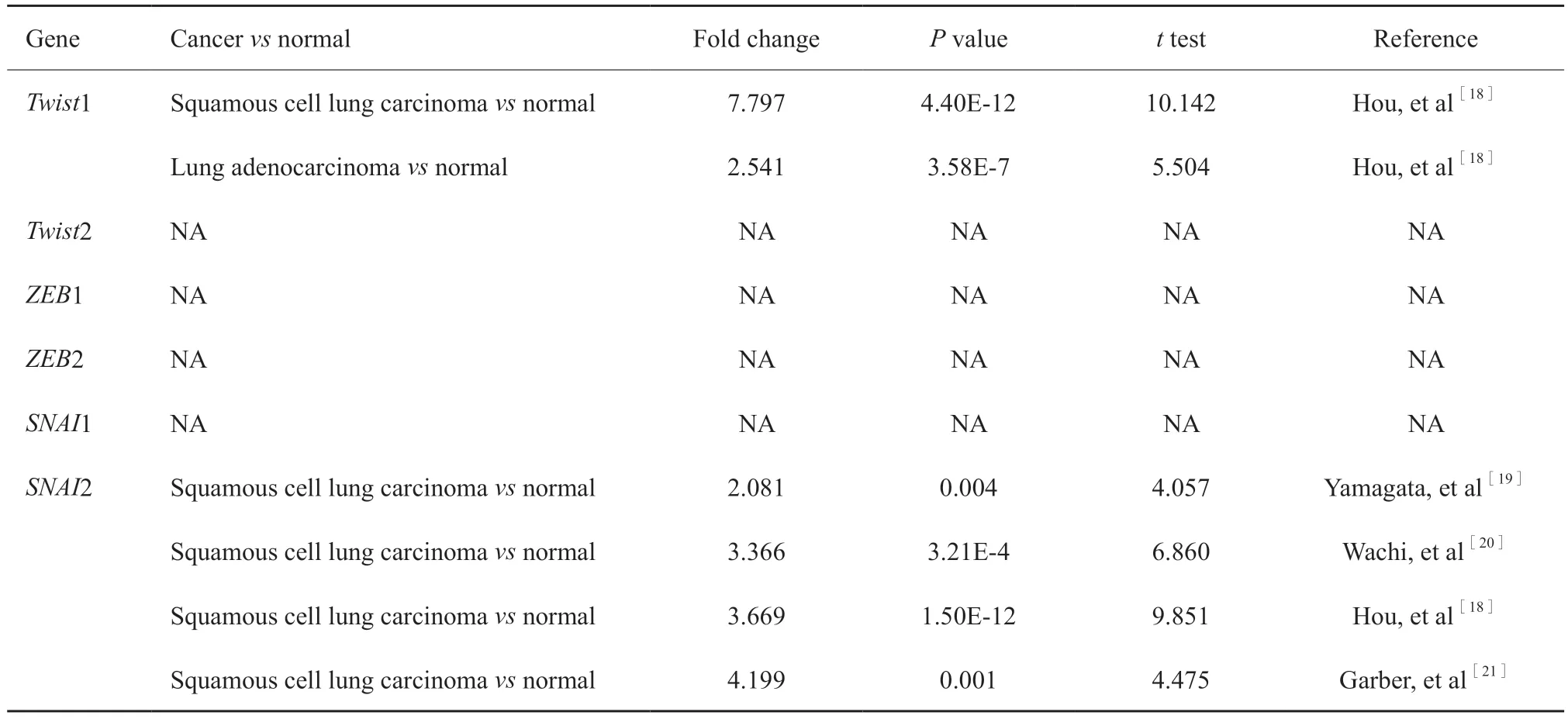
表1 EMT-TF转录水平在肺癌和肺组织中的改变Tab.1 The significant changes in transcription level of EMT-TF between different types of lung cancer and normal tissues
2.2 EMT-TF的mRNA表达与肺癌临床病理学分期的关系
通过搜索基因表达谱数据动态分析(Gene Expression Profiling Interactive Analysis,GEPIA)数据库比较了EMT-TF在肺癌组织和正常组织中的表达差异。结果显示,与正常组织相比,在肺鳞癌中Twist1和SNAI2 mRNA表达增加,Twist2、ZEB1、ZEB2和SNAI1表达降低;而在腺癌中,Twist2、ZEB1、ZEB2和SNAI1 mRNA表达水平降低,Twist1、SNAI2 mRNA表达无差异(图2A)。
为探究EMT-TF的表达水平与肿瘤分期的相关性,我们采用stage plot方法对GEPIA数据进行了分析,结果显示,Twist1、SNAI1和SNAI2表达水平与肺癌临床病理分期具有明显相关性,而Twist2、ZEB1和ZEB2的表达水平与临床病理学分期无相关性(图2B)。
2.3 Twist1与肺癌患者预后相关
我们采用Kaplan-Meier Plotter工具分析了EMT-TF mRNA水平与肺癌5年生存率之间的关系,结果发现,Twist1和Twist2的表达增加提示肺癌患者的不良预后(P<0.05):例如Twist1、Twist2高表达组患者OS、PFS均较低(P<0.05),SNAI1高表达组患者PFS、OS和PPS均较低(P<0.05),ZEB1、ZEB2低表达与肺癌的不良预后相关,其中ZEB1的表达降低与肺癌OS降低相关,ZEB2的低表达与肺癌的PFS和OS预后不良显著相关(图3)。
2.4 EMT-TF的相互作用及通路
我们首先采用STRING分析了EMT-TF之间的PPI,结果显示,EMT-TF之间存在直接或间接的相互作用,其中Twist1和Twist2在信号网络中起关键作用(图4A)。随后,我们采用Mentha数据库进一步展示了TF之间的相互作用以及与它们相互作用的分子,并且显示了分子作用的部位(图4B)。KEGG通路分析发现,EMT-TF受到细胞外界微环境的变化,如细胞因子等的调控,发挥促进肿瘤迁移和侵袭的作用,进而导致转移的发生。
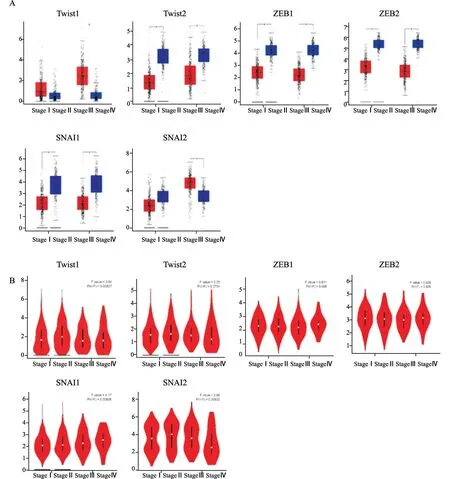
图2 EMT-TF的mRNA水平以及与肺癌临床病理分期的关系Fig.2 The association of EMT-TF mRNA transcription level and tumor stage in lung cancer patients
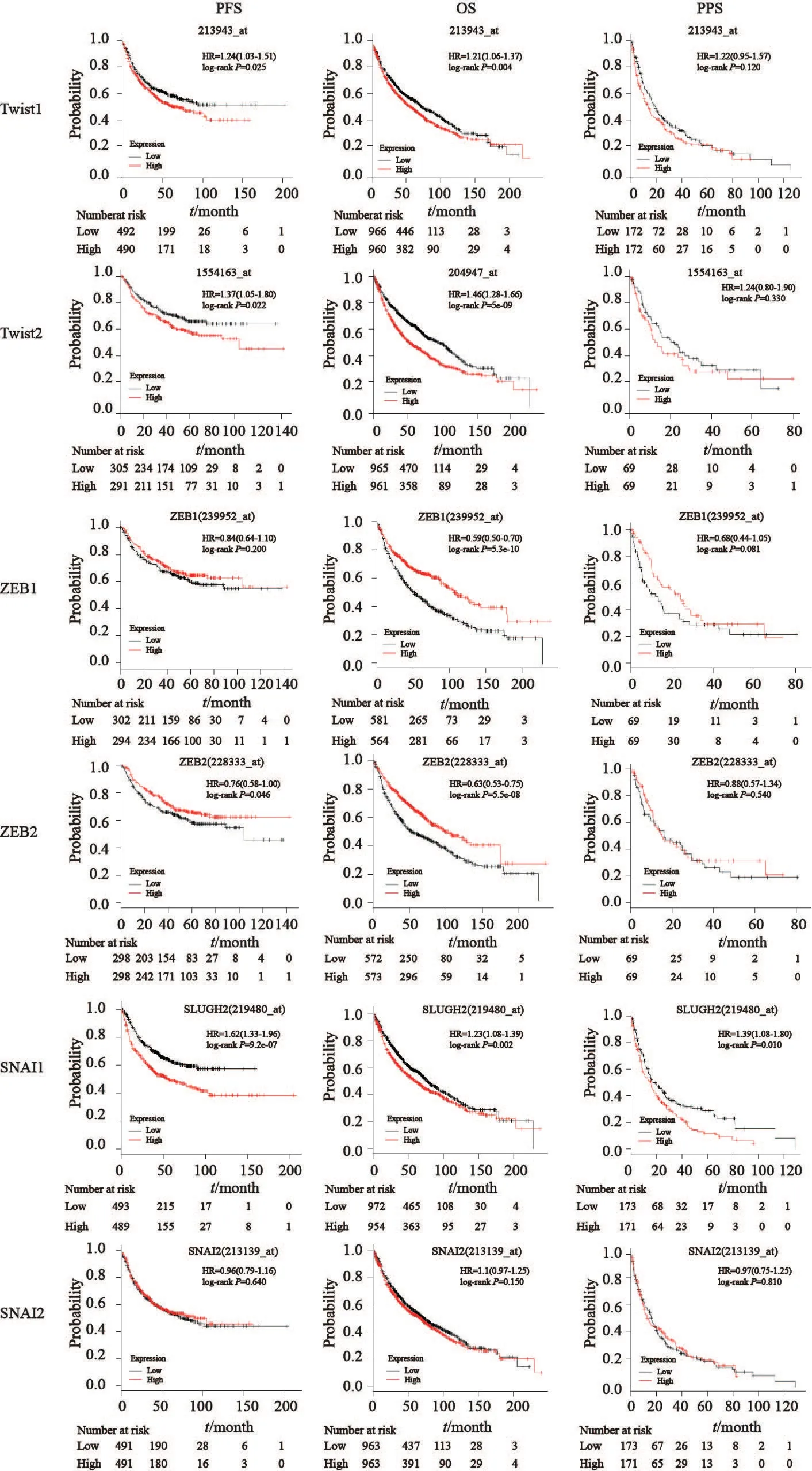
图3 EMT-TF与肺癌预后的相关性Fig.3 The correlation of EMT-TF expression level and prognosis of lung cancer patients

图4 PPI和EMT-TF相互作用的分子Fig.4 PPI network of EMT-TF and the cofunction molecules
3 讨 论
EMT是肺癌侵袭和转移的重要环节,非小细胞肺癌患者可通过EMT机制对肿瘤治疗药物产生耐药。研究发现,TGF-β可通过下列途径介导EMT:①通过Smad途径介导EMT;② 通过诱导Smad复合体浸入细胞核进而调节EMT相关基因和因子的表达;③可增加SNAI1、SNAI2和ZEB1/2等EMT-TF的表达[22]。LncRNA也能通过影响EMT的进程和肿瘤干细胞特性,发挥调节非小细胞肺癌转移的作用[23-24]。研究表明,miRNA也能调控EMT,如抑癌因子miR-451a的过表达可破坏肺癌细胞的EMT,显著增强肺癌细胞对多柔比星治疗的敏感性[25]。在肺癌中,很多促癌基因也能促进EMT,比如FAM83D[26]、FOXK1[27]、KLK4[28]等。因此识别并阻断EMT进程,对降低肿瘤的侵袭和转移非常重要,同时也可降低进展期肺癌患者的负荷,进而提高对手术的耐受和预后,这对肺癌乃至所有肿瘤患者都很重要。
研究发现Twist1在肺癌中受很多因素的调节,如LncRNA JPX上调Twist1后通过Wnt/β-catenin信号通路诱导EMT和肺癌细胞侵袭[29];HR23A与Twist1相互作用促进了Twist1的泛素介导的蛋白酶体降解,从而抑制了EMT、癌细胞迁移和干细胞特性[30];此外还包括表观遗传相关分子和miRNA。目前对Twist2的研究寥寥无几,并且对其在肺癌中的作用并无明确一致的观点[31-32]。本研究发现Twist1在肺癌中的表达增加,并且与肺癌的临床病理学分期相关,Twist1表达增加提示肺癌患者的不良预后,以上皆提示Twist1在肺癌诊断和研究中的重要性和作为肺癌潜在标志物的可能。
SNAI1是一种重要的EMT-TF,可以促进肿瘤的转移,从机制上讲,SNAI1向其目标启动子招募多个参与组蛋白去乙酰化、甲基化和泛素化的抑制蛋白复合物,并发挥其抑制功能[33]。临床上发现,SNAI1的表达和化疗耐药、生存率降低、复发率较高和预后较差相关[15,33-34]。然而SNAI1是不稳定的,通过泛素化介导的蛋白酶体途径很快被降解,通过稳定SNAI1能够促进肺癌细胞的迁移[33]。肿瘤在线数据库分析发现SNAI1在肺癌组织中的表达低于正常组织,并且与分期密切相关,但其预后和在肿瘤中的表达存在分歧。目前对于SNAI1的研究甚少,SNAI1在肺癌中降低的机制,以及它调控的基因仍有待进一步探讨;同时我们分析不同的研究存在样本的差异,以及临床数据收集样本的特异性等,使得无法对其原因进行深入分析。
ZEB1/2的作用相似,在肺癌中,各种调节因子通过作用于ZEB1/2的启动子,调节它们的表达,进而调节EMT和肺癌的侵袭和转移[35-37]。ZEB1/2通过数据库分析发现其表达水平在肺癌中降低,但和临床病理学分期无相关性,ZEB1/2表达降低与患者的不良预后相关。同时EMT-TF在肺癌中的作用逐渐明了,本研究也发现了其与肺癌分期和预后的相关性,这可能辅助于临床诊断、分期和预后预测,同时未来的研究需要进一步探索外界及肿瘤微环境中调节EMT-TF的因子,为肿瘤的预防和治疗提供理论依据。
Twist1、SNAI2、ZEB1和ZEB2在肺癌中的表达量和正常组织不同,Twist1和SNAI2的表达量与肿瘤的分期与预后相关,ZEB1和ZEB2在肺癌中表达量降低与肺癌患者的预后不良相关。因此,Twist1和SNAI2可能是肺癌诊断和研究的潜在的生物标志物,ZEB1和ZEB2可作为肺癌预后的预测分子。

