PFKFB3在胃癌中的表达及对胃癌细胞生长和凋亡的影响研究
刘 鹏 ,龚 阳,刘道江,张 翔,张佳楠,杨高亮,方 念
1.南昌大学第三附属医院消化内科,江西 南昌 330008;
2.新余市人民医院普外科,江西 新余 338025;
3.阳新县人民医院消化内科,湖北 黄石 435200;
4.南昌大学第二附属医院病理科,江西 南昌 330008
胃癌是世界范围内常见的恶性肿瘤之一,是导致我国癌症死亡的主要原因[1-2]。中国恶性肿瘤流行病学数据显示,胃癌发病率居所有癌症第2位,死亡率位列所有癌症第3位[3]。其具有恶性程度较高、生长迅速、易发生转移等特点[4-5]。目前主要的治疗方式是放化疗和手术治疗,然而,患者预后依旧很差。因此亟待寻找新的特异度高、灵敏度高的胃癌生物标志物。研究表明,活跃的糖酵解途径在胃癌的快速生长方面发挥着重要作用;也有研究也证实肿瘤细胞糖代谢增强与糖酵解途径限速酶的活性相关[6-7]。6-磷酸果糖激酶-2同工酶3(6-phosphofructo-2-kinase 3,PFKFB3)作为糖酵解关键酶,在肝癌、骨肉瘤、乳腺癌、非小细胞肺癌等呈高表达,研究也证实PFKFB3与肿瘤的预后密切相关。尽管有研究[8]表明PFKFB3在胃癌中高表达,但其在胃癌进展中的作用和机制并不清楚。因此,本研究分析PFKFB3在胃癌组织中的表达及其对胃癌细胞生物学行为的影响和机制,旨在为胃癌的靶向治疗寻找新的线索。
1 材料和方法
1.1 主要试剂及细胞系
人胃癌细胞系MGC-803及AGS购自中国科学院典藏培养物保型委员会细胞库/中国科学院上海生命科学研究院细胞资源中心,PFKFB3、cyclin D1、PANC、P-/PI3K、P-/AKT、BCL-2、BAX及GAPDH抗体购自英国Abcam公司,细胞凋亡及周期试剂盒购自江苏凯基生物技术股份有限公司,细胞计数试剂盒-8(cell counting kit-8,CCK-8)检测试剂盒购自天根生化科技(北京)有限公司,EdU试剂盒购自广州市锐博生物科技有限公司,PFKFB3 shRNA质粒及空转shNC质粒购自上海吉玛制药技术有限公司,血清、培养基、胰酶购自以色列Biological Industries公司。
1.2 组织标本
经南昌大学医学伦理委员会许可,收集了南昌大学第二附属医院及第三附属医院72例经外科手术切除的新鲜胃癌标本及其相应的癌旁组织。所有标本都经病理医师诊断为胃癌及癌旁组织,于-80 ℃保存。
1.3 实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQ-PCR)检测
采用TRIzol法提取胃癌组织及细胞RNA,经核酸定量分析仪测定RNA的浓度和纯度。按照预设定的程序将其逆转录合成cDNA,最后进行RTFQ-PCR扩增,每组设置3个复孔,每次实验重复3次,取平均值。
1.4 蛋白印迹法(Western blot)检测
提取胃癌组织及细胞总蛋白,经二喹啉甲酸(bicinchoninic acid,BCA)法定量后,按照预定分组,每孔约30 μg总蛋白进行上样,经电泳、转膜、牛奶封闭后,将蛋白条带与其相对应的抗体进行4 ℃温育过夜,经洗膜缓冲液(TRIS-buffered saline Tween,TBST)洗膜3次,根据一抗的来源种属,与对应二抗室温温育1~2 h,再经TBST洗膜3次,将电化学发光(electrochemical luminescence,ECL)试剂滴加于条带上,通过凝胶成像分析仪分析胃癌组织及细胞中PFKFB3的表达,每次实验重复3次,取平均值。
1.5 免疫组织化学检测
新鲜的胃癌及癌旁组织立即置于4%中性多聚甲醛固定,经石蜡包埋后切成连续4 μm厚切片,再经烤片、脱蜡、水化、渗透、封闭后,与PFKFB3抗体(1∶200)进行温育4 ℃过夜,与相对应来源的二抗常温温育1 h,最后二氨基联苯胺(diaminobenzidine,DAB)显色反应,于倒置显微镜拍照并记录分析。
1.6 CCK-8检测细胞增殖
取对数生长期的转染shNC、shPFKFB3质粒分组的胃癌细胞,经胰酶消化后以每孔5×103个胃癌细胞接种于96孔板中,每组设置3个复孔,待其贴壁后即为0 h加入CCK-8试剂10 μL 37 ℃温育2 h,于450 nm波长测其吸光度(D)值,同样于1、2、3、4、5 d后测量其D值,记录并分析。
1.7 EdU检测细胞增殖
分组同上,取对数生长期的胃癌细胞,以每孔1×104个细胞接种于96孔板中,于细胞温育箱中培育24 h,按照EdU试剂说明书,每孔加入50 μL EdU 37 ℃温育2 h,100 μL 4%中性多聚甲醛固定30 min,经0.5%Triton-X渗透后加入100 μL Hoechst33342闭关温育30 min,最后荧光显微镜下观察胃癌细胞增殖情况。
1.8 细胞周期与凋亡
按照shNC、shPFKFB3进行分组,经胰酶消化后收集细胞沉淀,磷酸盐缓冲溶液(phosphate-buffered saline,PBS)清洗2次,对于细胞周期,4 ℃预冷的70%甲醇固定4 h,PBS洗2次,收集细胞,加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)染料温育20 min,上机检测。对于细胞凋亡,加入500 mL缓冲液分别加入7AAD及Annexin-Ⅴ温育30 min上机检测凋亡比例,每次实验重复3次。
1.9 统计学处理
所有数据均采用SPSS 19.0和Graphpad Prism 7.0数据软件进行分析。采用t检验分析两组间的差异,采用单因素方差分析比较多组间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 PFKFB3在胃癌中表达情况及与预后的关系
为了明确PFKFB3在胃癌中的表达情况,首先通过TCGA数据库分析了胃癌及相应的癌旁组织中PFKFB3的表达,结果显示,胃癌组织中PFKFB3表达显著增加(P<0.05,图1A),进一步分析发现,高表达PFKFB3的胃癌患者预后差(图1B)。接下来采用RTFQ-PCR及Western blot分析25例胃癌组织中PFKFB3 mRNA表达及蛋白水平,RTFQ-PCR结果显示,与相应的癌旁相比,PFKFB3 mRNA表达显著升高(P<0.01,图1C);同样Western blot结果也证实了PFKFB3蛋白水平明显高于癌旁组织(P<0.01,图1D、E)。接下来采用免疫组织化学法检测进一步证实了PFKFB3蛋白水平升高(图1F)。最后分析PFKFB3表达与临床病理学特征的关系,结果表明,PFKFB3的表达升高与淋巴结转移及TNM分期密切相关(P<0.05,表1)。以上结果均表明,PFKFB3在胃癌中表达升高且影响患者预后。
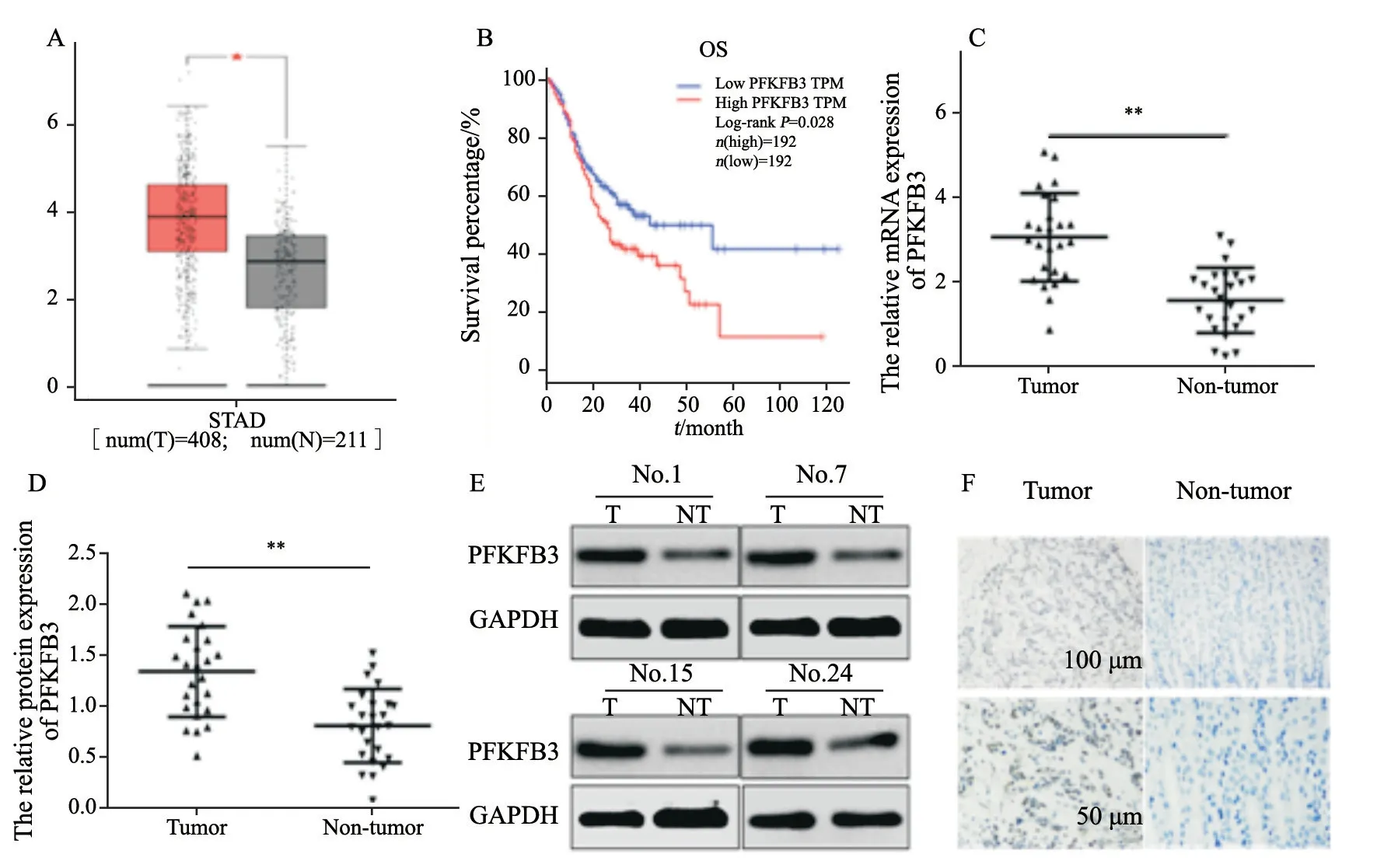
图1 PFKFB3在胃癌中表达情况及与预后的关系Fig.1 Expression of PFKFB3 in gastric cancer and its relationship with prognosis

表1 PFKFB3的表达与胃癌患者的临床数据分析Tab.1 Analysis of the relationship between PFKFB3 expression and clinical data of gastric cancer patients(n)
2.2 下调PFKFB3的表达后抑制胃癌的生长
接下来分析PFKFB3对胃癌细胞生长的影响,首先采用shRNA质粒干扰胃癌细胞MGC803的表达,RTFQ-PCR及Western blot检测结果证实,PFKFB3下调成功(P<0.01,图2A、B)。进一步通过CCK-8及EdU实验分析了胃癌细胞的增殖情况,抑制胃癌细胞PFKFB3的表达后,其增殖能力明显减弱(P<0.05,图2C、D)。由此表明,下调PFKFB3的表达后可以显著抑制胃癌的生长。
2.3 下调PFKFB3的表达后胃癌细胞周期阻滞于G1期并促进其凋亡
进一步采用流式细胞术分析对胃癌细胞周期及细胞凋亡的影响,结果表明,下调胃癌细胞中PFKFB3表达后,细胞生长阻滞于G1期(P<0.01),并且胃癌细胞凋亡比例明显增加;同样,Western blot检测结果显示,PFKFB3表达的降低导致细胞周期蛋白D1(cyclin D1)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)表达的降低,同时凋亡相关蛋白BAX蛋白表达升高,而BCL-2的表达下降。以上结果表明,下调PFKFB3的表达之后,胃癌细胞周期阻滞于G1期并促进其凋亡(图3)。
2.4 PFKFB3通过影响磷酸化PI3K/AKT进而调控胃癌细胞的生长
研究表明,PFKFB3可通过磷酸化磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)通路调控细胞的生物活性[9],我们进一步分析了PFKFB3-PI3K/AKT通路在调控胃癌细胞生长中的作用。结果表明,下调胃癌细胞中PFKFB3的表达水平,总PI3K/AKT并不改变,而磷酸化PI3K/AKT却随之降低(图4A)。进一步在过表达PFKFB3的胃癌细胞中加入PI3K/AKT信号通路抑制剂LY294002,Western blot检测结果证实,PI3K/AKT信号通路被抑制(图4B)。过表达PFKFB3后其生长显著增强,然而在过表达PFKFB3胃癌细胞中抑制PI3K/AKT信号通路后其生长明显被抑制(图4C,P<0.05)。由此可见,PFKFB3可能通过影响磷酸化PI3K/AKT进而调控胃癌细胞的生长。

图2 下调PFKFB3的表达抑制胃癌的生长Fig.2 Down-regulation of PFKFB3 expression inhibited gastric cancer growth
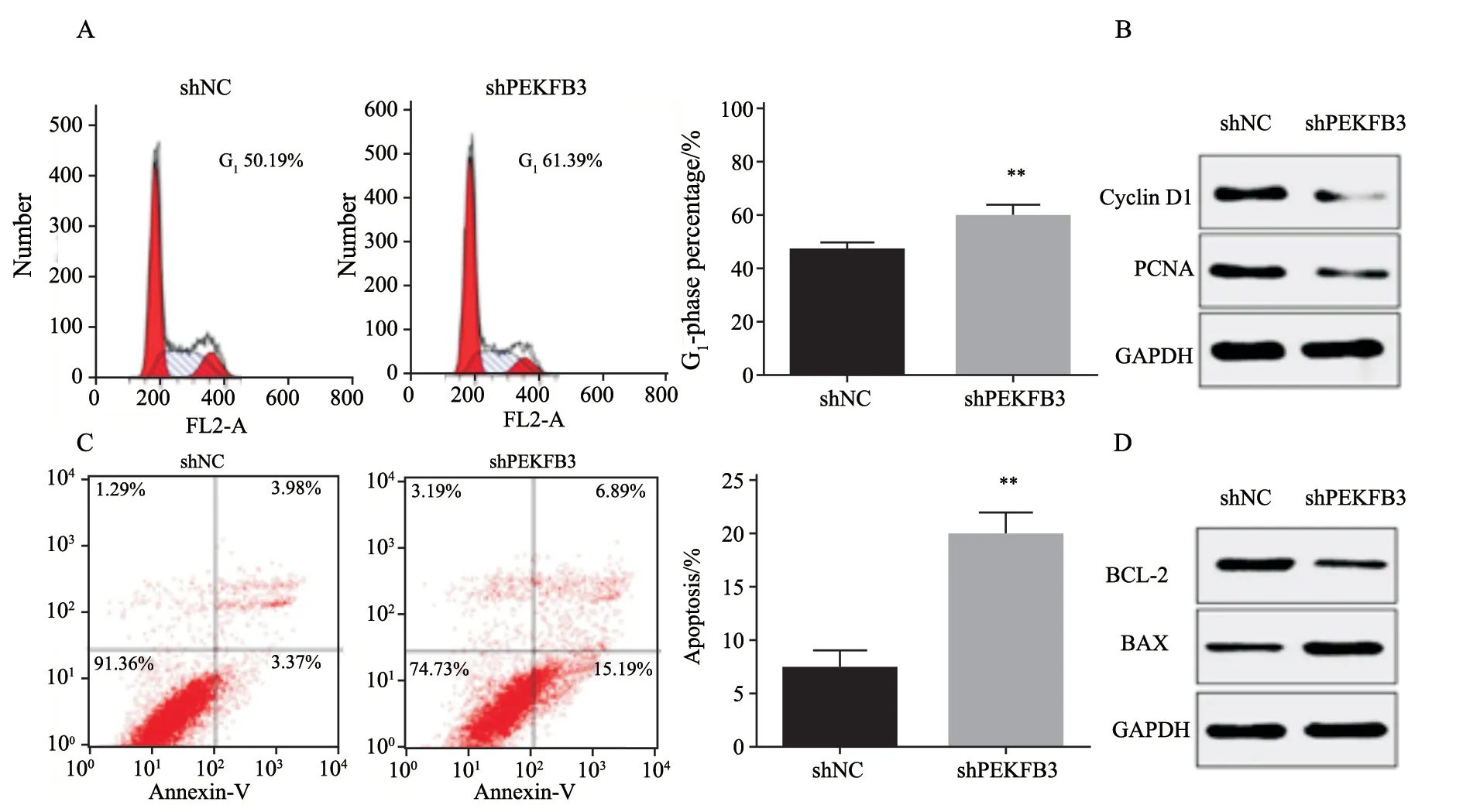
图3 下调PFKFB3的表达后胃癌细胞周期阻滞于G1期并促进其凋亡Fig.3 Gastric cancer cell cycle arrests in G1phase and apoptosis increased after down-regulating PFKFB3 expression
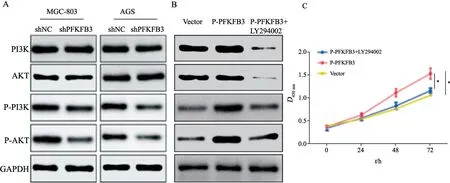
图4 PFKFB3通过激活磷酸化PI3K/AKT信号通路进而调控胃癌细胞的生长Fig.4 PFKFB3 regulated the growth of gastric cancer cells by activating the phosphorylated PI3K/AKT signaling pathway
3 讨 论
胃癌仍然是当今世界上常见的肿瘤之一,由于当前还缺乏敏感性及特异性靶点,其5年生存率依旧很低[10]。在胃癌新型化疗药物及免疫治疗取得重大突破之前,亟待寻找特异性靶点,为胃癌的靶向治疗提供更多线索。肿瘤的发生、发展中涉及到很多遗传及表观遗传学的改变,而胃癌的一个重要标志是其代谢变化,主要包括氨基酸、核苷酸、脂质及糖酵解途径等。有氧糖酵解其特征是消耗葡萄糖并导致乳酸堆积。一方面,肿瘤中乳酸的堆积导致糖酵解限速酶磷酸果糖激酶-1(phosphofructokinase-1,PFK-1)表达,进一步抑制细胞凋亡及促进癌细胞的转移发生。另一方面,大量的糖酵解产物又可以驱动肿瘤细胞的生长[11]。因此,阐明肿瘤中的好氧糖酵解发生过程,将可能为胃癌提供一种新的有效的治疗策略。PFKFB3作为糖酵解的关键限速酶,在多种癌症中高表达,Peng等[9]报道在乳腺癌中PFKFB3高表达,沉默乳腺癌细胞中PFKFB3的表达能显著抑制其生长和转移;Li等[12]也证实了PFKFB3在肺癌中高表达,且与肺癌患者预后密切相关;此外,Deng等[13]也证实骨肉瘤中PFKFB3高表达,且PFKFB3的表达与骨肉瘤的生长和转移相关。在机制方面研究报道肿瘤中PTEN的缺失、RAS及AKT的激活会增加糖酵解中的限速酶PFKFB3的活性[14]。另外PFKFB3作为PFK-1的激活剂,其升高能够促进PFK-1的活性,从而增强肿瘤细胞摄取的葡萄糖迅速进行糖酵解,从而为肿瘤的生长提供充足能量;其次PFKFB3对于含有Ras转化细胞的肿瘤的生长十分重要,能够促进正常的血管生成和肿瘤的生长,并加速肿瘤的发生、发展[15-16]。也有研究证实,缺氧诱导因子-1α(hypoxia-inducible factor-1,HIF-1)和P38/MK2信号通路的激活及PFKFB3第461位点丝氨酸的磷酸化可使其表达上调,进而促进肿瘤的增殖[12]。本研究检测了胃癌患者PFKFB3的表达,并通过研究证实了PFKFB3在胃癌中高表达,进一步研究表明下调胃癌细胞中PFKFB3的表达后,其生长能力显著被抑制,而凋亡明显上升,且细胞周期于G1期阻滞,表明PFKFB3通过影响磷酸化PI3K/AKT信号通路进而调控胃癌细胞的生长。由此,PFKFB3可能是胃癌潜在的生物标志物。
综上,本研究分析了PFKFB3在胃癌中的表达,并阐述了其对胃癌细胞生长和凋亡的影响及机制,可望为胃癌的生物靶向治疗提供新的线索。

