骨关节炎滑液的表面增强拉曼光谱技术研究
朱勇康 马丹英 陆燕飞 尚林伟 赵远 张紫薇 尹建华

摘 要 关节滑液(SF)作为关节重要组分,在关节运动、润滑、保护等方面起至关重要的作用。随着骨关节炎(OA)的发展,滑液内蛋白、多糖等成分也会发生改变,因此可作为OA检测的标志物。常规拉曼光谱法检测的灵敏度较低,难以实现对关节滑液内微/痕量成分的光谱学检测,因此,表面增强拉曼散射(SERS)技术成为微/痕量生物组织检测的优先选择。本研究首先利用配制的银纳米溶胶检测稀释血清和透明质酸(HA),以检验SERS技术用于关节滑液内含物检测的可行性,然后以患病早期(8周)OA犬类膝关节处滑液为实验对象进行SERS检测。结果表明,蛋白谱带和HA、硫酸多糖等多糖谱带的强度均明显增强,实现了关节滑液的微量检测分析。通过病变与健康关节滑液SERS光谱的对比分析发现,在OA早期,关节滑液中HA、硫酸多糖等多糖成分较健康滑液均呈现增加趋势,并与健康关节滑液中对应的相关谱带有显著性差异(p<0.05)。本研究将SERS技术用于关节滑液的检测,取得了较为理想的实验结果,为早期OA识别和病变规律的探究以及关节滑液等组织液的微/痕量检测开辟了新的路径。
关键词 表面增强拉曼散射;关节滑液;多糖;骨关节炎
1 引 言
骨关节炎(Osteoarthritis,OA)是由于软骨、滑膜、软骨下骨、关节滑液等多种生化因素变化共同作用所导致的退行性关节疾病,主要表现为关节疼痛和活动受限,最终导致患者活动能力下降甚至丧失[1~3]。骨关节疾病早期缺乏症状,不易察觉,当出现明显症状时,多进入中晚期,软骨已发生不可逆性损害[4]。因此,多数患者因为疼痛、关节功能丧失而不得不接受人工关节置换手术[5]。现阶段,骨关节炎的诊断主要依据临床表现和影像学检测,或以骨關节炎不同阶段临床表现及疼痛症状为诊断依据(慢性病史检查),或以骨关节炎中后期出现的关节形态变化(如: 关节间隙显著变窄、关节边缘变尖、关节软骨下骨形成骨性囊腔等)为诊断依据(X射线成像)[6],或以骨关节炎发生时出现的软骨及其下骨异变为诊断依据(计算机断层扫描(CT),磁共振(MRI))[7],但X线平片、CT检查不能反映关节软骨结构变化,而MRI检查存在检测时间长、价格高、分辨率低等局限性。因此,探索骨关节炎早期的病变规律,开发在病变早期可及时诊断的方法十分有必要。
关节滑液(Synovial fluid,SF)是由水、蛋白质、蛋白多糖(主要是糖胺聚糖GAGs)、脂质、少量无机盐及代谢物等成分构成的生物体液,各成分在关节处发挥多种功能,如透明质酸(Hyaluronic acid,HA)作为未硫酸化的糖胺聚糖维持着关节滑液的粘弹性,并具有调节糖基化终产物、细胞因子和与OA相关酶生物活性的功能[8~10]。关节滑液作为关节软骨与血液进行物质交换的代谢通道,其中的组分会随OA的发展而发生相应的变化。在细胞因子水平研究中,已证实了滑液中硫酸软骨素(Chondroitin salfate,CS)[11]、HA[12,13]、Ⅱ型胶原蛋白类[14,15]等成分均与OA进展具有相关性,但目前普遍使用酶联免疫吸附测定(Enzyme-linked immunosorbent assay,ELISA)结合吸光度检测的方法耗时长,步骤较为繁琐,无法实现快速实时检测[16]。
目前,对关节软骨的光谱学研究主要采用傅里叶变换红外光谱技术(Fourier transform infrared spectrometer,FTIR)和拉曼散射技术(Stimulated Raman scattering,SRS)[17,18],两者主要对软骨、胫骨等组织进行切块/片检测分析,但都存在对低浓度物质检测灵敏度低的缺陷。因为关节滑液中存在水,所以仅考虑拉曼光谱技术进行检测。关节滑液在关节处含量少、浓度较低,常规自发拉曼技术难以进行微/痕量检测。
液滴沉积法(Drop deposition,DD)是将液滴滴于固体基质上,干燥并用于检测的简单方法[19]。结合拉曼检测技术,可使弱散射性组分的拉曼信号得到改善[20,21],在干燥过程中,干扰有效拉曼信号的杂质(如荧光物质等成分)会沉积于液滴中心处,而蛋白、多糖等大分子物质会沉积于液滴边缘,从而实现与检测组分的“粗分离”[22~24]。
表面增强拉曼散射(Surface enhanced Raman scattering,SERS)技术的发展弥补了自发拉曼散射的不足,利用SERS基底金属纳米材料吸附检测分子可以将待测物质分子的检测灵敏度提高若干个数量级,并在一定程度上减弱荧光背景,从而实现痕量检测分析[25~29]。本研究通过滴加柠檬酸钠加热还原硝酸银的方法制备银纳米溶胶,并利用液滴沉积法将其分别与血清、HA混合,进行拉曼光谱检测,验证了所制基底对蛋白、多糖等生物组分具有较好的增强效果。通过对比分析病变与健康SF的SERS光谱,发现病变SF中多糖成分(HA、硫酸多糖等)明显增加,因而可作为OA(早期)检测的潜在生物标志物。
2 实验方法
2.1 仪器、试剂与材料
FK-H2型磁力加热搅拌器(上海越众仪器公司);CQ-600型超声振荡机(上海生析超声仪器有限公司);TGL-16C型高速离心机(上海安亭科学仪器厂);LP8200P型电子天平(上海升隆电子科技公司)。
柠檬酸钠(>99%)、AgNO3(>99.9%)均为分析纯(南京化学试剂有限公司);HA(>99%,分析纯,江苏倍达医药科技有限公司);实验用水为二次去离子水。
选用成年比格犬(江苏亚东实验动物研究院实验动物中心,动物实验经动物伦理委员会批准)作为实验对象,对其进行右后腿膝关节前交叉韧带造模术处理,培养8周后(即OA早期,由病理检测及FTIR实验证实[30]),用注射器抽取其4条腿膝关节腔内关节滑液,并加入适量生理盐水,以满足实验用量。同期抽取该犬血液,不加入抗凝剂,静置2 h后,以3000 r/min离心10 min,弃去红细胞,取淡黄色上清液即血清,进行后续实验。
2.2 银纳米溶胶的制备
采用柠檬酸钠加热还原AgNO3方法[31,32]制得银纳米溶胶,具体步骤如下: 将150 mL 0.1 mg/mL AgNO3溶液置于磁力加热搅拌器上加热至沸腾,逐滴加入4 mL 1% (m/m)柠檬酸钠溶液,并伴随剧烈磁力搅拌,加热搅拌60 min后停止加热,继续搅拌,冷却至室温,即得到初始银纳米溶胶;取适量溶胶于离心管内,9000 r/min离心10 min,弃去上清液,并加入等量水,超声振荡5 min使其混合均匀,重复上述步骤,离心,超声振荡3次后,得到银纳米溶胶,用于后续实验。
2.3 拉曼光谱采集
自行搭建的色散型拉曼光谱检测系统[33,34],由785 nm激光光源(IPS)、制冷型CCD检测器(Andor)、外光路系统(收集系统)、计算机处理与显示系统和光谱仪系统(光栅(Newport)刻痕密度1200 lp/mm,狭缝(Thorlab)50 μm组成。光谱采集范围: 500~2200 cm1;分辨率: 3 cm1。制备10 4 mol/L(~0.04 mg/mL)HA溶液,此浓度明显低于病理性关节滑液中HA浓度0.10~1.14 mg/mL[35]。用生理盐水按1∶2(V/V)比例将血清稀释;取约100 μL HA溶液、稀释血清及实验犬4组关节滑液,分别与等量银纳米溶胶混合,并设置对照组(不与银胶混合的等量样本),超声振荡5 min后,滴于氟化钡晶片,于室温条件下静置约12 h,待其自然风干。
分别采集HA、血清以及4组关节滑液液滴沉积风干后的SERS光谱及对应的自发拉曼光谱。共设置了6组实验样本共72个液滴沉积样品,对每一液滴沉积边缘绕一周检测50~60处,并取其中增强效果明显(即结合“热点”区域)的20~30组拉曼数据作平均处理,以减小实验误差。背景扣除和光谱采集由CCD自带Andor Solis软件下完成,采用Vancouver Raman Algorithm软件[36]对光谱进行荧光背景分离。上述各组的拉曼检测实验环境(室温、干燥环境)均一致,其中各样品的光谱检测时间根据获得较好的光谱效果的时间确定。血清的稀释倍数不大,其在自发拉曼检测中较短时间即可获得较好效果的光谱,而由于HA和SF浓度极低导致自发拉曼信号很弱,需较长的积分时间检测,因此稀释血清的自发拉曼和SERS检测时间均为10 s;稀释HA自发拉曼检测时间为60 s,SERS检测时间为10 s;关节滑液自发拉曼检测时间为60 s,SERS检测时间为40 s。
3 结果与讨论
关节滑液作为关节软骨组织与血液进行物质交换的通道,本质上属于血浆透析液,各蛋白组分与血清中基本一致[37]。目前HA已被广泛应用于细胞因子水平研究中[8~10]。由于其中各生物组分的光谱重叠,为探究具体的增强成分,分别制备了稀释血清及HA溶液作为实验对象,以探究关节滑液SERS检测的可行性。
3.1 血清及HA的SERS检测
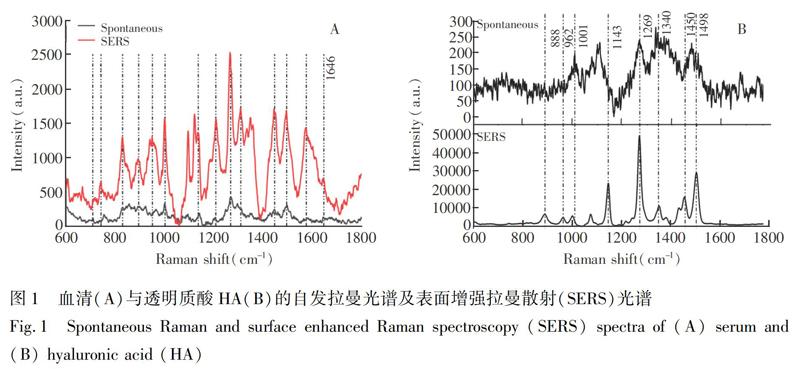
将稀释血清自发平均拉曼光谱与增强平均拉曼光谱对比,由图1A可见,SERS光谱在709、742、830、894、950、1002、1090、1130、1207、1230~1280(amide Ⅲ)、1446、1646 cm 1等处各峰强度明显增强,所测得的血清拉曼特征峰与文献[38,39]一致。其中,增强的谱带主要归属于血清中各种蛋白氨基酸,表明所制备的银纳米溶胶对血清中各蛋白组分有较好的增强效果。
0.1 mmol/L HA的拉曼光谱与SERS光谱对比如图1B所示,自发拉曼光谱中各特征峰强度极弱,并且部分峰因出现叠加情况而无法分辨,而SERS光谱在890、1001、1150、1270、1340和1490 cm 1等处的峰强度有~102数量级的增强。尽管在不同实验条件下各特征峰位置会发生2~10 cm 1的偏移,但实验所测各特征峰与文献[40]中基本一致。此外,通过对比检测时间及光谱各谱带效果可知,与自发拉曼光谱相比,SERS具有快速、高效、高信噪比等优势[41]。
上述结果表明,所制备的银纳米溶胶对血清和HA的拉曼谱峰明显增强。血清中增强的各谱带主要是各种蛋白质的谱峰,而关节滑液中也含有这些蛋白,只是关节滑液中蛋白的成分含量约是血清中的1/5[37]。对稀释后的HA的SERS检测结果表明,888和962 cm 1(醇类OH伸缩振动)、1269 cm 1(CN伸缩振动)、1450和1498 cm 1(CH2/CH3发生形变或弯曲)等谱带明显增强,而HA是关节滑液的主要成分,因此,基于本研究制备的SERS基底对关节滑液等生物组织液的检测是可行的,HA可作为SERS检测OA的潜在生物标志物。并且所制备银溶胶对HA这种多糖成分增强效果明显优于各蛋白组分,这可能是多糖成分更易与银纳米粒子结合形成“热点”区域而得到增强(即SERS基底具有选择性和特异性[26,42])。因此,本实验在对关节滑液进行检测分析时,以各多糖谱带研究为主,对OA早期阶段关节滑液内各多糖组分的变化规律进行探究。
3.2 关节滑液自发拉曼光谱分析
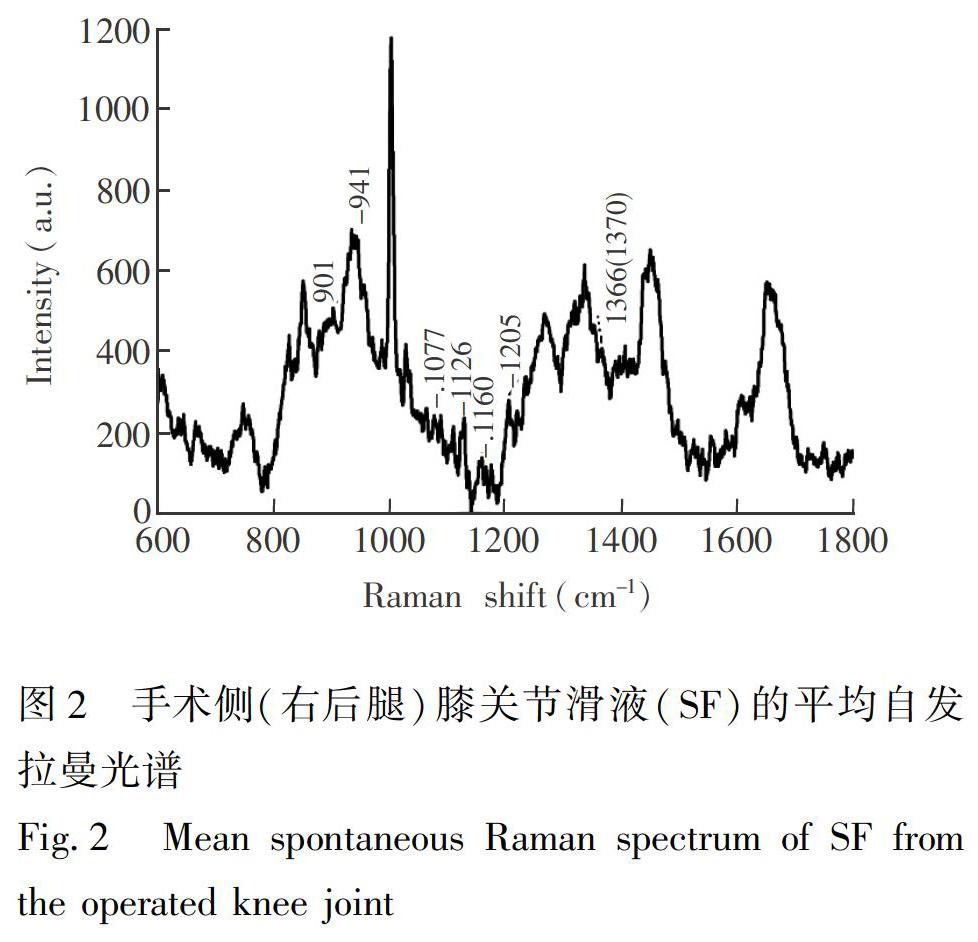
首先对OA造模培养8周(OA早期)的实验犬4条腿膝关节处关节滑液进行自发拉曼光谱检测。图2为手术侧(右后腿)关节滑液自发平均拉曼光谱,结合表1中关节滑液主要糖带Raman谱峰可知,1处糖带峰较為明显,而其余几处不明显且强度都很弱,不适于于进行分析对比。
考虑到犬类前后腿健壮程度差异较大,选择右后腿SF(手术侧)和左后腿SF(手术对侧)进行对比分析较为合适。但实验犬在右后腿进行OA造模后,在日常活动中可能会使左后腿承受更大压力,从而使其关节磨损过度出现OA症状,因此有必要探究实验犬左后腿是否健康。
實验犬左前与右前腿健康膝关节滑液自发平均拉曼光谱对比如图3A所示,虽然各峰强度不强,但898、940、1160和1204 cm 1等主要糖带峰差异不大(各峰p>0.05,无显著差异性)。实验犬健康(左前腿)关节滑液与手术对侧(左后腿)关节滑液自发平均拉曼光谱如图3B所示,除1000~1180 cm 1之间各谱带强度太低,无法用于对比分析外,两者在898、940和1206 cm1处主要糖带峰基本重合(即图3B中圈出部分,p>0.05,无明显差异性),说明实验犬手术对侧膝关节滑液仍然健康,即在OA早期(8周),实验犬可能为适应身体状况而减少活动量,所以手术对侧左后腿膝关节磨损受压程度还未生成OA,这与病理解剖结果[30]一致。因此,可以将手术对侧与手术侧关节滑液进行对比分析。手术侧(右后腿)与手术对侧(左后腿)关节滑液自发平均拉曼光谱如图3C所示,两者在901、940和1206 cm 1处谱峰有差异,但只有1206 cm 1处表现出明显差异性(p<0.05);而1080、1160、1206和1370 cm 1处各糖带峰强度弱,无法充分利用光谱信息进行分析,即关节滑液常规的自发拉曼光谱检测无法满足需求。因此,有必要结合SERS技术对关节滑液进行微/痕量增强检测。
3.3 关节滑液SERS分析
手术对侧(左后腿)膝关节滑液自发拉曼与SERS对比如图4所示,所制备银纳米溶胶对关节滑液的拉曼光谱信号有明显的增强作用,特别是902、934、1068、1130、1208和1377 cm 1等处多糖谱带信号强度较自发拉曼光谱提升了约100倍,因此可以充分利用光谱中各糖带信息进行对比分析。
并出现了较大的差异,OA早期关节滑液与健康关节滑液之间多糖成分含量具有显著差异性(p<0.05),即在手术侧OA早期关节滑液中各多糖含量相较于手术对侧正常关节滑液中多糖含量有所增加。这可能是因为在OA早期软骨结构发生明显改变之前软骨内部代谢已出现异常,HA、硫酸多糖等多糖成分开始出现流失或吸收减少,从而进入到了作为物质代谢通道的关节滑液内,导致了早期OA关节滑液中多糖含量增加,这也与在早期OA中软骨内多糖成分减少的相关文献结论吻合[43]。结合图4和图5关节滑液的自发及SERS光谱可知,在自发拉曼光谱中,以1001 cm 1(蛋白质,苯丙氨酸)为代表的各蛋白氨基酸特征峰强度明显强于各主要糖带峰,且1001 cm 1处强度最强;SERS光谱中,1026和1126 cm 1等各多糖带增强效果相较于蛋白组分更明显,这与3.1节中对稀释HA和血清的SERS检测结果一致,进一步验证了所制备银纳米溶胶用于关节滑液检测的可行性,其中多糖组分的增强效果较好。
4 结 论
以关节滑液为研究对象,结合SERS技术,利用液滴沉积法对OA早期关节滑液中成分变化进行了探究,发现在OA早期,病变关节滑液中硫酸多糖、HA等多糖成分呈现增加趋势。在OA早期,特别是在结构发生改变之前,快速准确的诊断并及时治疗是骨关节炎诊断治疗的难点。目前,常规拉曼或红外光谱可以实现软骨成分变化快速检测,但难以实现无创或微创的临床要求。本研究将SERS技术应用于关节滑液研究,实现了对关节滑液的微量检测,并初步探究了OA早期病变的规律,为早期OA病变规律的探究提供了新思路,也为OA的无创或微创诊断提供了新方法。
References
1 Felson D T,Neogi T. Arthritis Rheumatism,2004,50(2): 341-344
2 Dieppe P A,Lohmander L S. Lancet,2005,365(9463): 965-973
3 Frigg A,Song D,Willi J,Freiburghaus A U,Grehn H. J. Shoulder Elbow Surg.,2019,28(10): E344-E351
4 Ding C,Jones G,Wluka A E. Curr. Opin. Rheumatol.,2010,(22): 520-527
5 ZHANG Hong-Tao,ZHANG Ji-Wen,JIANG Bo. Journal of Chinese Practical Diagnosis and Therapy,2011,25(3): 270-271
张洪涛,张继文,姜 波. 中华实用诊断与治疗杂志,2011,25(3): 270-271
6 YE Zhen,LI Min,CHEN Ding-Jia. Chinese Journal of Osteoporosis,2016,22(5): 624-627
叶 臻,李 民,陈定家. 中国骨质疏松杂志,2016,22(5): 624-627
7 WANG Ji-Lu. World Latest Medicine Information,2016,16(13): 146-152
王继鲁. 世界最新医学信息文摘,2016,16(13): 146-152
8 Cowman M K,Matsuoka S. Carbohyd. Res.,2005,340(5): 791-809
9 Neumann A,Schinzel R,Palm D,Riederer P,Münch G. FEBS Lett.,1999,453(3): 283-287
10 Wang C T,Lin Y T,Chiang B L,Lin Y H,Hou S M. Osteoarthritis Cart.,2006,14(12): 1237-1247
11 Fuller C J,Barr A R,Sharif M,Dieppe P A. Osteoarthritis Cart.,2001,9(1): 49-55
12 Ishimaru J I,Ogi N,Mizuno S,Goss A N. Osteoarthritis Cart.,2001,9(4): 365-370
13 GhoshP,Guidolin D. Semin Arthritis Rheum.,2002,32(1): 10-37
14 Sugiyama S,Itokazu M,Suzuki Y,Shimizu K. Ann. Rheum. Dis.,2003,62(1): 27-32
15 Martel-Pelletier J,Raynauld J P,Mineau F,AbramPatrice F,Delorme P P,Pelletier J P. Arthritis Res. Ther.,2017,19(1): 169
16 Dehring K A,Mandair G S,Roessler B J. ACS Symposium,2007,963: 123-137
17 MAO Zhi-Hua,ZHANG Xue-Xi,WU Yue-Chao,YIN Jian-Hua,XIA Yang. Chinese J. Anal. Chem.,2015,43(4): 518-522
毛之華,张学喜,吴曰超,尹建华,XIA Yang. 分析化学,2015,43(4): 518-522
18 Xu D,Dong Z,Sun J L. Nanotechnology,2012,23(12): 125705
19 Deegan R D,Bakajin O,Dupont T F,Huber G,Nagel S R,Witten TA. Nature,1997,389(6653): 827-829
20 Yakhno T A,Yakhno V G,Sanin A G,Sanina OA,Pelyushenko A S,Egorova N A,Terentiev I G,Smetanina S V,Engineer. Med. Biol. Mag. IEEE,2005,24(2): 96-104
21 Yakhno T,Sedova O,Sanin A,Pelyushenko A. Tech. Phys.,2003,48(4): 399-403
22 Kopecky JV,Baumruk V. Vib. Spectrosc.,2006,42(2): 184-187
23 Zhang D,Mrozek MF,Xie Y,Ben-Amotz D. Appl. Spectrosc.,2004,58(8): 929-933
24 Esmonde-White K A,Mandair G S,Raaii F,Jacobson J A,Miller B S,Urquhart A G,Roessler B J,Morris M D. J. Biomed. Optics,2009,14(3): 034013
25 Piotrowski P,Bukowska J. Sens. Actuators B,2015,221: 700-707
26 Tian Z Q. J. Raman Spectrosc.,2005,36(6-7): 466-470
27 Tian Z Q,Gao J S,Li X Q. J. Raman Spectrosc.,1998,29(8): 703-711
28 Toccafondi C,Rocca RL,Scarpellini A. Appl. Surf. Sci.,2015,351: 738-745
29 WANG Zhi-Le,WANG Zhu-Yuan,ZONG Shen-Fei,CUI Yi-Ping. Chinese Optics.,2018,11(3): 513-530
王志乐,王著元,宗慎飞,崔一平. 中国光学,2018,11(3): 513-530
30 Zhao Y,Lu Y F,Zhu Y K,Wu Y C,Zhai M Y,Wang X,Yin J H. Infrared Phys. Technol.,2019,98(5): 236-239
31 Fleischmann M,Hendra P J,Mcquillan A J. Chem. Phys. Lett.,1974,26(2): 163-166
32 Fleischmann M. Eur. J. Oper. Res.,1997,103(1): 1-17
33 GAO Hao,WANG Xiao,SHANG Lin-Wei,ZHAO Yuan,XU Hao,YIN Jian-Hua. Spectroscopy and Spectral Analysis,2018,38(6): 1933-1937
高 浩,王 潇,尚林伟,赵 远,徐 浩,尹建华. 光谱学与光谱分析,2018,38(6): 1933-1937
34 GAO Hao,ZHAI Ming-Yang,SHANG Lin-Wei,ZHAO Yuan,YIN Jian-Hua,HUANG Bao-Kun. Spectroscopy and Spectral Analysis,2018,38(8): 2425-2429
高 浩,翟明阳,尚林伟,赵 远,尹建华,黄保坤. 光谱学与光谱分析,2018,38(8): 2425-2429
35 Kvam C,Granese D,Flaibani A,Zanetti F,Paoletti S. Anal. Biochem.,1993,211: 44-49
36 Mclean D I,Zeng H,Lui H,Zhao J. Appl. Optics,2007,46(29): 7132-7140
37 Li De-Xue. Chinese Journal of Veterinary Science and Technology,1985,(8): 28-33
李德雪. 中国兽医科技,1985,(8): 28-33
38 ZHANG Hui-Min,QU Xin-Yan,ZHOU Zhe,WANG Sheng-Qi. The Journal of Practical Medicine,2018,34(5): 712-716
张会敏,曲新艳,周 喆,王升启. 实用医学杂志,2018,34(05): 712-716
39 Gonzalez-Solis J L,Martinez-Espinosa J C,Torres-Gonzalez LA,Aguilar-Lemarroy A,Jave-Suarez L F,Palomares-Anda P. Lasers Med. Sci.,2014,29(3): 979-985
40 Mandair G S,Dehring K A,Morris M D. Proceed. SPIE,2006,6093: 60930H-7
41 GAN Zhen-Fei,WANG Lu,GUO Dan,LI Da-Wei. Chinese J. Anal. Chem.,2019,47(4): 613-619
甘振飞,汪 璐,郭 丹,李大偉. 分析化学,2019,47(4): 613-619
42 FU Hao,TONG Li-Ying,LIANG Zhao-Heng,PENG Le,WANG Fu-Yan,ZHOU Jun. Chinese Journal of Luminescence,2019,40(3): 317-325
洑 颢,佟丽莹,梁照恒,彭 乐,王福艳,周 骏. 发光学报,2019,40(3): 317-325
43 Lim N S J,Hamed Z,Yeow C H,Chan C,Huang Z. J. Biomed. Optics,2011,16(1): 017003

