基于1H NMR与多元统计分析的薏苡仁油加速氧化特性研究
肖仕芸 赵泽伟 丁筑红 陈思奇 杜勃峰


摘 要 基于核磁共振氢谱(1H NMR)技术与偏最小二乘判别分析(Partial least squares-discriminant analysis,PLS-DA),分析薏苡仁油分子在室温与60℃加速氧化条件下的变化特性。结果表明,新鲜薏苡仁油样在室温下贮藏135 d,油样亚油酸含量减少16.46%,油酸含量增加1.83%,饱和脂肪酸含量增加30.23%,但初级及次级氧化产物信号峰未出现。薏苡仁油60℃加速氧化18 d时,次级氧化产物信号峰出现,42 d后亚油酸含量减少71.99%,油酸含量增加7.33%,饱和脂肪酸含量增加1.34倍,表明脂肪酸含量随氧化温度变化而差异显著(p<0.05),且脂肪酸氧化顺序为多不饱和脂肪酸(PUFA)>单不饱和脂肪酸(MUSA)>饱和脂肪酸(SFA),加速氧化油样较室温氧化油样质劣变迅速。通过PLS-DA模型能鉴别薏苡仁油氧化条件。 1H NMR指纹图谱结合多元统计分析方法构建的定性分析模型,可为薏苡仁油的质量控制和品质评价提供参考。
关键词 薏苡仁油;加速氧化;核磁共振氢谱;偏最小二乘判别法
1 引 言
薏苡仁油(Coix seed oil)是薏苡仁重要的活性物质,主要为甘油三酯类,包括1,3-二油酸-2-亚油酸甘油酯(1,3-Olein-2-linolein,OLO)、1,2-二亚油酸-3-油酸甘油酯(1,2-Linolein-3-olein,LLO)、三油酸甘油酯(Triolein,OOO)、1-棕榈酸-2-亚油酸-3-油酸甘油酯(1-Palmitin-2-linolein-3-olein,PLO)、薏苡仁内酯、脂肪酸类等[1],其微量营养素(甾醇,生育酚和角鲨烯)含量显著优于其它常用植物油,为高品质多功能食用油脂的新资源[2,3]。医学研究表明,薏苡仁油具有抗炎、抗氧化和抗肿瘤活性[4],已开发应用于如胃癌、肝癌等多种癌症的辅助治疗药剂[5~7]。薏苡仁油不饱和脂肪酸含量高于80%,易被氧化分解,严重影响其应用品质,并带来安全风险[8,9],成为其开发利用需要解决的关键问题。目前,薏苡仁油研究主要涉及分离提取、功能特性及质量控制技术[3,10],有关薏苡仁油氧化问题研究主要关注影响其稳定性的因素条件以及氧化过程中挥发性成分变化[11,12],而贮藏过程中氧化作用动态变化特征与变化机制少有报道。
通常情况下,脂质在室温下的自氧化是油脂变质的主要原因[13]。经典烘箱加热加速氧化实验(Schaal Oven Test)方法作为快速有效手段已广泛应用于油脂氧化稳定性研究[14~16]。核磁共振氢谱(1H NMR) 技术不需对样品进行化学改性,已成为近年来定性与定量分析油脂品质的重要分析方法[17,18]。通过1H NMR与偏最小二乘判别(Partial least squares-discriminant analysis,PLS-DA)等化学计量学方法相结合,可建立基于1H NMR技术的油脂品质变化快速分析模型及技术体系[19]。
本研究将1H NMR指纹图谱技术应用于薏苡仁油的氧化稳定性研究,有效克服了传统化学指标检测法(酸价、过氧化值)[12]和气相色譜-质谱联用结合电子鼻技术[11]等方法的缺陷,快速高效、直观准确分析油脂在不同氧化温度下组分变化情况[17,20],并结合PLS-DA多元统计分析[19],考察室温贮藏与60℃加速氧化条件下薏苡仁油脂变化特征,探明薏苡仁油脂组成结构、氧化变化动态规律及变化实质。本研究为揭示薏苡仁油贮藏氧化机制,建立其氧化变化品质分析方法以及资源合理利用提供了重要依据。
2 实验部分
2.1 仪器与试剂
JEOL-ECX500型500MHz核磁共振仪(日本电子公司);5mm核磁共振样品管(美国Wilmad公司);SK-1型旋涡混匀器(江苏省金坛市友联仪器研究所);GX-45B远红外干燥箱机(天津市泰斯特仪器有限公司)。
薏苡仁油(广州合诚三先生物有限公司),采用薏苡仁超临界CO2萃取,纯度﹥99%,淡黄色液体,味微甜,于4℃保存;氘代氯仿(CDCl3,99.8%,含0.03%四甲基硅烷(TMS),上海阿拉丁生化科技股份有限公司)。
2.2 材料处理
室温贮藏油样制备[18,21]: 将薏苡仁油置于玻璃皿中,于自然条件下,每隔12 h搅拌2 min,使其与空气中氧气充分接触。每隔15 d取样一次,于20℃冻存,待1H NMR测定。
60℃加速氧化油样制备: 采用烘箱加热加速氧化试验[11,14,15],将薏苡仁油置于玻璃皿中,(60±1)℃的烘箱中敞口、避光储存连续加热氧化42d ,每隔12 h对其进行搅拌2 min,并改变其在烘箱中的放置位置。0~15 d,每隔5 d进行取样;15~42 d,每隔3 d进行取样,取样后冷却至室温,于20℃冻存,待1H NMR测定。
2.3 样品的1H-NMR测定
样品准备[19]: 用移液枪吸取200 μL油样,与800 μL CDCl3混合,漩涡振荡60 s,室温下静置5 min,取600 μL混合溶液转移至5 mm核磁管中,进行1H NMR测试。核磁共振分析的主要参数为: 采用1D单脉冲,质子共振频率为500.16 MHz,时域为32 K,90°脉冲的宽度为7.57 μs,谱宽7507.5 Hz,弛豫时间为5 s,信号检测时间为1.75 s,扫描次数为8次。
2.4 定性与定量分析
将测得的一组自由感应衰减信号(FID)导入 MestReNova 11.0软件进行傅立叶变换。对得到的一维1H NMR 谱图进行基线自动校准和相位自动校准。以TMS (δ 0.00 ppm)为内标,δ 7.26 (ppm)归属于CDCl3 (CAS: 865-49-6)的溶剂峰信号。经基线校准后,得到室温与60℃加速氧化条件下薏苡仁油的1H NMR谱图,依据文献[22]并结合Chemdraw软件对峰信号进行峰定性归属,采用文献[23]的方法进行定量分析。以酰基链上α-亚甲基氢(OCOCH2,信号E,δ 2.20~2.40 ppm)处的积分1为标准,然后对其余8个信号峰面积手动积分,并将此9个峰面积加和,和值换算成100,得出A~I等9个峰的新面积。积分数据导入Origin 2017和Excel 2016中作图。通过1H NMR指纹图谱定量分析薏苡仁油中多种脂肪酸含量,因信号峰的面积(A)与产生它们的氢原子的数量成正比,并且比例常数对于所有类型的氢原子都是相同的[24],根据各质子峰的归属,利用下列计算公式(1)、(2)和(3)计算出亚油酸(Linoleic)、油酸(Oleic)和饱和及改性的脂肪酸(Saturated+ modified)百分比含量。
式中,F为由双烯丙基质子(或相对于两个双键的α位质子)引起的信号;D为由烯丙基质子(或相对于一个双键的α位质子)引起的信号;G为由甘油结构的亚甲基质子引起的信号。这些方程可用于测定薏苡仁油中几种酰基(油酸、亚油酸等)的摩尔百分比,以及不同降解程度的薏苡仁油中的亚油酸、油酸和饱和及改性的脂肪酸的摩尔百分率。研究表明,上述信号F、D和G的分配在热氧化油中也有效[24]。
2.5 多元统计分析
将积分后的数据在Excel中进行面积归一化后再导入SIMCA 14.1软件进行多元统计分析,所选择数据预处理方式为Pareto scaling,采用PLS-DA对不同温度下各样品进行分类[25],采用Permutation test对模型的可靠性进行验证,对模型鉴定进行200次的置换测试[26]。
3 结果与讨论
3.1 新鲜薏苡仁油1H NMR指纹图谱分析
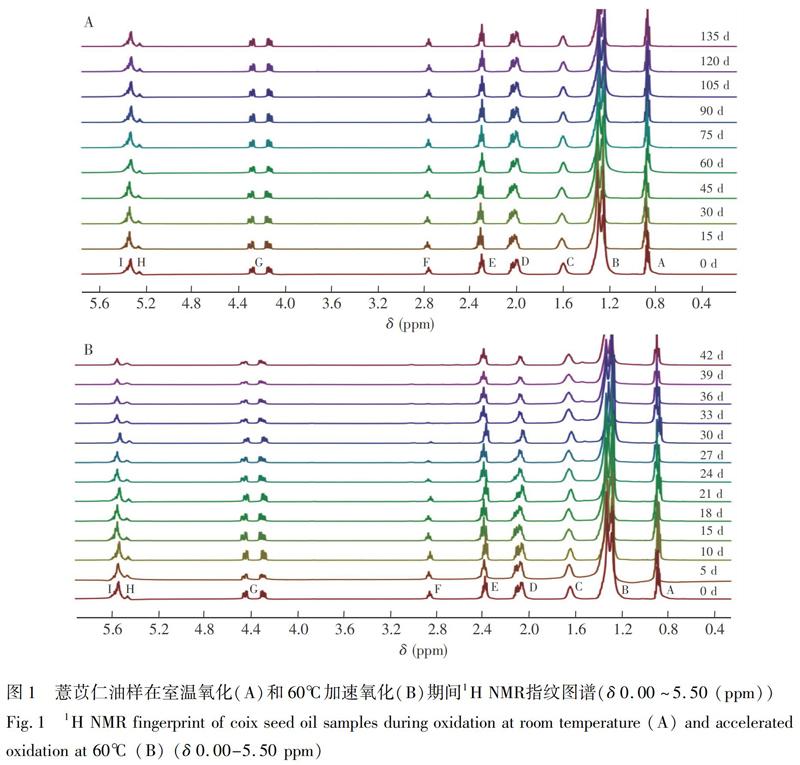
薏苡仁油甘油三酯为主要由亚油酸、油酸和饱和脂肪酸组成的混合脂肪酸甘油酯[3],1H NMR检测新鲜油的指纹图谱结果及对应的脂肪酸甘油酯结构如图1所示,表1是相应官能团对应的化学位移。因脂肪酸的化学结构具有相似性,大部分信号存在重叠没有完全区分开。图1中A~I共9种信号在δ 0.00~5.50 ppm之间,其中信号最强为δ 1.20~1.43 ppm(信号B)和δ 0.82~0.94 ppm(信号A)。信号B为不饱和脂肪酸、软脂酸和硬脂酸上的亚甲基H质子,A信号归属于除亚麻酸以外的其余脂肪酸末端的甲基H质子,如表1所示。这些信号峰主要由薏苡仁油甘油三酯不同结构中H质子产生,其峰值的高低与该化学环境下H质子的含量成正比[24]。薏苡仁油样1H NMR谱与脂肪酸甘油酯结构确认及A、B、D和F信号的化学位移信息见电子版文后支持信息图S1。
3.2 薏苡仁油室温与加速氧化期间1H NMR指纹图谱变化结果分析
研究表明,食用油在贮藏期间油脂酰基发生降解,尤其在加速氧化期间,不饱和度越高,越易受到影响,甚至在氧化后期消失[27]。
由图1可见,薏苡仁油室温氧化下1H NMR指纹图谱中,各质子峰信号强度未出现较大变化;在60℃加速氧化条件下,油脂各酰基峰强度变化明显。图1B中分别代表烯族类(不饱和双键)、双烯丙基、烯丙基的I、F、D信号峰的峰强度出现不同程度的降低,其中双烯丙基(F)信号峰(δ 2.747、2.761和2.773 (ppm)三重峰)信号强度从30 d开始显著减小,饱和脂肪酸结构中甲基(A峰附近)则相应增加,一般脂质的自动氧化是自由基链式反应过程,温度每升高10℃,氧化反应速度增加1倍[28]。因此,与室温油样相比,加速氧化条件下薏苡仁油氧化程度加剧,脂肪酸酰基组成发生了变化,且由此产生了一系列的油脂氧化产物,其信號峰主要集中在δ 5.50~10.00 ppm。室温和加速氧化条件下薏苡仁油随时间变化的部分波谱区域放大图见电子版文后支持信息图S2。
3.3 薏苡仁油氧化过程中不同类型酰基的变化
从3.2节中波谱图直接观察到,薏苡仁油酰基峰均发生变化,尤其加速氧化处理组发生明显氧化或降解,不同时间获得的波谱特征变化,揭示了不同类型酰基的信号变化情况。图2和图3为薏苡仁油氧化期间甲基质子(信号A)、亚甲基质子(信号B)的信号变化情况。
薏苡仁油富含亚油酸、油酸等不饱和脂肪酸,在贮藏过程中,温度对薏苡仁油的氧化稳定性影响最大[12,15],并生成初级和次级氧化产物。薏苡仁油在室温与加速氧化过程中δ 0.82~0.94 ppm和δ 1.15~1.43 ppm的波谱对比如图2和图3所示,δ 0.82~0.94 ppm处归属于各脂肪酸相连的甲基质子,δ 1.15~1.43 ppm处归属于β位的亚甲基质子,或处于双键、γ位,以及亚油酸、油酸和饱和脂肪酸酰基的羰基,均可通过图谱进行观察[24]。
如图2A所示,与新鲜油δ 0.856、0.870和0.884 ppm处油酸加饱和脂肪酸(O+S)信号相比,室温贮藏135 d时,这些信号峰强度均增大。同时,以δ 0.880 ppm为中心的亚油酸(L)基团信号强度减少;在图3A中,δ 1.289 ppm油酸加亚油酸(L+O)信号、δ 1.259 ppm油酸(O)信号、δ 1.242 ppm饱和脂肪酸(S)信号的强度变化不明显,表明在室温氧化下,薏苡仁油不饱和脂肪酸酰基氧化速度较慢。
而在图2B中,与新鲜油相比,60℃加速氧化24 d时,δ 0.866、0.880和0.894 ppm的亚油酸(L)基团信号峰强度明显减小;42 d时,亚油酸(L)基团信号峰消失,仅保留有δ 0.856、0.870和0.884 ppm的油酸加(B) at of δ 1.15-1.43 ppm饱和脂肪酸(O+S)信号。在图3B中,信号B的δ 1.289 ppm油酸及亚油酸(L+O)信号、δ 1.259 ppm油酸(O)信号峰强度在氧化期间明显减弱。可见,加速氧化42 d,亚油酸信号峰强度变化最大,其次为油酸及饱和脂肪酸(O+S),表明加热加速氧化实验能较好地反映油脂品质劣变过程,且对亚油酸影响最大。薏苡仁油脂肪酸氧化速率顺序为PUFA>MUFA>SFA,结果与文献[26]报道茶油的氧化结果吻合。
3.4 薏苡仁油氧化过程中脂肪酸含量变化结果分析
植物油脂肪酸组成与油脂品质有关,同时也影响油脂的稳定性,油脂不饱和脂肪酸含量越高,油脂越容易受到单线态氧(1O2)、光敏剂和脂肪氧化酶的攻击,从而引发油脂氧化链式反应[29],导致其氧化降解,含量减少。
薏苡仁油在室温贮藏条件下脂肪酸含量变化如图4A所示,新鲜薏苡仁油中亚油酸含量34.20%,油酸含量50.22%,饱和脂肪酸含量15.58%,这与Hu等[30]采用超临界CO2萃取及GC-MS测定薏苡仁油脂肪酸含量结果相似,李添宝等[23]也发现,1H NMR与GC-MS定量分析植物油中脂肪酸含量结果相近。
薏苡仁油在室温氧化过程中,总不饱和脂肪酸含量降低缓慢,氧化期间不饱和脂肪酸含量减少5.58%,其中,亚油酸含量减少16.46%,油酸增加1.83%,饱和脂肪酸增加30.23%,此结果与相同条件下薏苡仁油脂肪酸酰基变化情况一致。
薏苡仁油在60℃加速氧化期间脂肪酸含量的变化如图4B所示。随着氧化时间的延长,亚油酸含量呈现下降趋势,油酸含量先升高后降低,饱和脂肪酸含量呈现递增趋势。氧化初期0~15 d,不饱和脂肪酸含量减少1.86%;15~30 d,亚油酸含量减少61%。可见,该阶段薏苡仁油氧化剧烈,亚油酸降解迅速,品质劣变加速。30 d后油酸含量才开始出现下降。氧化期间亚油酸含量减少71.99%,油酸含量增加7.33%,饱和脂肪酸含量增加1.34倍,表明薏苡仁油在加速氧化期间,亚油酸氧化降解明显,而油酸含量变化较小,饱和脂肪酸含量升高。这可能因为亚油酸氧化速率远大于油酸,使不饱和度较低的脂肪酸含量出现波动[31]。实验结果表明,利用1H NMR可准确监测油脂氧化过程中脂肪酸含量动态变化情况。
3.5 薏苡仁油氧化期间初级与次级氧化产物变化分析
由3.4节结果可知,薏苡仁油中多不饱和脂肪酸在氧化期间降解明显。研究表明,PUFA的降解在氧化初期形成的氢过氧化物进一步氧化成次级氧化产物,如醛类化合物、过氧化物、芳香烃等氧化产物[32]。薏苡仁油在室温及加速氧化过程中不同阶段的1H NMR指纹图谱见电子版文后支持信息图S3和图S4。
薏苡仁油在室温氧化期间,在δ 8.00~8.50 ppm处无氢过氧化物信号产生,且未出现δ 9.00~9.80 ppm处的醛类氧化产物信号,与Guillén等[21]研究结果相似,表明较低温度下食用油氧化诱导时间长,氧化缓慢。薏苡仁油在60℃加速氧化期间也未观察到氢过氧化物信号。氢过氧化物性质不稳定,在较高温度下,氢过氧化物的OO键易均裂,产生烷氧自由基和羟基,进而形成醛、酮、酸、醇和短链烃等次级氧化产物,导致其信号不稳定,消失快[33]。研究结果表明,新鲜薏苡仁油的1H NMR图谱在δ 9.30~9.90 ppm处无信号产生,直到60℃加速氧化18 d时,明显观察到醛类物质的信号峰产生,分别为δ 9.764 ppm的n-烷醛与δ 9.497 和9.517 ppm处的(E)-2-烯醛,这与加速氧化下亚油酸含量第18 d出现急剧下降结果相一致,且随着氧化时间的增加,信号峰强度逐渐增大[21,24]。研究表明,次级氧化产物的生成与多不饱和脂肪酸自动氧化形成氢过氧化物的降解有较大联系[31]。
3.6 薏苡仁油氧化变化的PLS-DA模型
为了更好地探究不同氧化条件对薏苡仁油的影响,采用PLS-DA建立分类模型,PLS-DA得分图与置换验证分别见图5和图6。
如图5所示,室温贮藏薏苡仁油与加速氧化薏苡仁油在PLS-DA中得到较好的分离,模型质量评价参数R2X、R2Y及Q2分别是0.935、0.704及0.597。本模型的Q2>0.5,说明模型的拟合能力和预测能力良好。在此模型中,室温油脂样品集中分布,与加速氧化油样间隙较大,区分界限明显,并且室温与加速氧化油样随着氧化时间的延长呈不同趋势变化(图5箭头所指方向)。为避免模型获得分类的偶然性,采用200次置换检验对所建PLS-DA模型进行验证(图6)。建立的PLS-DA模型的响应置换结果为: R2=0.152,Q2=0.298。响应置换检验中的Q2<0,说明建模成功,稳定性和预测性较好,且未出现过拟合现象。上述结果表明,1H NMR结合PLS-DA不仅可有效分辨室温与加速氧化油脂,表征薏苡仁油分子氧化变化趋势,且建立的PLS-DA模型能對氧化薏苡仁油脂进行分类鉴别。
4 结 论
通过高分辨率(500 MHz)1H NMR指纹图谱技术对薏苡仁油氧化变化进行监测,发现薏苡仁油在室温与加速氧化期间1H NMR指纹图谱存在明显差异。室温氧化油样1H NMR图谱各酰基变化不明显,而加速氧化条件下薏苡仁油的烯族类、双烯丙基、烯丙基的峰强度变化显著。新鲜薏苡仁油中亚油酸、油酸及饱和脂肪酸含量分别为34.20%、50.22%和15.58%,室温条件下,其不饱和脂肪酸含量变化缓慢,贮藏135 d减少5.58%,其中亚油酸含量减少了16.46%,油酸含量增加了1.83%。而加速氧化期间油脂亚油酸含量变化显著,油酸含量先升高后降低,饱和脂肪酸含量呈现递增趋势。15~30 d亚油酸含量急剧下降,30 d后油酸含量下降。氧化期间,亚油酸含量减少71.99%,油酸含量增加7.33%,饱和脂肪酸含量增加1.34倍。同时,在两种氧化条件下均未发现氢过氧化物信号峰出现,加速氧化油样在第18d时呈现次级氧化产物信号峰。
由1H NMR指纹图谱结合PLS-DA对薏苡仁油分子在室温和加速氧化条件下进行模式识别分析的结果可知,1H NMR指纹图谱能很好地表征薏苡仁油分子的氧化变化,信号灵敏度高,与化学计量学方法相结合构建定性分析模型,能够更准确地反映油脂氧化的内在品质变化,所构建的模型能准确对油脂进行分类和鉴别,可为薏苡仁油质量控制和品质评价提供实验依据和技术参考。
References
1 Xi X J,Zhu Y G,Tong Y P,Yang X L,Tang N N,Ma S M,Li S,Cheng Z. Plos One,2016,11(4): e0153269
2 Zhu F. Trends Food Sci. Tech.,2017,61: 160-175
3 WANG Qing-Xia,YU Jia-Hao,ZHANG Lian-Fu. China Oils and Fats,2018,43(08): 63-67,75
王青霞,余佳浩,张连富. 中国油脂,2018,43(08): 63-67,75
4 Zhang P R,Meng X Y,Tang X H. Support. Care Cancer,2019,27: 461-465
5 Zhan Y P,Huang X E,Cao J,Lu Y Y,Wu X Y,Liu J,Xu X,Xiang J,Ye L H. Asian Pac. J. Cancer Prevent.,2012,13(10): 5319-5321
6 Qu D,He J J,Liu C Y,Zhou J,Chen Y. Int. J. Nanomed.,2014,9: 109-119
7 Qu D,Liu M J,Huang M M,Wang L X,Chen Y,Liu C Y,Liu Y P. Int. J. Nanomed.,2017,12: 2045-2059
8 LUAN Lin-Lin,LU Hong-Mei,CHEN Li,YANG Feng-Yi,WU Yu-Zhang,MOU Can-Can. Food & Machinery,2019,35(3): 149-154
栾琳琳,卢红梅,陈 莉,杨凤仪,吴煜樟,牟灿灿. 食品与机械,2019,35(3): 149-154
9 Zeb A,Rahman S U. Food Funct.,2017,8(1): 429-436
10 XIA Jing,SHI Rui,ZHANG Jing-Mei,ZHAO Yi-He. China Oils and Fats,2017,42(6): 9-11
夏 菁,施 蕊,张静美,赵一鹤. 中国油脂,2017,42(6): 9-11
11 ZHAO Ze-Wei,DING Zhu-Hong,GU Yuan-Ting,DING Xiao-Juan. Food Science,2019,40(16): 220-226
赵泽伟,丁筑红,顾苑婷,丁小娟. 食品科学,2019,40(16): 220-226
12 XIAO Xiao-Nian,LIU Yuan-Jie,YI Xing,HU Shao-Hua,XIONG Hua. Food Science,2009,30(21): 43-45
肖小年,刘媛洁,易 醒,胡少华,熊 华. 食品科学,2009,30(21): 43-45
13 Cao J,Deng L,Zhu X M,Fan Y,Hu J N,Li J,Deng Z Y. J. Agr. Food Chem.,2014,62(52): 12545-12552
14 Mohdaly A A A,Sarhan M A,Mahmoud A,Ramadan M F,Smetanskaa I. Food Chem.,2010,123(4): 1019-1026
15 Li H Y,Fan Y W,Li J,Tang L,Hu J N,Deng Z Y. J. Food Sci.,2013,78(4): H633-H641
16 Iqbal S,Bhanger M. Food Chem.,2007,100(1): 246-254
17 Martínez-Yusta A,Goicoechea E,Guillén M D. Compr. Rev. Food Sci. Food Safe.,2014,13(5): 838-859
18 Guillén M D,Goicoechea E. J. Agr. Food Chem.,2007,55(26): 10729-10736
19 SHI Ting,CHEN Qian,YAN Xiao-Li,ZHU Meng-Ting,CHEN Yi,XIE Ming-Yong. Food Science,2018,39(22): 241-248
石 婷,陈 倩,闫小丽,朱梦婷,陈 奕,谢明勇. 食品科学,2018,39(22): 241-248
20 Martin-Rubio A S,Sopelana P,Ibargoitia M L,Guillén M D. Food Chem.,2018,245: 312-323
21 Guillén M D,Uriarte P S. J. Agr. Food Chem.,2009,57(17): 7790-7799
22 Guillén M D,Ruiz A. Eur. J. Lipid. Sci. Tech.,2003,105(11): 688-696
23 LI Tian-Bao,WU Yue,LUO Jing. Food Science,2014,35(16): 212-216
李添寶,吴 越,罗 敬. 食品科学,2014,35(16): 212-216
24 Goicoechea E,Guillen M D. J. Agr. Food Chem.,2010,58(10): 6234-6245
25 Triba M N,Le Moyec L,Amathieu R,Goossens C,Bouchemal N,Nahon P,Rutledgee D N. Mol. Biosyst.,2014,11(1): 13-19
26 Shi T,Zhu M T,Chen Y,Yan X L,Chen Q,Wu X L,Lin J G,Xie M Y. Food Chem.,2018,242: 308-315
27 Guillén M D,Cabo N,Ibargoitia M L,Ruiz A. J. Agr. Food Chem.,2005,53(4): 1093-1101
28 WANG Hai-Ze,ZHAO Zhong,QU Mei,ZHU Hai-Lan. J. Northwest A&F Univ.(Nat.Sci.Ed.),2014,42(1): 72-77
王海泽,赵 忠,渠 美,朱海兰. 西北农林科技大学学报(自然科学版),2014,42(1): 72-77
29 Smith S A,King R E,Min D B. Food Chem.,2007,102(4): 1208-1213
30 Hu A J,Zhang Z H,Zheng J,Wang Y M,Chen Q X,Liu R,Liu X,Zhang S J. Innov. Food Sci. Emerg.,2012,13: 128-133
31 Guillén M D,Uriarte P S. Food Control,2012,28(1): 59-68
32 LU Hai-Yan,WANG Xin,ZHAO Ting-Ting,LIU Bao-Lin. Modern Food Sci. Tech.,2014,30(8): 43-50
卢海燕,王 欣,赵婷婷,刘宝林. 现代食品科技,2014,30(8): 43-50
33 Choe E,Min D. Compr. Rev. Food Sci. Food Safe.,2006,5(4): 169-186

