基于适配体/金纳米粒子的“开-关”型荧光探针快速测定水胺硫磷
邹小波 蒋彩萍 李志华 孙悦 石吉勇 李艳肖 黄晓玮 张迪 胡雪桃 翟晓东 魏晓鸥
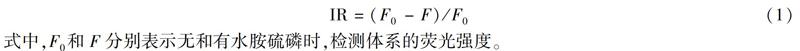

摘 要 基于适配体和金纳米粒子(Gold nanoparticles,AuNPs)合成“开-关”型荧光探针,用于快速、灵敏、高选择性测定水胺硫磷。5'端连接荧光素(6-Carboxyfluorescein,FAM)的发卡型水胺硫磷适配体互补链(Complementary strand,cDNA)通过修饰于3'端的巯基连接到AuNPs表面,FAM(荧光信号分子)与AuNPs(荧光猝灭剂)间发生荧光共振能量转移效应 (Fluorescence resonance energy transfer,FRET),导致荧光猝灭。加入水胺硫磷适配体(Isocarbophos-binding aptamer,ICP-Aptamer)与cDNA杂交,cDNA发卡构型被打开,使荧光信号恢复。当体系中存在水胺硫磷时,ICP-Aptamer与其特异性结合,导致与cDNA解离,cDNA发卡型结构重新恢复,使荧光信号猝灭。采用透射电镜、紫外-可见光谱、Zeta电位表征纳米粒子特性,优化了实验参数,包括pH值、ICP-Aptamer浓度、温育时间和温育温度。在优化的实验条件下,在0.02~10 μmol/L线性范围内,水胺硫磷浓度与荧光抑制率呈良好的线性关系,检出限为17.8 nmol/L(3σ)。将此荧光探针应于大米、菠菜样品中水胺硫磷的测定,回收率均为92.9%~107.0%,相对标准偏差小于4.2%,表明此荧光探针在农药的检测和食品安全的监测中具有潜在的应用价值。
关键词 荧光探针;“开-关”型;适配体;金纳米粒子;水胺硫磷
1 引 言
有機磷农药作为应用最广泛的一类化学农药,常被用作杀菌剂、除草剂和杀虫剂[1]。然而,由于有机磷农药的半衰期长,不当的使用及处理均会导致其在农作物、环境和水资源中残留,甚至会通过食物链富集于人畜体内,危害人体健康,导致不孕、呼吸系统疾病、神经系统疾病等[2]。水胺硫磷是一种被普遍应用的乙酰胆碱酯酶抑制剂有机磷农药,具有广谱的高杀虫毒性,主要用于防治鳞翅目、同翅目和螨类害虫。由于其高毒性,水胺硫磷虽仍广泛施用于棉花和水稻作物中,但现已被我国禁用于果蔬和茶叶中[3]。然而,在一些地区,水胺硫磷仍被发现大量残留于果蔬、大米等多种农作物中。因此,建立快速、灵敏、简便、高效的检测方法对于保障食品安全具有重要意义。
目前,对水胺硫磷的检测主要采用仪器分析技术[4],例如高效液相色谱法(High performance liquid chromatography,HPLC[5])、气相色谱-质谱联用法(Gas chromatography-mass spectroscopy,GC-MS[6])等,以及免疫学检测技术例如酶联免疫吸附法[7]、免疫亲和柱法[8]等。 这些分析方法分离能力高、灵敏度高、定量精确,但样品前处理过程复杂、成本高、费时长,需专业人员操作处理。与荧光光谱法[9]、拉曼光谱法[10]以及电化学信号[11]相结合的纳米探针,因其具有响应速度快、成本低、特异性好等特点而备受关注。纳米生物探针结合了纳米材料与生物活性物质,采用酶[12]、抗体[13]等生物分子作为识别元件,特异性识别待检测物质;同时,基于纳米材料(如金纳米粒子[13]、碳量子点[14~15]、石墨烯[16~17]、聚苯胺[18]、磁性纳米粒子[19~20]等)转换或增强其传感信号。
酶、抗体等生物活性分子制备困难,对环境因素敏感,对检测的准确性有较大影响。功能性核酸(如适配体)因具有易于制备、低免疫原性、高化学稳定性等优点,已经成为研究的热点[21]。Taghdisi等[22]制备了基于金纳米粒子(Gold nanoparticles,AuNPs)、发卡型结构的适配体互补链以及硫堇的电化学适配体探针,当目标物Pb2+存在时,适配体互补链形成发卡结构,硫堇-AuNPs络合物无法与其复合,导致体系产生微弱的电化学信号;当不存在目标物Pb2+时,硫堇-AuNPs络合物与适配体互补链共轭复合,体系产生强电化学信号。Emrani等[23]构建了以发卡型结构的适配体体系为识别元件的荧光探针,用于检测可卡因,检出限低至0.07 ng/mL。
本研究以6-羧基荧光素(6-Carboxyfluorescein,FAM)为荧光信号分子,AuNPs为荧光猝灭剂,水胺硫磷适配体(Isocarbophos-binding aptamer,ICP-Aptamer)为识别元件,发卡型水胺硫磷适配体互补链(Complementary strand,cDNA)为结构型“信号开关”,制备了可特异性识别水胺硫磷的“开-关”型荧光探针。此荧光探针通过发卡型cDNA的构型变化,以及FAM-AuNPs供受体间的荧光共振能量转移效应(Fluorescence resonance energy transfer,FRET),将水胺硫磷的含量信息转变为相应的荧光信号,实现水胺硫磷的定量检测,并将此“开-关”型荧光探针用于大米和菠菜中水胺硫磷的定量检测。
2 实验方法
2.1 仪器、试剂与材料
VIS-7220N可见分光光度仪(北京瑞利分析仪器有限公司);F-98荧光分光光度计(上海棱光技术有限公司);QuantaMasterTM 40荧光光谱仪(美国PTI公司);JEM-2100透射电子显微镜(TEM,日本电子株式会社);Nano ZS90纳米粒度仪及Zeta电位仪(英国马尔文公司);TGL-15B高速离心机(上海安亭科学仪器厂)。
HAuCl4·4H2O、柠檬酸三钠、十二烷基硫酸钠、三(2-羧乙基)膦盐酸盐(Tris (2-carboxyethyl) phosphine hydrochloride,TCEP)、二水合双(对-磺酰苯基)苯基膦化二钾盐(Bis (p-sulfonatophenyl) phenylphosphine dihydrate dipotassium salt,BSPP)、三(羟甲基)氨基甲烷(Tris-HCl)等试剂均购自镇江华东器化玻有限公司。ICP-Aptamer (序列5'-AAGCTTGCTTTATAGCCTGCAGCGATTCTTGATCGGAAAAGGCTGAGAGCTACGC-3')、5'和3'端分别修饰有FAM、巯基的cDNA(序列5'-FAM-CTGCACAAGAATCGCTGCAG-C3-SH-3')[24]由生工生物工程(上海)股份有限公司合成。水胺硫磷、毒死蜱、敌敌畏、乐果、马拉硫磷、甲基对硫磷、辛硫磷、三唑磷、敌百虫、啶虫脒、吡虫啉等农药标准品均购于北京世纪奥科生物技术有限公司。所用试剂均为分析纯,实验用水为采用Easypure 超纯水系统纯化的超纯水。
大米、菠菜样品购自镇江市超市。
2.2 “开-关”型荧光探针的制备
2.2.1 AuNPs的制备 参考Frens-Turkevich方法[25]并稍作改进,通过柠檬酸盐还原HAuCl4·4H2O的方法制备13 nm AuNPs。将10 mL 1 mmol/L HAuCl4·4H2O溶液加入带有回流冷凝器的圆底烧瓶中,置于恒温电磁搅拌器,水浴加热至剧烈沸腾,迅速加入1 mL 60 mmol/L 柠檬酸三钠,溶液颜色由淡黄色变为无色。在100℃条件下剧烈搅拌15 min,至溶液变为酒红色。停止加热,冷却至室温。加入3 mg BSPP,并继续搅拌15 min,防止颗粒聚集。将得到的AuNPs过0.22 μm滤膜,于4℃保存,备用。
2.2.2 荧光探针的制备 将合成的AuNPs以10000 r/min离心15 min,弃去上清液,将沉淀物重悬于4.5 mL 10 mmol/L磷酸盐缓冲溶液(PBS,pH 8.0,含0.01% 十二烷基硫酸钠(SDS))。将10 μL 500 mmol/L醋酸缓冲溶液(pH 5.2)、20 μL 10 mmol/L TCEP(现配现用)和100 μL 100 μmol/L cDNA混合均匀,在室温下孵育1 h,然后与上述AuNPs溶液混合,室温下避光孵育过夜。
向上述反应溶液中加入50 μL 10 mmol/L PBS (pH 8.0,0.01% SDS,100 mmol/L NaCl),在室温下孵育30 min,使cDNA与AuNPs复合。5000 r/min离心10 min,去除多余的cDNA。
将cDNA-AuNPs复合物重悬于10 mmol/L PBS(pH 8.0)中,使cDNA-AuNPs复合物终浓度为500 nmol/L。 在500 μL上述复合溶液中[26,27],加入10 μL 40 μmol/L ICP-Aptamer和10 μL 10 mmol/L PBS(pH 8.0,50 mmol/L NaCl,10 mmol/L KCl,10 mol/L MgCl2,50 mmol/L Tris),60℃温育10 min,冷却至室温,即达到荧光探针溶液的动态平衡。
2.3 水胺硫磷的检测
将不同浓度的水胺硫磷标准溶液(0.02、0.04、0.06、0.08、0.1、0.2、0.4、0.6、0.8、1.0、2.0、4.0、6.0、8.0和10.0 μmol/L)分别与上述荧光探针溶液混合,静置10 min,测定荧光光谱,激发波长为495 nm。 按公式(1)计算荧光抑制率(Inhibition ratio,IR),重复实验3次,取平均值。
2.4 大米和菠菜样品中水胺硫磷的检测
在10 g大米样品中加入5 mL去离子水和20 mL乙腈,匀浆10 min后,再超声处理30 min,使其混合均匀。过滤,65℃旋转蒸发,进行浓缩。用PBS(pH 8.0)将浓缩液稀释100倍,过0.22 μm滤膜,备用。菠菜样品的预处理方法与大米样品一致。按照2.3节方法对样品中水胺硫磷进行检测,并进行加标回收实验。
3 结果与分析
3.1 检测原理
基于发卡型cDNA的构型变化以及FAM-AuNPs供受体间的FRET效应的“开-关”型荧光探针检测水胺硫磷的原理如图1所示。其中,ICP-Aptamer为识别元件,FAM为荧光信号分子,AuNPs为荧光猝灭剂,cDNA为结构型“信号开关”。
3'端的巯基将发卡型cDNA通过AuS键连接到AuNPs上。由于发卡型cDNA5'端荧光信号分子FAM靠近猝灭剂AuNPs的表面,FAM与AuNPs之间的FRET效应成功猝灭了FAM的荧光信号。随着ICP-Aptamer的加入,ICP-Aptamer与cDNA互补杂交,cDNA发卡型结构被打开,FAM远离AuNPs表面,不再发生FRET,因此,伴随显著的荧光“开启”,在495 nm激发波长下的FAM荧光信号恢复。当检测体系中加入靶标水胺硫磷后,ICP-aptamer与水胺硫磷之间的特异性亲和力使得ICP-aptamer优先与水胺硫磷结合,从而造成ICP-aptamer与互补的cDNA发生解链,cDNA发卡型结构重新恢复,FAM与AuNPs之间的FRET效应使荧光信号猝灭,荧光“关闭”。
3.2 AuNPs和荧光探针的表征
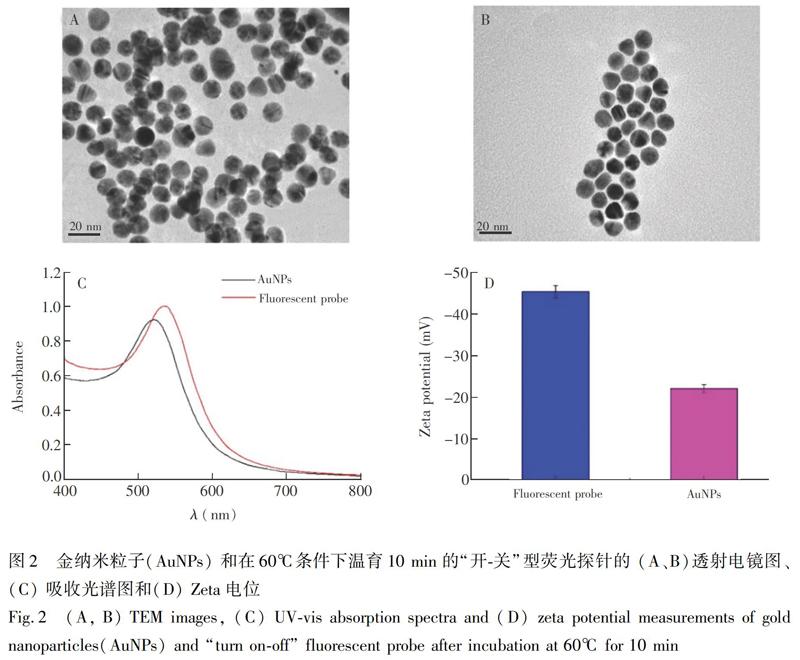
如图2A和2B的电镜图所示,所制备的AuNPs呈现良好的单分散状态。随着发卡型cDNA组装到AuNPs表面,复合粒子的水动力半径由12.8 nm增加到19.8 nm。由于ICP-Aptamer体系的相对刚性结构对体系的保护以及体系达到的动态平衡,复合粒子趋于规则且稳定的条带状分布。由图2C可知,随着AuNPs和cDNA的复合,复合粒子的共振吸收峰相比AuNPs发生红移(由521 nm红移至534 nm),峰强变强,进一步表明发卡型cDNA成功修饰到了AuNPs表面[28]。通过测定Zeta电位值可进一步探明AuNPs和cDNA复合过程中体系的稳定性和复合粒子的表面状况[29]。所制备的AuNPs表面带负电(22.07 mV),当发卡型cDNA通过巯基连接到AuNPs上时,Zeta电位为45.48 mV,體系状态逐渐趋于平衡和稳定,复合粒子粒径变大。
3.3 荧光共振能量转移体系
“开-关”型荧光探针通过cDNA-AuNPs供受体间的荧光共振能量转移(FRET)效应[30,31],实现检测体系荧光信号的“开启”和“关闭”。在此检测体系中,FAM作为荧光供体,AuNPs作为受体。如图3A所示,FAM的荧光发射峰和AuNPs的紫外吸收峰分别为518和521 nm,两峰几乎完全重叠;当cDNA通过3'端的巯基连接到AuNPs上时,cDNA由于自身碱基互补配对形成发夹型结构,5'端连接的FAM靠近AuNPs,AuNPs猝灭FAM荧光。通过公式(2)估算FRET猝灭效率(Q):
式中,F0' 表示FAM的荧光强度,F'为FAM-AuNPs复合粒子的荧光强度,B是背景荧光强度。
加入AuNPs后,Q>83%,表明 AuNPs 对 FAM荧光有较好的猝灭作用。荧光寿命可作为评判一個FRET体系的关键因素,通过图3B可从荧光寿命衰减动力学角度分析cDNA-AuNPs 的FRET体系。加入AuNPs后,FAM的荧光寿命由4.11 ns下降为3.37 ns,且荧光被有效猝灭,表明FAM-AuNPs供受体间为动态猝灭[32]。
3.4 实验条件的优化
pH值、ICP-Aptamer浓度、温育时间和温育温度等因素均会影响荧光探针检测灵敏性和准确性。除pH值、ICP-Aptamer浓度、温育时间、温育温度以外,固定其它实验条件,向反应溶液加入适量 5 μmol/L水胺硫磷溶液,混合均匀。在同一体系中,通过比较荧光抑制率衡量荧光探针性能。在pH 5.0~11.0范围内,测定不同pH值下检测体系在水胺硫磷加入后的的荧光抑制率,结果如图4A所示,当体系pH值为8.0时,其荧光抑制率最大;当pH值过高或过低时,由强酸碱或高离子强度引起的屏蔽效应、AuNPs的团聚现象等均会抑制FRET猝灭效率。由图4B可知,加入10 μL ICP-Aptamer时,体系的荧光抑制率达到最大,这可能是因为ICP-Aptamer与DNA的杂交趋于饱和,继续增加ICP-Aptamer含量,体系荧光抑制率基本不变。当温育时间和温育温度分别为10 min(图4C)和60℃(图4D)时,体系荧光抑制率达到最大值。
3.5 “开-关”型荧光探针对水胺硫磷的灵敏检测
在优化的实验条件下,将“开-关”型荧光探针用于水胺硫磷的检测。如图5所示,在0.02~10 μmol/L的浓度范围内,随着水胺硫磷浓度的增大,检测体系在518 nm处荧光值逐渐降低,荧光抑制率与水胺硫磷浓度呈良好的线性关系,回归方程为y=0.015x + 0.769 (R2=0.998),检出限(LOD)为17.8 nmol/L (3σ),低于大多数文献报道的方法 (表1)。
3.6 “开-关”型荧光探针对水胺硫磷的选择性
在相同的实验条件下,测定“开-关”型荧光探针对水胺硫磷、毒死蜱、敌敌畏、乐果、马拉硫磷、甲基对硫磷、辛硫磷、三唑磷、敌百虫、啶虫脒、吡虫啉等农药的荧光信号,水胺硫磷的浓度为5 μmol/L,其它农药的浓度为50 μmol/L。 如图6所示,对水胺硫磷,检测体系的荧光强度发生显著变化,荧光抑制率为84%,检测其它农药时,检测体系荧光强度均无明显变化,荧光抑制率较低。结果表明,“开-关”型荧光探针对水胺硫磷有较好的选择性与特异性,这主要归因于ICP-Aptamer特有的核苷酸序列,以及特异性结合靶标前后特有的二级、三级结构,即ICP-Aptamer对水胺硫磷所具有的特异性识别的茎、环结构以及在特异性识别过程中结构的旋转与折叠等[24]。
3.7 大米、菠菜样品中水胺硫磷的检测
采用“开-关”型荧光探针检测大米、菠菜样品中的水胺硫磷,评估其在检测实际样品中水胺硫磷的可行性。同时,采用气相色谱法(GC)测定水胺硫磷含量。大米、菠菜样品中未检出水胺硫磷,5个添加水平下的加标回收实验结果如表2所示,回收率为92.9%~107.0%,相对标准偏差(RSD)小于4.2%,检测结果与GC方法一致。结果表明,本研究建立的基于适配体/金纳米粒子的“开-关”型荧光探针用于水胺硫磷含量的测定,具有较好精确度和准确度。
4 结 论
基于水胺硫磷的适配体和金纳米粒子,制备了“开-关”型荧光探针,在0.02~10 μmol/L的浓度范围内,水胺硫磷浓度与荧光抑制率呈良好的线性关系。将此探针用于大米和菠菜样品中水胺硫磷的检测,其结果与气相色谱法具有较好的一致性。此荧光探针具有检出限低、操作简单、灵敏度高、准确度高、重现性好的特点,在农药等痕量物质的分析测定中具有良好的应用前景。
References
1 Pundir C S,Malik A,Preety. Biosens. Bioelectron.,2019,140: 111348
2 Qiu L H,Lv P,Zhao C L,Feng X Y,Fang G Z,Liu J F,Wang S. Sens. Actuators B,2019,286: 386-393
3 Jia M,Wang Y,Teng M M,Wang D Z,Yan J,Miao J Y,Zhou Z Q,Zhu W T. Ecotox. Environ. Safe.,2018,163: 1-6
4 GB 24753-2009,Isocarbophos Technical. National Standards of the People's Republic of China水胺硫磷原药. 中华人民共和国国家标准. GB 24753-2009
5 Timofeeva I,Shishov A,Kanashina D,Dzema D,Bulatov A. Talanta,2017,167: 761-767
6 Taha S M,Gadalla S A. Talanta,2017,174: 767-779
7 Zhang C,Cui H Y,Han Y F,Yu F F,Shi X M. Food Chem.,2018,240: 893-897
8 Senyuva H Z,Gilbert J. J. Chromatogr. B,2010,878 (2): 115-132
9 Pan J F,Li Q,Zhou D H,Chen J H. Talanta,2018,189: 370-376
10 Sun Y,Li Z H,Huang X W,Zhang D,Zou X B,Shi J Y,Zhai X D,Jiang C P,Wei X O,Liu T T. Biosens. Bioelectron.,2019,145,111672
11 Fu J Y,An X S,Yao Y,Guo Y M,Sun X. Sens. Actuators B,2019,287: 503-509
12 Jia L P,Zhou Y X,Wu K P,Feng Q L,Wang C M,He P. Bioelectrochemistry,2020,131: 107392
13 Pérez-Fernández B,Mercader J V,Abad-Fuentes A,Checa-Orrego B I,Costa-Garcia A,de la Escosura-Muiz A,Costa-García A. Talanta,2019,209: 120465
14 Hu X T,Shi J Y,Shi Y Q,Zou X B,Tahir H E,Holmes M,Zhang W,Huang X W,Li Z H,Xu Y W. Meat Sci.,2019,147: 127-134
15 ZOU Xiao-Bo,SHI Yong-Qiang,ZHENG Yue,SHI Ji-Yong,HU Xue-Tao,JIANG Cai-Ping,HUANG Xiao-Wei,XU Yi-Wei. Chiness J. Anal. Chem.,2018,46(6): 960-968
鄒小波,史永强,郑 悦,石吉勇,胡雪桃,蒋彩萍,黄晓玮,徐艺伟. 分析化学,2018,46(6): 960-968
16 Zhang W,Xu Y W,Zou X B. Food Chem.,2018,261: 1-7
17 Li Z H,Zhou X C,Wang K,Zou X B,Shi J Y,Huang X Y,Holmes M. Innov. Food Sci. Emerg.,2015,31: 196-203
18 Li Z H,Zhou X C,Shi J Y,Zou X B,Huang X Y,Tahir H E. Food Chem.,2019,276: 291-297
19 Xu X C,Niu X H,Wu S W,Zou X B,Pan J M. Sens. Actuators B,2018,268: 430-437
20 ZHANG Jing-Jing,KANG Tian-Fang,LU Li-Ping,CHENG Shui-Yuan. Anal. Chem.,2016,44 (5): 760-766
张晶晶,康天放,鲁理平,程水源. 分析化学,2016,44 (5): 760-766
21 ZOU Xue-Mei,ZHOU Jia-Wei,SONG Shang-Hong,CHEN Guan-Hua. Anal. Chem.,2019,47 (4): 488-499
邹雪梅,周佳伟,宋尚红,陈冠华. 分析化学,2019,47 (4): 488-499
22 Taghdisi S M,Danesh N M,Lavaee P,Ramezani M,Abnous K. Sens. Actuators B,2016,234: 462-469
23 Emrani A S,Danesh N M,Ramezani M,Taghdisi S M,Abnous K. Biosens. Bioelectron.,2016,79: 288-293
24 Zhang C Z,Wang L,Tu Z,Sun X,He Q H,Lei Z J,Xu C X,Liu Y,Zhang X,Yang J Y,Liu X J,Xu Y. Biosens. Bioelectron.,2014,55: 216-219
25 Turkevich J,Stevenson P C,Hillier J. Discuss. Faraday Soc.,1951,11: 55-75
26 Tang T T,Deng J J,Zhang M,Shi G Y,Zhou T S. Talanta,2016,146,55-61
27 Yao G B,Pei H,Li J,Zhao Y,Zhu D,Zhang Y N,Lin Y F,Huang Q,Fan C H. NPG Asia Mater.,2015,7 (1): e159
28 Haiss W,Thanh N T K,Aveyard J,Fernig D G. Anal. Chem.,2007,79 (11): 4215-4221
29 Asati A,Santra S,Kaittanis C,Perez J M. ACS Nano,2010,4 (9): 5321-5331
30 Liu B Y,Zeng F,Wu S Z,Wang J S,Tang F C. Microchim. Acta,2013,180 (9): 845-853
31 Hu X T,Shi J Y,Shi Y Q,Zou X B,Arslan M,Zhang W,Huang X W,Li Z H,Xu Y Y. Food Chem.,2019,272: 58-65
32 Wang L,Li H,Yang Y,Zhang D,Wu M,Pan B,Xing B S. Water Res.,2017,122: 337-344
33 WANG Li,YE Hua,SANG Hong-Qing,WANG Dan-Dan. Chinese J.Anal. Chem.,2016,44 (5): 799-803
王 丽,叶 华,桑宏庆,王丹丹. 分析化学,2016,44 (5): 799-803
34 Yan X N,Deng J,Xu J S,Li H,Wang L L,Chen D,Xie J. Sens. Actuators B,2012,171-172: 1087-1094
35 Shi Q W,Teng Y J,Zhang Y C,Liu W H. Chinese Chem. Lett.,2018,29 (9): 1379-1382
36 Pang S,Labuza T P,He L L. Analyst,2014,139: 1895-1901
37 Bai W H,Zhu C,Liu J C,Yan M M,Yang S M,Chen A L. Environ. Toxicol.Chem.,2015,34 (10): 2244-2249

