香水百合不定芽诱导及再生体系的建立
(1.凯里学院大健康学院, 贵州 凯里 556011; 2.四川农业大学风景园林学院, 成都 611130)
香水百合(LiliumcasaBlanca)是世界各地广泛应用的切花材料,其原产地为喜马拉雅山区、澳洲等各个地区。国内切花种植以北京、上海、广州及云南等地区为主,其中云南百合产量占全国花卉总产量的50%[1]。百合传统繁殖技术主要是分株、扦插、包埋等方法,这些方法不仅繁殖系数较小,需要时间较长,难以满足生产需要和市场需求,而且这些方法极易产生种性退化,易感染病毒,影响百合的产量和质量[2]。研究表明:百合组织培养可脱毒快繁,是百合无毒化、商品化和产业化发展的必然趋势[3]。
相关研究表明,百合离体培养体系是百合脱毒快繁能否成功的关键。Park[4]对不同百合品种以及同一品种不同部位分化能力研究,结果表明,百合分化能力由强到弱为鳞片>根>叶片。王亚斌等对百合幼胚进行离体培养研究得出,pH值对百合幼胚的萌发及成苗有一定影响,pH值为5.0最好[5]。罗凤霞等研究发现,MS培养基优于SH培养基[6]。研究表明,百合鳞片、叶片、茎段、花瓣等都可作为组织培养的材料,其中鳞片是目前普遍采用的优良外植体,常用的消毒灭菌剂主要有乙醇(C2H5OH)、升汞(HgCl2)、次氯酸钠(NaClO)、抗菌素等[7]。在百合组织培养过程中,再生体系建立的关键是成功诱导出不定芽,不定芽的诱导过程通常需要NAA和6-BA的参与调节[8],6-BA的使用浓度通常为0.2~3.0 mg·L-1,而NAA为0.005~1.0 mg·L-1[9]。NAA和6-BA的适宜浓度配比,会使芽的诱导和增殖达到最高比率[10]。百合生根培养一般采用1/2 MS培养基[11],并附加适宜浓度的NAA、IBA或IAA[12],也有部分使用MS培养基,为有效促进百合生根,有时需要在培养基里面添加活性炭。
香水百合为杂交种,有性繁殖后代易出现性分离,并且播种苗生育周期较长,常规采用分株芽、扦插等无性繁殖方法进行繁殖,但繁殖系数较低,种球容易退化[13]。采用植物组织培养技术能够快速繁殖的目的,同时便于生产,具有不受季节、地区等影响,这些优势弥补了传统繁殖技术的不足[14]。目前,香水百合组培主要是以鳞茎、叶片、花器官等作为外植体建立再生体系[15-17]。
基于以上问题,本试验以香水百合的鳞片作为材料,MS作为诱导、增殖基础培养基,1/2 MS为生根基础培养基,并添加6-BA、NAA、IBA不同激素配比,探究激素不同种类和浓度对香水百合再生体系建立的影响,以期获得香水百合最适诱导不定芽、增殖以及生根的培养基,进一步为香水百合快速繁殖提供一些参考和借鉴。
1 材料与方法
1.1 材 料
本试验材料采自凯里学院实验楼旁山地种植的香水百合植株(北纬26°、东经107°53′、气压92.78 kPa、海拔743.0 m),挑选翠绿、健壮的植株,将其鳞茎挖出,清水洗去外层泥土,去掉最外层受损、腐烂的鳞片,挑选靠外层饱满、完好的鳞片待用。
1.2 仪器与试剂
仪器主要有高压蒸汽灭菌锅(YXQ-LS-75 SII,上海博迅实业有限公司)、蒸馏水器(YN-ZD,上海博迅实业有限公司)、超净工作台(JH-1,北京科伟永兴仪器有限公司)、冰箱(BCD-268 TN,青岛海尔股份有限公司)、空调(KFR-72 LW,青岛海尔空调器有限总公司)、电子天平(AR 224 CN,奥豪斯仪器有限公司)、游标卡尺(0~200 mm游标卡尺,上海量具刃具厂)。
主要试剂有大量元素、钙盐、微量元素、有机元素、铁盐、无水乙醇(AR,重庆川东化工有限公司)、工业乙醇(AR,重庆川东化工有限公司)、0.1% HgCl2(100 g,上海化学试剂采购供应站)、琼脂(500 g,杭州木木生物科技有限公司)、蔗糖(500 g,科密欧化学试剂有限公司)、1 mol·L-1KOH溶液、吐温80、蒸馏水等;激素有0.5 mg·mL-16-BA、NAA和IBA。
1.3 试验方法
1.3.1外植体的消毒
将挑选完好的鳞片置于烧杯,流水冲洗2 h,蒸馏水洗2~3次,再转移到超净工作台内75% C2H5OH处理30 s,无菌水洗2~3次,然后用0.1% HgCl2加1滴吐温80 处理10 min,再用无菌水洗3~5次。
1.3.2不定芽的诱导
以MS为基本培养基,把消毒灭菌好的百合鳞片每块切成3~4小块,约0.5 cm×0.5 cm,小块四周都有切口。根据其形态学特征,将凹面朝上,分别接种于6-BA与NAA组合的两因素三水平完全随机试验的L9(32)中(表1),每瓶2~3块,每个配方接种5瓶。置于培养室内25 ℃培养,湿度为70%~80%,光照培养16 h、黑暗培养8 h(增殖和生根培养与该培养条件一致),每3 d进行观察、记录,统计不定芽诱导情况。
诱导率(%)=(诱导出芽块数/总接种数)×100%
1.3.3不定芽的增殖培养
以MS为基本培养基,选取生长良好、健壮的不定芽分别接种于6-BA与NAA 随机组合的5个配方中(表2),每瓶接种1株不定芽,每个配方重复5次。培养30 d后,观察不定芽增殖和生长情况,统计增殖率及增殖系数。
增殖率(%)=(增殖块数/接种总块数)×100%;

1.3.4生根培养
以1/2 MS为基本培养基,加入4 g·L-1活性炭。增殖分化的丛芽长至3~4 cm时,将其切成单株,挑选生长一致的单苗接种于NAA和IBA单因素两水平随机组合的L4(22)中(表3)。每瓶接种1株,每个配方重复5次。30 d后调查根生长情况,统计生根率及根数,测量根长。
生根数=每个丛芽长出的根条数;
生根率(%)=(生根丛芽数/总接种数)×100%。
1.3.5数据处理
本试验所得数据采用Microsoft Excel 2010软件初步统计,百分数(<30%或>70%)需要经过平方根反正弦Y=ARCSIN(SQRT(X))×180/3.1415926转换,再用SPSS 19.0单因素ANOVA作描述性和方差同质性检验;一般线性模型单因变量,DunCan法(p<0.05和p<0.01)进行方差分析。
2 结果与分析
2.1 不同激素对香水百合不定芽诱导的影响
不同激素诱导香水百合不定芽结果表明,编号为1~9配方(表1)接种3 d鳞片颜色发生变化(图1 A),均能在6 d之内转绿(图1 B),除3和9配方小鳞片未见不定芽长出外,1~8配方能在15 d长出嫩绿色的小芽点,21 d诱导出不定芽(图1 C)。1配方大部分小鳞片均能转绿并且长出嫩绿色小芽点,部分鳞片没有变化,未见不定芽长出。2配方小鳞片转绿后,部分能诱导出较多不定芽,也有部分小鳞片长出绿色的愈伤组织,且长出愈伤组织的小鳞片不能长出不定芽。4配方生长状况良好,但小部分鳞片转绿后未长出不定芽。5配方大部分鳞片诱导出了不定芽,且诱导出的不定芽生长健壮。6配方大部分小鳞片不能诱导出不定芽,一直保持绿色状态,只有少部分分化出不定芽,7配方不定芽诱导情况相对较差,转绿的小鳞片只有小部分诱导出不定芽。
由表1可以看出,1~9配方诱导不定芽均只达到5%水平差异。在5%水平上, 3和9配方均未出芽,但与其他配方诱导率形成显著差异。NAA浓度为0.1 mg·L-1和0.3 mg·L-1,6-BA浓度为1.0 mg·L-1时,促进不定芽的诱导;当6-BA浓度>1.0 mg·L-1会抑制不定芽的诱导。当NAA浓度为0.5 mg·L-1时,6-BA浓度1.5 mg·L-1对不定芽的诱导有一定的促进作用,而6-BA 浓度为2.0 mg·L-1时,3和9配方均出现诱导率为0的情况,说明高浓度的6-BA不利于不定芽的诱导。NAA浓度均为0.3 mg·L-1,同一6-BA浓度为1.0~2.0 mg·L-1时, 诱导率分别为73.33%、60.00%和40.00%,说明NAA浓度为0.3 mg·L-1时,与6-BA不同浓度的组合都适合不定芽的诱导。
表2分析显示,在5%水平上下,NAA和6-BA以及NAA×6-BA交互作用对于不定芽的诱导效果都不显著。NAA的F值是4.415,影响效果大于6-BA和NAA×6-BA交互作用,所以鳞片诱导不定芽的过程中,NAA是主导因子。其主效应顺序依次为NAA>6-BA>NAA×6-BA。

图1 鳞片诱导不定芽
表1 NAA和6-BA对鳞片诱导不定芽的影响

编号NAA/(mg·L-1)6-BA/(mg·L-1)诱导率/%生长情况 10.11.060.00±24.50abA生长良好,大部分小鳞茎长出不定芽,但数量较少。20.11.553.33±22.61abA生长较好,大部分小鳞茎长出较多不定芽,出现少量愈伤。30.12.00.00±0.00bA鳞片变绿,未见不定芽长出。40.31.073.33±19.44aA生长良好,大部分小鳞茎诱导出不定芽。50.31.560.00±24.50abA生长良好,大部分小鳞茎长出较多不定芽。60.32.040.00±24.50abA部分长出不定芽,长势一般。70.51.013.33±8.16abA生长不良,只有很少的一部分长出了不定芽。80.51.520.00±20.00abA生长不好,只有少部分长出不定芽。90.52.00.00±0.00bA鳞片变绿,未见不定芽长出。
注:大、小写字母分别表示0.01和0.05水平。下同。
表2 NAA和6-BA对鳞片诱导不定芽的方差分析
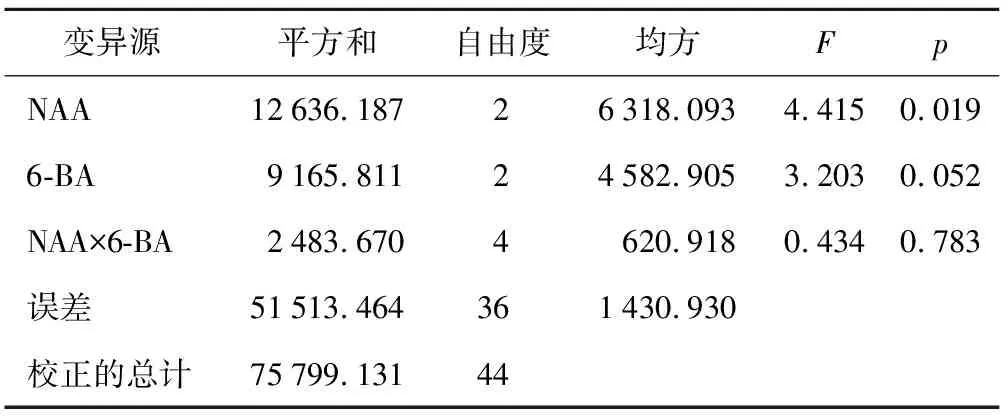
变异源平方和自由度均方FpNAA12636.18726318.0934.4150.0196-BA9165.81124582.9053.2030.052NAA×6-BA2483.6704620.9180.4340.783误差51513.464361430.930校正的总计75799.13144
表3方差分析显示,在5%水平下,NAA浓度0.5 mg·L-1不定芽诱导率显著性低于0.1 mg·L-1和0.3 mg·L-1处理,两两显著性差异均未达到极显著水平,0.1 mg·L-1和0.3 mg·L-1之间差异不显著。当NAA浓度介于0.1~0.3 mg·L-1之间能促进不定芽的诱导,大于0.3 mg·L-1则起抑制作用。在5%水平下,6-BA 1.0 mg·L-1诱导率显著性高于2.0 mg·L-1,显著性差异均未达到极显著水平,诱导率分别为48.90%和13.30%,1.0 mg·L-1和1.5 mg·L-1,1.5 mg·L-1和2.0 mg·L-1差异均不显著。6-BA浓度在1.0~2.0 mg·L-1之间,诱导率分别为48.90%、44.40%和13.30%,由此看出,6-BA浓度超过2.0 mg·L-1对不定芽的诱导有明显的抑制作用。综上所述,诱导不定芽时,NAA浓度0.3 mg·L-1有促进作用,而6-BA高于2.0 mg·L-1,会抑制不定芽的分化,因此确定MS+NAA 0.3 mg·L-1+6-BA 1.0 mg·L-1为本次试验小鳞片诱导不定芽的最佳培养基,诱导率为73.33%。
表3 NAA和6-BA对鳞片诱导不定芽的多重比较分析
2.2 不同激素对香水百合不定芽增殖的影响
接种于编号1(表4)的配方不定芽植株健壮,芽苗翠绿,且长出的不定芽数最多,大部分不定芽都能增殖(图2)。2配方不定芽增殖能力相对较差,只有小部分的不定芽继续增殖,但该配方上生长的不定芽植株较为健壮。接种于3配方上的不定芽芽苗偏细,植株较嫩,但增殖能力较强,能分化出较多不定芽,其增殖效果比1配方好。4配方不定芽增殖能力一般,但芽苗生长健壮,且出现部分不定芽分化较多的情况。5配方上的不定芽植株健壮,叶片翠绿,但只有部分能增殖。
表4 6-BA和NAA对不定芽增殖的影响
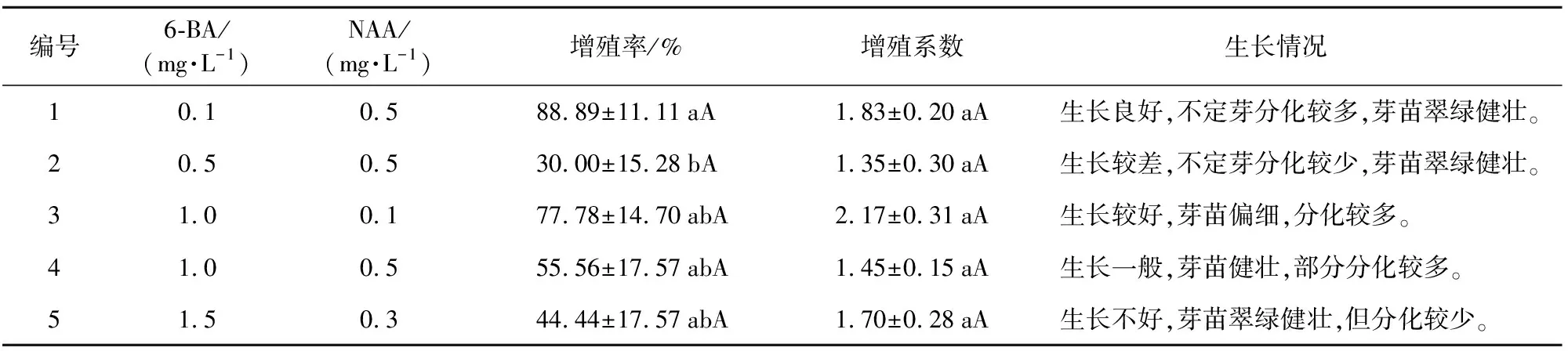
编号6-BA/(mg·L-1)NAA/(mg·L-1)增殖率/%增殖系数生长情况 10.10.588.89±11.11aA1.83±0.20aA生长良好,不定芽分化较多,芽苗翠绿健壮。20.50.530.00±15.28bA1.35±0.30aA生长较差,不定芽分化较少,芽苗翠绿健壮。31.00.177.78±14.70abA2.17±0.31aA生长较好,芽苗偏细,分化较多。41.00.555.56±17.57abA1.45±0.15aA生长一般,芽苗健壮,部分分化较多。51.50.344.44±17.57abA1.70±0.28aA生长不好,芽苗翠绿健壮,但分化较少。

注:A为增殖前;B为增殖30 d。图2 不定芽的增殖
由表4可知,仅在5%水平2配方增殖率显著差异均低于其他配方;增殖系数2个水平均不显著。当6-BA和NAA浓度之比大于1时,其增殖率依次为77.78%、55.56%和44.44%;增殖系数分别是2.17、1.45和1.70,说明6-BA/NAA>1时,不利于不定芽的增殖。而NAA浓度为0.5 mg·L-1和6-BA浓度为0.1 mg·L-1的组合其增殖率高达88.89%,增殖系数是1.83,说明6-BA/NAA<1更有利于促进不定芽的增殖。而NAA和6-BA浓度均为0.5 mg·L-1时,增殖率仅为30%,且增殖系数最低,仅为1.35,说明相同浓度的NAA和6-BA也不利于不定芽的增殖。
表5方差分析显示,在5%水平,仅6-BA对增殖率影响显著且NAA和6-BA无交互作用,其主次效应为6-BA>NAA;6-BA和NAA对增殖系数的影响均不显著,二者无交互作用,其对增殖系数主次效应为NAA>6-BA。
由表6可知,在1%、5%水平差异NAA对增殖率和增殖系数的影响均不显著。NAA在0.1~0.3 mg·L-1之间对不定芽增殖有抑制作用,0.3~0.5 mg·L-1之间,NAA对不定芽增殖有促进作用,当NAA浓度高于0.1 mg·L-1会抑制不定芽增殖系数。6-BA对增殖率的影响仅达到1%水平差异,而对增殖系数的影响2个水平均不显著。6-BA浓度0.1 mg·L-1增殖率显著性差异高于0.5和1.5 mg·L-1处理,增殖率和增殖系数达到最大值,与1 mg·L-1差异不显著。从整体来看,6-BA浓度>0.1 mg·L-1,对增殖率和增殖系数均有抑制作用。
综上所述,6-BA/NAA<1时,为不定芽增殖的最适培养基,即MS+NAA 0.5 mg·L-1+6-BA 0.1 mg·L-1,增殖率高达88.89%,增殖系数为1.83。
2.3 不同激素对香水百合不定芽诱导生根的影响
挑选生长一致的单苗接种于生根培养基,培养30 d,部分苗底部开始长出乳白色幼根,继续培养30 d后,根长得更粗壮且较长,呈绿色,且大部分都长出了密密的根毛;后续长出来的幼根呈乳白色,较短。
1配方在生根培养30 d后,大部分小鳞球底部长出乳白色幼根,再过30 d后观察发现,大部分生根状况良好,根系较为发达,出现绿色根毛,且还长出较多幼根。2配方长出的根较多,生长均匀,但较短,且多呈白色状。3配方在生根培养30 d后,大部分均长出了乳白色幼根,继续培养30 d后,发现根的生长较为均匀,大部分根系生长良好,均变成绿色,长出了少部分幼根。4配方长势相对较差,生根培养30 d后,出现部分幼根,继续培养30 d后,部分转绿,但根系不发达,且较短。
表5 6-BA和NAA对不定芽增殖的多因素方差分析
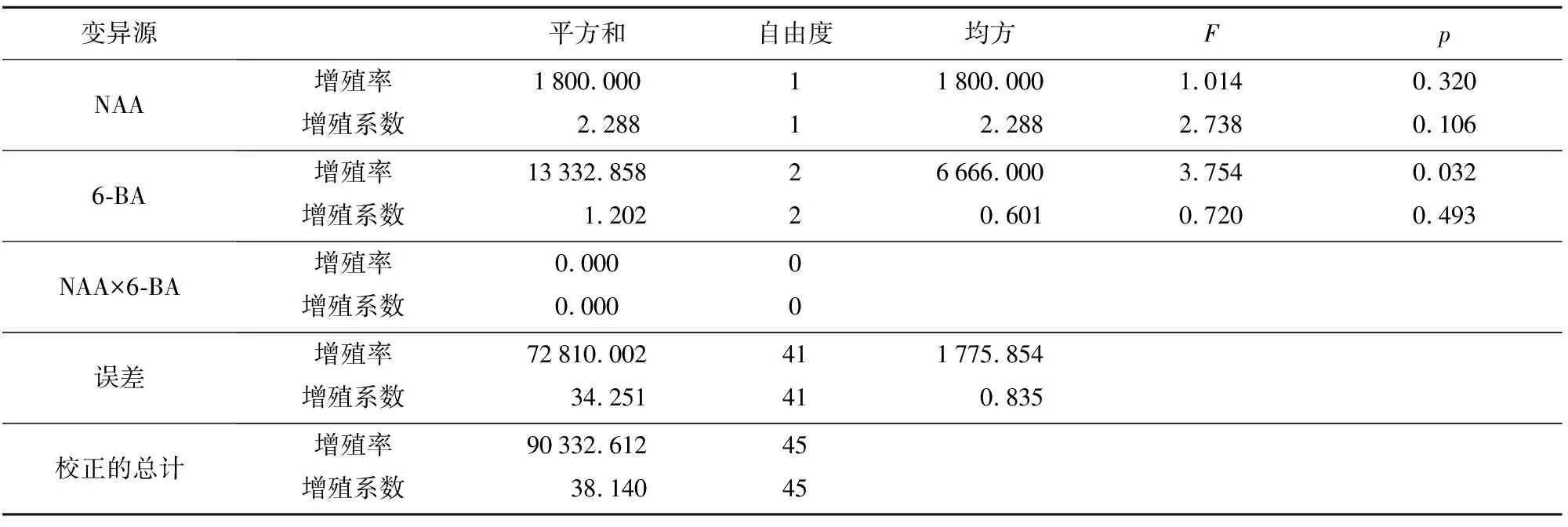
变异源平方和自由度均方FpNAA增殖率1800.00011800.0001.0140.320增殖系数2.28812.2882.7380.1066-BA增殖率13332.85826666.0003.7540.032增殖系数1.20220.6010.7200.493NAA×6-BA增殖率0.0000增殖系数0.0000误差增殖率72810.002411775.854增殖系数34.251410.835校正的总计增殖率90332.61245增殖系数38.14045
表6 不定芽增殖的多重比较检验

NAA/(mg·L-1)增殖率/%增殖系数6-BA/(mg·L-1)增殖率/%增殖系数0.177.78±14.70abA2.17±0.31aA0.188.90±15.60aA1.83±0.31aA0.344.44±17.56aA1.70±0.28aA0.530.00±14.80bA1.35±0.29aA0.558.15±14.65aA1.55±0.17aA1.066.67±16.13abA1.81±0.23aA1.544.40±15.60bA1.70±0.31aA
表7 NAA和IBA对生根的影响
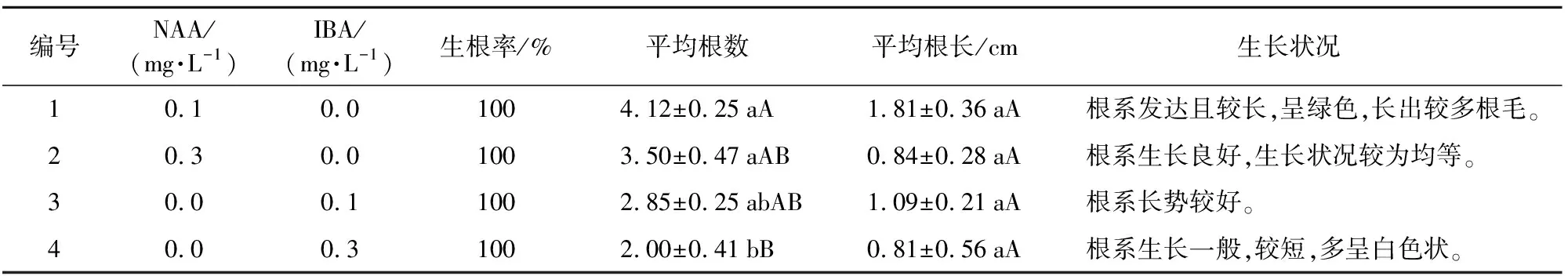
编号NAA/(mg·L-1)IBA/(mg·L-1)生根率/%平均根数平均根长/cm生长状况 10.10.01004.12±0.25aA1.81±0.36aA根系发达且较长,呈绿色,长出较多根毛。20.30.01003.50±0.47aAB0.84±0.28aA根系生长良好,生长状况较为均等。30.00.11002.85±0.25abAB1.09±0.21aA根系长势较好。40.00.31002.00±0.41bB0.81±0.56aA根系生长一般,较短,多呈白色状。
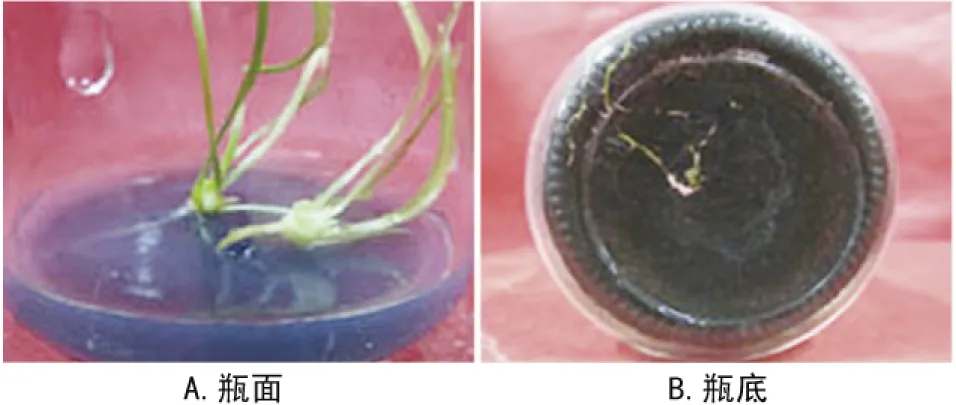
注:A.瓶面;B.瓶底。图3 不定芽生根
由表7可看出:4配方对根数的影响显著低于其他配方,但对根长的影响均不显著。NAA浓度是0.1 mg·L-1和0.3 mg·L-1,生根率均为100%,平均根数分别是4.12和3.50;平均根长分别是1.81 cm和0.84 cm,说明NAA和IBA浓度>0.1 mg·L-1均不利于不定芽的生根,且从整体上看,NAA对生根的作用效果比IBA强。
由表8可知,NAA和IBA无交互作用,对根数和根长没有影响。NAA对生根的影响起主导作用,主次效应为NAA>IBA。
综上发现,NAA对根的诱导情况较IBA理想,诱导不定芽生根的最佳培养基为1/2 MS+NAA 0.1 mg·L-1+4 g·L-1活性炭,生根率100%,平均根数为4.12,平均根长为1.81 cm。
3 结论与讨论
3.1 结 论
香水百合诱导不定芽的最佳培养基:MS+NAA 0.3 mg·L-1+6-BA 1.0 mg·L-1,诱导率为73.33%,其影响主效应是NAA。
表8 NAA和IBA对生根影响的多因素方差分析
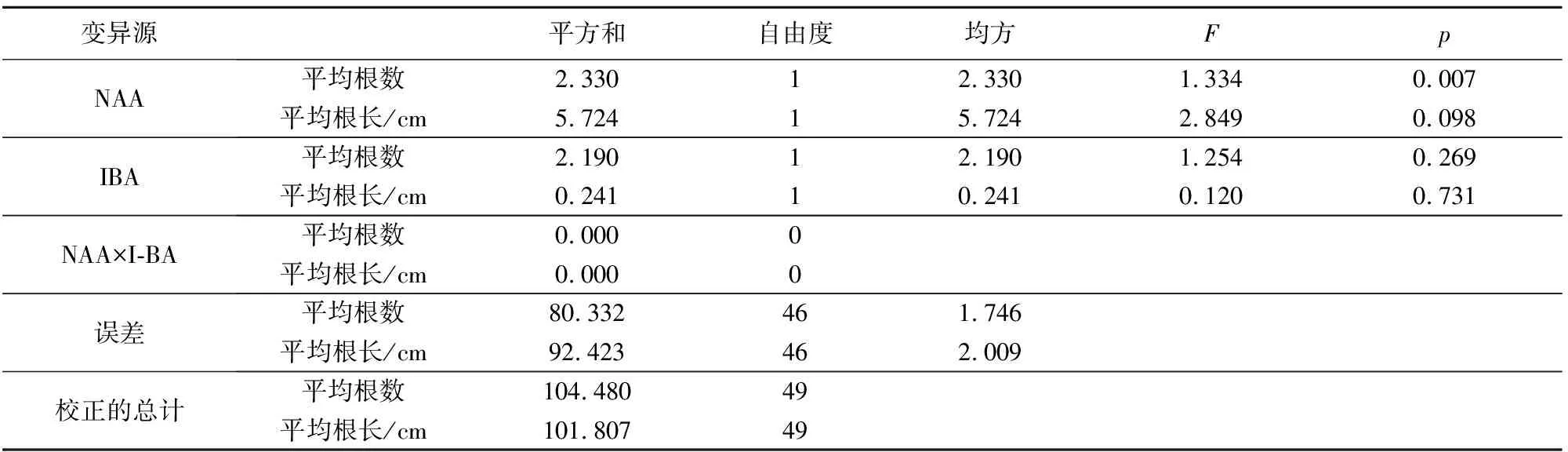
变异源平方和自由度均方FpNAA平均根数2.33012.3301.3340.007平均根长/cm5.72415.7242.8490.098IBA平均根数2.19012.1901.2540.269平均根长/cm0.24110.2410.1200.731NAA×I-BA平均根数0.0000平均根长/cm0.0000误差平均根数80.332461.746平均根长/cm92.423462.009校正的总计平均根数104.48049平均根长/cm101.80749
香水百合不定芽增殖的最佳培养基:MS+NAA 0.5 mg·L-1+6-BA 0.1 mg·L-1增殖率高达88.89%,增殖系数为1.83,增殖率和增殖系数影响的主效应分别是6-BA和NAA。
香水百合生根的最佳培养基:1/2 MS+NAA 0.1 mg·L-1+4 g·L-1活性炭,生根率100%,平均根数为4.12,平均根长为1.81 cm,影响生根的主导因子是NAA。
3.2 讨 论
3.2.1不同激素组合对不定芽诱导的影响
NAA和6-BA浓度之比对于百合鳞片诱导不定芽有一定的影响[16]。本试验以香水百合外层鳞片作为外植体,MS为基础培养基,分别在NAA浓度为0.1、0.3、0.5 mg·L-1和6-BA浓度为1.0、1.5、2.0 mg·L-1组合的9个配方中诱导出不定芽。结果显示,NAA浓度介于0.1~0.3 mg·L-1之间香水百合鳞片诱导不定芽的情况较好,诱导率呈上升趋势。而杨鹭生等[17]研究东方百合‘帝伯’(OrientalHybrids‘Tiber’)诱导不定芽的NAA适宜范围是0.15~0.36 mg·L-1,本试验研究结果与之相似,但本试验中NAA浓度>0.3 mg·L-1则起抑制作用,这可能跟百合品种的不同有关。刘龙昌等研究发现,新豫百合(LiliumformolongiHort.L.browniiF.E.Brown ex Miellez)鳞片诱导的最适NAA范围是0.1~0.2 mg·L-1[18],本试验研究结果与之相吻合。结果分析显示,6-BA浓度为1.0 mg·L-1,诱导效果最好,与杜帅等[19]对绿花百合(LiliumfargesiiFranch)研究相同。本试验中鳞片诱导不定芽的最佳培养基是MS+NAA 0.3 mg·L-1+6-BA 1.0 mg·L-1,张悦等对‘木门’百合的研究显示,6-BA和NAA浓度均为0.5 mg·L-1,是鳞片诱导最好的培养基[20];而宜昌百合(Liliumleucanthum(Baker) Baker)适宜培养基为1.0 mg·L-16-BA+0.2 mg·L-1NAA[21]。由此可见,百合品种不同,适宜百合鳞片诱导不定芽的激素配比也不同。
3.2.2不同激素组合对增殖培养的影响
百合增殖培养过程中,一般采用高浓度的细胞分裂素和低浓度的生长素搭配,来提高芽苗的增殖和促进苗的健壮生长[22]。增殖培养过程中,多采用NAA和6-BA参与调节。NAA能促小鳞茎增殖分化出不定芽[23],6-BA则有利于提高增殖系数[24]。本试验采用NAA和6-BA对不定芽进行增殖,对NAA设计了0.1、0.3、0.5 mg·L-13个浓度差,6-BA 0.1、0.5、1、1.5 mg·L-14个浓度差随机组合的5组。结果分析表明,NAA/6-BA>1不利于不定芽的增殖,二者之间比例越大,增殖率越低,增殖系数也有所下降,这和前人研究6-BA/NAA>1时,有利于芽的分化[25]不同,本试验中6-BA浓度设置的梯度比NAA大,且不同百合品种对这2种激素比例要求不同[26]。本试验最佳增殖培养基是MS+NAA 0.5 mg·L-1+6-BA 0.1 mg·L-1,这和曾洲德[27]对泸定百合(LiliumsargentiaeWilson)以及石印[28]等对大花卷丹(Liliumleichtliniimowiczii(Regel)Baker)的研究结果不一致。香水百合具体增殖培养最佳激素组合还有待试验进一步证明。
3.2.3不同激素组合对生根培养的影响
研究发现,生根培养基常用1/2 MS培养基,万勇等认为,附加NAA、IBA的培养基主要影响百合生根的数量和质量,而附加活性炭促进根的生长[29]。本试验以1/2 MS培养基为生根的基础培养基,并添加4 g·L-1的活性炭,对NAA和IBA分别设计了0.1 mg·L-1和0.3 mg·L-1两个浓度梯度。结果显示,0.1 mg·L-1的NAA和IBA更利于香水百合诱导生根,0.3 mg·L-1的NAA和IBA对根的生长有抑制作用,其中NAA的作用效果比IBA好。金亚征等对药用百合研究表明,在1/2 MS培养基上添加NAA对百合生根诱导较好[30],本试验结果与之一致。李玲玲[31]、潘理云[32]等分别对有斑百合(Liliumconcolorsalisb.var.pulchellum(Fisch)Regel)、宜兴百合(LiliumlancifoliumThunb)进行了研究,1/2 MS+IBA 0.5 mg·L-1对百合生根诱导效果最好;本试验中0.1 mg·L-1的IBA对生根的诱导效果最好,更高浓度的IBA对香水百合生根的影响需要更进一步的试验证明。方中明等发现,0.2 mg·L-1NAA的1/2 MS培养基上加入0.5 mg·L-1的IBA是香水百合诱导生根的最佳培养基[33],本试验未设计NAA和IBA的交互作用,故需试验验证二者之间的差异。

