枸杞多糖对17℃负压环境下猪精子保存质量的影响
王 硕,赵家辉,邹一诺,高明山,李雁冰,黄大鹏,魏国生,李井春
(黑龙江八一农垦大学动物科技学院,黑龙江大庆 163319)
目前,猪人工授精技术随着国内外养殖业的快速发展愈加完善,猪精液长期保存技术的发展使得猪人工授精技术在养猪业中得到广泛应用[1]。生产实践中主要以常温液态保存为主,冷冻精液应用相对较少[2],但常温保存精子易受活性氧族(ROS)氧化损伤,从而使精子活力、质膜完整性及形态等受到影响[3]。因此,增强猪精子的抗氧化性已成为现今研究的热点,在稀释液中添加外源性抗氧化剂是最直接的方法。
枸杞多糖(Lycium barbarum polysaccharide,LBP)是由阿拉伯糖、葡萄糖、半乳糖、甘露糖等成分组成,现代药理学研究表示枸杞多糖具有抗氧化、防衰老、防止遗传损伤等作用[4]。何涛等[5]研究表明,枸杞多糖能显著提高猪精子冷冻后的精子活率、质膜完整率、线粒体活性等。然而,在17℃保存环境下添加枸杞多糖对猪精液保存效果影响的研究鲜有报道。研究表明,负压处理可提高精液的保存效果[6]。本实验在Modena 稀释液中添加不同剂量的枸杞多糖,并采用17℃负压处理,从温度与低氧2 个途径降低精子代谢速度,利用迈朗全自动精子质量检测仪检测精子质量参数,分析枸杞多糖对17℃负压环境下猪精子保存质量的影响,为猪精液保存技术以及人工授精技术的发展提供依据。
1 材料与方法
1.1 主要试剂 枸杞多糖购自上海江莱生物科技有限公司,Modena 稀释液药品组成均购自西格玛公司。Modena 稀释液组成为每1 L 溶液中含青霉素 0.074 g、链霉素 0.05 g、葡萄糖 27.50 g、NaHCO31 g、柠檬酸 2.9 g、柠檬酸钠 6.9 g、TRIS 5.65 g、EDTA-2Na 2.6 g、BSA 4 g(现配现用)。
1.2 实验设计 本实验共设计5 组,在Modena 基础稀释液中分别添加0、0.5、1.0、1.5、2.0 mg/mL 的枸杞多糖,共设4 次重复实验。
1.3 猪精液采集 猪精液采自黑龙江八一农垦大学猪场,采集3 头健康无病长白种公猪混合精液,精子活力在0.8以上的精液。采集后的精液置于保温箱内在1~2 h 内运送至实验室,在运输过程中避免剧烈晃动,以减少对猪精子的机械损伤。
1.4 猪精液的稀释 精液运送到实验室后,将原精液1 800 r/min 离心5 min,离心后去除上清液,采用精板计数法检测离心后的浓缩精液的精子密度,用各组室温的试剂稀释液将离心后精子稀释计算调整密度为1×108个/mL,精液离心后对精液稀释过程要在15 min 内完成,避免沉积而造成物理损伤,待用。
1.5 精液保存 将稀释后的各组试管置于负压保存瓶中,用带有空气流通开关的活塞密封负压保存瓶,将负压保存瓶与真空泵机连接紧密,通过真空泵机将负压保存瓶内气压调整负压为0.04 MPa。负压处理后将负压保存瓶置于17℃恒温箱中保存。每隔12 h 对各组试管中的精液进行移液枪缓慢冲击混匀。
1.6 精子质量参数的检测 根据实验设计,在保存的各时间点(1、2、3、4、5 d)定时取样,各组取10 μL样品分别需在37℃加热板上复苏2~3 min,通过迈朗全自动精子分析仪等仪器检测精子活率、活力、直线速度、路径速度、鞭打频率、畸形率等质量参数,并记录实验数据。精子活率是指具有活动能力的精子数占总精子数的百分率;活力是指精液中呈前进运动精子所占的百分率;直线速度是指精子直线运动的平均速度;路径速度是指精子沿其空间轨迹移动的平均速度 ;鞭打频率是指精子每秒中平均鞭打次数;畸形率是指具有畸形的精子数占总精子数的百分率。
1.7 统计分析 将各时间段的各试验组质量参数数据利用Excel 进行汇总初步处理,再利用 StatView 5.0 软件对实验测定的各项参数进行方差分析和多重比较(模型Duncan´s),实验结果用平均值± 标准差来表示。P<0.05 表示差异显著。
2 结果
2.1 枸杞多糖对精子活率的影响 由表1 可知,保存第3天时各实验组精子活率显著高于0 mg/mL 组,1.5 mg/mL组显著高于其他实验组。第4 天时,0.5、1 mg/mL 组的精子活率与1.5、2 mg/mL 组差异不显著,而1.5 mg/mL组显著高于2 mg/mL 组。第5 天时,1.5 mg/mL 组的精子活率显著高于其他试验组,1 mg/mL 组显著高于0、0.5、2 mg/mL 组,而0.5 mg/mL 组与2 mg/mL 组之间差异不显著。
2.2 枸杞多糖对精子活力的影响 由表2 可知,保存第3 天时,0.5、1、1.5 mg/mL 组精子活力显著高于其他组,而1.5 mg/mL 组显著高于0.5、1 mg/mL 组。保存第4天时,4 个实验组的精子活力显著高于0 mg/mL 组,其中1.5 mg/mL 组显著高于其他实验组,其他实验组间差异不显著。保存第5 天时,1.5 mg/mL 组的精子活力显著 高 于0、0.5、2 mg/mL 组,而0.5、1、2 mg/mL 组之间差异不显著,0 mg/mL 组与 0.5 mg/mL 组间差异不显著,1 mg/mL 组与1.5 mg/mL 组间差异不显著。
2.3 枸杞多糖对精子直线速度的影响 由表3 可知,添加枸杞多糖后保存3 d 时,1、1.5、2 mg/mL 组精子的直线速度显著高于0、0.5 mg/mL 组,且0 mg/mL 组与0.5 mg/mL组间差异不显著。保存第4 天时,1.5 mg/mL 组的精子直线速度显著高于其他组,0.5 mg/mL 组显著高于0 mg/mL 组,0、1、2 mg/mL 组之间差异不显著。保存第5 天时,1.5 mg/mL 组的精子直线速度显著高于0、2 mg/mL 组,而与0.5、1 组之间差异不显著,0、0.5、1、2 mg/mL 组之间差异不显著。

表1 枸杞多糖对精子活率的影响 %

表2 枸杞多糖对精子活力的影响 %
2.4 枸杞多糖对精子路径速度的影响 由表4 可知,保存3 d 时,1.5 mg/mL 组精子路径速度显著优于其他组,0.5、1、2 mg/mL 组之间差异不显著,而0.5、1 mg/mL组显著高于0 mg/mL 组。保存4~5 d 时,实验组显著高于0 mg/mL 组,0.5、1、2 mg/mL 组之间差异不显著,但显著低于1.5 mg/mL 组。
2.5 枸杞多糖对精子鞭打频率的影响 由表5 可知,保存第2 天时,1.5 mg/mL 组与2 mg/mL 组之间精子鞭打频率差异不显著,但显著高于其他3 组;保存在3~5 d时,1.5 mg/mL 组显著高于其他组,且其他组间差异不显著。由此可知,各组间随着枸杞多糖添加量的增加精子鞭打频率逐渐上升趋势,但当枸杞多糖浓度达到2 mg/mL 时精子鞭打频率呈下降趋势。
2.6 枸杞多糖对精子畸形率的影响 由表6 可知,保存第3 天时,1.5 mg/mL 组与2 mg/mL 组精子畸形率差异不显著,且两组显著低于其他组,0.5 mg/mL 组与0、1 mg/mL 组差异均不显著。保存第4 天时,1、1.5 mg/mL组显著低于0、0.5、2 mg/mL 组,1.5 mg/mL 组显著低于1 mg/mL 组。保存第5 天时,4 个实验组精子畸形率均显著低于0 mg/mL 组,1.5 mg/mL 组显著低于其他实验组。
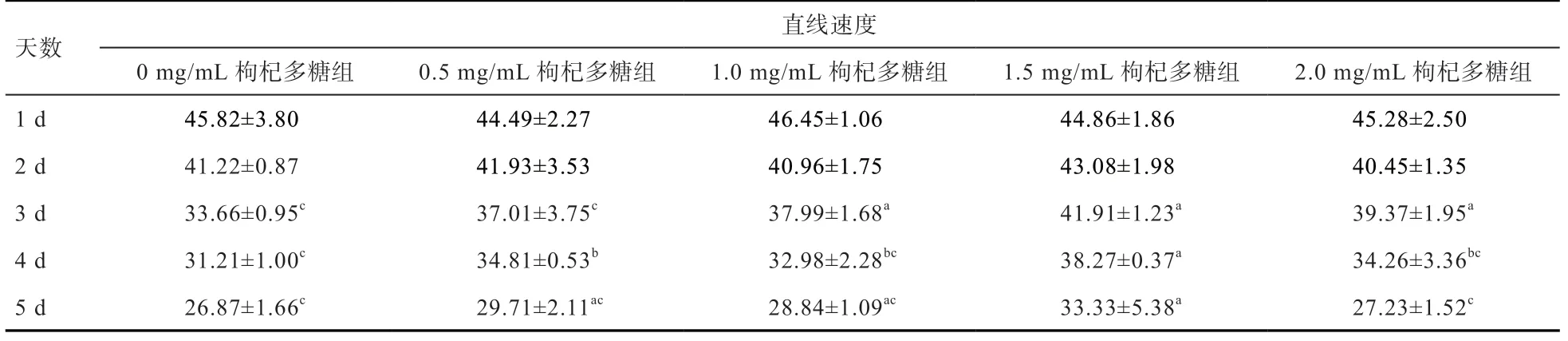
表3 枸杞多糖对精子直线速度的影响 μm/s
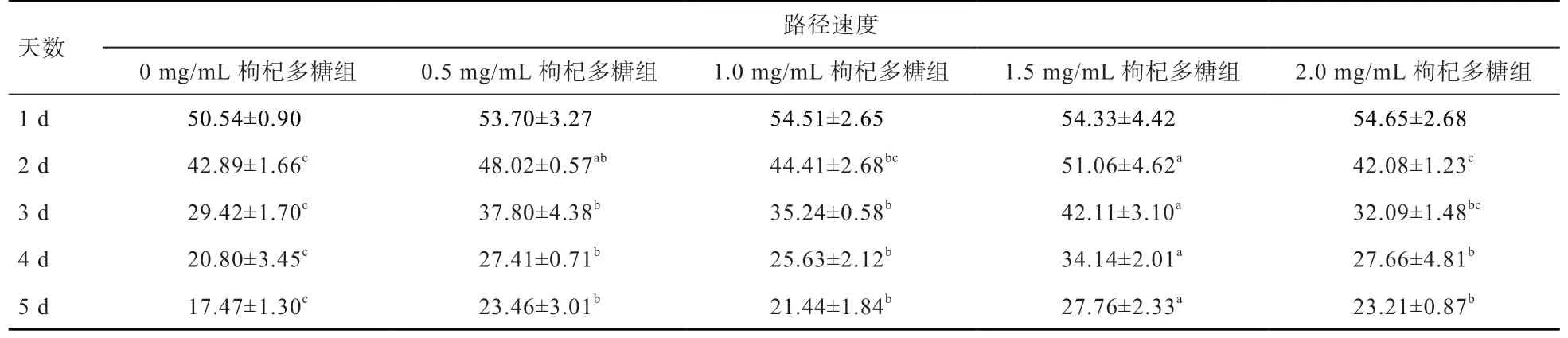
表4 枸杞多糖对精子路径速度的影响 μm/s

表5 枸杞多糖对精子鞭打频率的影响 HZ

表6 枸杞多糖对精子畸形率的影响 %
3 讨 论
在猪精液保存过程中,随着保存时间延长,产生的ROS 逐渐累加。研究表明在冷冻精子保存过程中产生过量的氧自由基会影响冻融后精子质量[7-8]。本实验在稀释液中添加一定量枸杞多糖,目的在于提高精液的抗氧化能力,减弱由猪精子和细菌代谢所产生的ROS 对猪精子的损伤。同时本实验采用负压处理,模拟睾丸负压低氧的环境,从而抑制精子的代谢速度、减弱精子的运动强度、减缓有害物质的产生以及抑制一些病原微生物的滋生,进而提高精液的保存质量。
猪精子的活率和运动性能参数与猪精子结构和功能的完整性存在密切的相关性,依据该参数可以对精子潜在的授精能力作出预测[9]。从本实验结果可知,各实验组的精子活率显著高于对照组,其中1.5 mg/mL 组精子活率显著高于其他实验组。李文烨[10]研究也表明,在猪精液中添加6%~8%的枸杞多糖可有效提高冻后精子活率。精子活力是保证精子到达受精部位的重要条件[11],同时精子路径与直线速度可间接反映精子活力以及精子保存效果,而直线运动的精子才属于有效精子更具有代表性。本研究中,1.5 mg/mL 组在精子活力、直线速度和路径速度都优于其他组。Hipler 等[12]研究表明,精细胞比体细胞更易被ROS 损伤,主要原因是精细胞膜含有丰富的不饱和脂肪酸,细胞膜较容易被氧化。研究表明,枸杞多糖在体外溶液中可直接清除羟自由基,同时能够抑制自发或由羟自由基引起的脂质过氧化反应,并且可以提高超氧化物歧化酶(SOD)活性进而清除过量的自由基,减弱ROS 对精子细胞膜的氧化损伤,从而提高猪精子活力以及运动性,这与马爱团等[13]研究中通过枸杞多糖抗氧化性来保护仓鼠生精细胞结论一致。
精子进入生殖道内后运动方式发生很大的变化,而精子的鞭打频率也可以间接反映精子的超激活以及精子保存效果。本研究中,从第3 天开始1.5 mg/mL 组猪精子鞭打频率显著优于其他组。畸形率对精子运动性也存在一定的影响,畸形率影响精子的受精能力[14]。本实验结果显示,1.5 mg/mL 组精子畸形率显著低于其他组,精子畸形率影响精子运动性能体现在精子尾部畸形上。精子运动功能是由线粒体提供能量。线粒体功能的衰弱直接影响精子的运动性能,精子细胞膜由于氧化损伤导致精子线粒体等细胞器机能表达受到影响[15]。易康乐等[16]研究表明,精子活率与质膜完整性呈显著正相关,精子平均游动速度与质膜完整性无明显相关性。而本研究各组间整体表现出精子活率越高运动参数越高的趋势,说明添加枸杞多糖可有效提高精子的质膜完整性,提高精子的运动性能以及降低精子的畸形率等。同时本实验采用负压处理可有效降低精液含氧量,进一步减缓精子和细菌代谢产生的ROS,从而提高精液配方的抗氧化性,延长精液的保存时间以及提高精液质量。
4 结 论
本实验中采用17℃负压保存处理,可在提升精液品质和精子受精能力的前提下,通过低温和低氧2 个技术措施弱化精子的代谢强度,使猪精子处于可逆转的半休眠状态。本实验结果表明,添加一定量的枸杞多糖在17℃负压环境下可显著提高猪精子的活率、活力等和降低精子畸形率,其中1.5 mg/mL 组各项参数显著优于其他组,添加1.5 mg/mL 的枸杞多糖最有利于猪精子保存。

