化学反应历程机理图解题分析
黄春德

摘 要:化学反应速率是高中化学《化学反应原理》模块的重要探究内容,属于化学动力学范畴。2020新版人教版教材对化学反应速率给了定义并剖析了影响因素,并引入了基元反应,碰撞理论等概念,对影响化学反应速率的因素展开了定性和定量分析。2017版课标也明确要求掌握基元反应,催化剂作用的要求。在新高考考题中,我们不难发现,化学反应历程机理遍布各地考题,构建思维模型等的教育理念推层出新,各类新科研成果,前言技术以情境模型出现于高考题型,无疑引领时代的进步,考察的不再是学生死记硬背的能力,而更多的是思维的能力,迁移的能力。本文就此部分知识出现的考题进行探索与研究。
关键词:情境教学;思维模型;催化剂;反应历程
纵观近几年高考真题与各地模拟题,笔者发现,在化学反应历程考察的题型,有以下几种题型:总能量变化曲线模型;非均相反应历程模型;“环式”反应历程模型……以下是介绍这几种题型的常见解法。
一、简单的总能量变化曲线模型
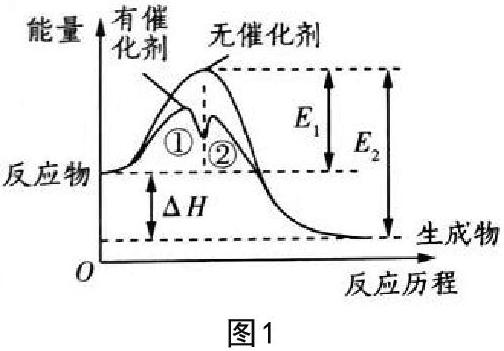
此类题型属于最基础的反应历程:清晰的展现能量变化趋势图。如图1所示,可以读出以下信息:
1.起点反应物的总能量与终点生成物的总能量的变化为降低的,故为放热反应,△H<0。
2.E1為正反应的活化能;E2为逆反应的活化能。故放热反应的正向活化能大于逆向活化能;反之,吸热反应的正向活化能小于逆向活化能。
3.加入催化剂,活化能明显降低,且反应历程为单一基元反应变成两个基元反应组合起来。
4.结合动力学理论,可以读出另外的信息:有催化剂的情况下,该反应历程有经历两个基元反应。反应①的活化能比反应②的活化能高,故该反应的速率由活化能高的慢反应决定。
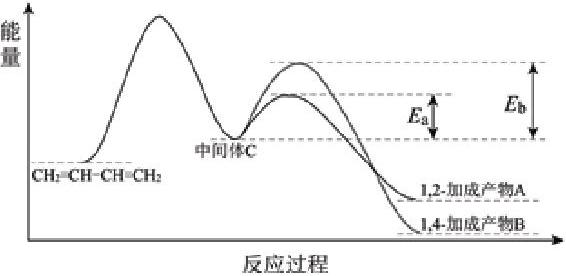
例1 1,3-丁二烯和Br2以物质的量之比为1∶1发生加成反应分两步:第一步Br+进攻1,3-丁二烯生成中间体C(溴鎓正离子);第二步Br?进攻中间体C完成1,2-加成或1,4-加成。反应过程中的能量变化如下图所示,下列说法正确的是
A.1,2-加成产物A比1,4-加成产物B稳定
B.第一步的反应速率比第二步慢
C.该加成反应的反应热为Eb–Ea
D.升高温度,1,3-丁二烯的平衡转化率增大
【解析】A.根据图像可知,1,2-加成产物A含有的总能量大于1,4-加成产物B,则1,4-加成产物B稳定,故A说法错误;
B.第一步的反应的活化能大于第二步,则第一步的反应速率比第二步慢,B说法正确;
C.该加成反应的反应热为1,3-丁二烯的总能量分别与1,2-加成产物A和1,4-加成产物B的总能量的差值,所以C说法错误;
D.根据图像可知,该反应为放热反应。升高温度,平衡逆反应方向移动,则1,3-丁二烯的平衡转化率减小,因此D说法错误。
二、非均相反应历程模型
所谓“均相”模型,就如H2O2的分解反应,用FeCl3溶液作为催化剂,均在水相中进行的反应;而“非均相”模型,就如H2O2液体相的分解反应,用固体相MnO2作为催化剂,经常表现为催化剂表面的“吸附”与“解吸”反应历程模型,如图2所示。
三、“环式”反应历程模型
此类题型,可以观察图3,可以看到整个反应过程中涉及多种物质,解题的关键在于有些物质循环出现,如⑤⑥⑦⑧,有可能是催化剂或者中间产物。如果是一开始就存在的,那么就是催化剂;中间产生的后来又反应掉的,则为中间产物。有些物质是进入旋转圈的,如①④,为反应物;由旋转圈出来的物质,如③,为反应产物。
例1(2020年全国1卷第10题)铑的配合物离子[Rh(CO)2I2]-可催化甲醇羰基化,反应过程如图所示。
下列叙述错误的是:
A.CH3COI是反应中间产物
B.甲醇羰基化反应为CH3OH+CO=CH3CO2H
C.反应过程中Rh的成键数目保持不变
D.存在反应CH3OH+HI=CH3I+H2O
[解析]
A.CH3COI为左侧循环圈的中间产物,正确。
B.纵观整个图,进入的物质有CO和CH3OH,生成的物质为CH3CO2H,所以B正确。
C.图中左右的Rh,可以看到6个键,而最上方的Rh只有4个键,最下方的Rh是5个键,故C错误。
D.图的左侧,可以看到H2O和CH3COI接触,生成HI和CH3CO2H,正确。
结合上述几道反应历程。笔者发现,考题主要考察的知识主要如下:1)化学反应的过程伴随能量的变化,加入催化剂能改变反应的历程,不改变反应的反应热。2)催化剂所起的作用是降低反应的活化能,以提高反应速率的作用;3)催化剂改变的历程有多种情况:可以是被吸附在催化剂表层,降低反应物的键能;也可能是反应物与催化剂反应生成中间产物,再重新与另一反应物反应生成目标产物…不管考题以何种情境何种类型出现,考察的内容都是基本概念基本原理。只有掌握课本知识,养成提炼题目信息的能力,构建科学的催化剂发挥作用模型,从“学会知识”转变为“会学”、“会研究”,才能满足新高考选拔人材的需要。
参考文献
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:74.
[2]徐聪,魏锐.由合成氨工艺引发的化学反应速率相关问题探讨[J].中学化学教学参考,2020(04):31-33.
惠州市华罗庚中学 516000

