缺血性卒中溶栓后早期神经功能恶化的危险因素及预后相关性研究
张世德,张 强
(1.锦州医科大学抚顺市中心医院研究生培养基地,辽宁 抚顺 113006;2.抚顺市中心医院神经内科,辽宁 抚顺 113006)
卒中是全球第二大死亡原因,也是中国的头号死因,仅次于缺血性心脏病[1]。对于时间窗内急性缺血性卒中(acute ischemic stroke, AIS)患者进行重组组织型纤溶酶原激活剂(recombinant tissue plasminogen activator, rt-PA)静脉溶栓治疗是有效、安全的再通方式[2]。尽管大多数AIS患者在rt-PA治疗后症状显著改善,但仍有部分病例出现症状短期改善后神经功能进一步恶化,或静脉溶栓后神经功能出现进行性或逐步恶化,将其称为早期神经功能恶化(early neurological deterioration,END)。关于rt-PA静脉溶栓后24 h内发生的END,其发生率、预测因子和临床处理了解甚少,缺乏明确的机制。大部分研究将END定义为入院至溶栓后24 h期间内出现的美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale, NIHSS)评分较基线评分增加≥4 分。以往的研究表明,症状性颅内出血(symptomatic intracranial hemorrhage,sICH)、恶性水肿、早期复发性缺血性卒中(early recurrent ischemic stroke, ERIS)是END的已知因素[3],相关研究表明END与动脉粥样硬化与血管狭窄、血脂异常、C反应蛋白、纤维蛋白原、D-二聚体等化验结果、影像学特征等[4]相关。本研究前瞻性分析AIS患者的临床数据,明确了END发生的其他临床相关危险因素,以及END的发生与预后之间的联系性,进而对临床治疗策略的选择和预后的评估提供指导。
1 资料与方法
1.1 研究对象 本研究中前瞻性连续纳入2017年9月—2018年12月于本院住院且发病4.5 h内静脉给予剂量为0.9 mg/kg rt-PA的AIS患者,所有患者均收入卒中单元治疗。在前6 h每15 min评价1 次NIHSS评分,6 h后每隔2 h记录1 次,根据END发生情况分为END组(研究组)和非END组(对照组)。纳入标准:所有诊断与《中国急性缺血性脑卒中诊治指南2014》[5]相符的AIS患者被纳入研究,主要包括:①年龄大于18 岁;②临床诊断为AIS,且发病时间4.5 h内;③通过CT或MRI检查除外了其他非脑卒中疾病、梗死面积大于大脑半球的2/3和脑出血;④不存在指南明确的其他溶栓禁忌证;⑤签署溶栓知情同意书。排除标准:①梗死后出血;②严重心、肺、肝、肾功能不全;③符合《中国急性缺血性脑卒中诊治指南2014》[5]其他溶栓禁忌证;④桥接血管内治疗;⑤临床数据不完整。
1.2 治疗方法 所有入组患者均在发病4.5 h内于抚顺市中心医院急诊卒中中心接受静脉rt-PA治疗,剂量为0.9 mg/kg(最大剂量为90 mg),总剂量的10%在1 min内静脉推注,剩余剂量持续静脉滴注60 min,后续治疗根据《中国急性缺血性卒中诊治指南2014》[5]收入抚顺市中心医院神经内科卒中单元给予调整血压血糖、营养支持、抗血小板或抗凝、降纤等治疗。
1.3 观察指标及预后判定标准 分析两组病例入院后一般临床数据、入院基线特征(基线血糖、基线收缩压、基线舒张压、基线NIHSS评分、发病至溶栓时间)及溶栓前和入院24 h内的实验室指标(血小板计数、白细胞计数、淋巴细胞、中性粒细胞淋巴细胞比值(neutrophil to lymphocyte ratio, NLR)、尿酸、总胆固醇、高密度脂蛋白、低密度脂蛋白、甘油三酯、糖化血红蛋白、空腹血糖、同型半胱氨酸、活化部分凝血活酶时间、凝血酶原时间、国际标准化比值、纤维蛋白原、肌酐、尿素氮)和TOAST分型以及两组患者的90 d(±7 d)随访改良Rankin量表(Modified Rankin Scale, mRS)评分。
所有入选患者均在溶栓前及24 h内完成实验室化验、头颅CT及NIHSS评分,在溶栓后24 h复查头颅CT,随访发病后90 d(±7 d)mRS评分,不良结局定义为90 d mRS评分>2 分。
sICH的定义采用欧洲卒中溶栓安全监测研究的定义[6],即溶栓后36 h内,相对基线或最低NIHSS增加≥4 分,且影像学证实为2型脑实质出血。2型血肿定义为血肿体积超过梗死体积的30%且有明显占位效应。
目前对END无统一定义,评价指标也不同,有的应用斯堪的那维亚神经卒中量表[7]、加拿大神经系统量表[8]、NIHSS评分[9],本研究END定义为基线至24 h期间NIHSS评分增加≥4 分,或者24 h内患者死亡。由两名医生负责审查最终的临床数据,本研究的临床评估人员均经过NIHSS和mRS评分专业培训。
1.4 统计学方法 本研究采用SPSS 25.0软件进行统计学分析,其中正态分布计量资料以均数±标准差描述,独立样本t检验用于组间比较;偏态分布的计量资料以中位数和极数描述,采用Mann-Whitney U检验进行组间比较;计数资料以频数和百分比描述,组间比较采用χ2检验或Fisher精确概率法检验。采用多因素Logistic回归分析评估END的独立危险因素,以及对两组患者的预后进行分析得出校正比值比(odds ratio, OR)和95%可信区间(confidence interval,CI),双尾P<0.05为差异有统计学意义。
2 结果
2.1 一般资料及基线特征 共纳入患者464 例,排除后续桥接血管内治疗20 例、资料不全2 例和失访3 例,最终439 例纳入分析。其中END组35 例,非END组404 例。两组的基线特征比较仅有既往高血压病史(P=0.017),既往糖尿病病史(P=0.000),既往卒中病史(P=0.042),基线血糖(P=0.003)、基线收缩压(P=0.020)、基线NIHSS评分(P=0.018)、空腹血糖水平(P=0.018)的差异有统计学意义。其他基线特征差异均无统计学意义。两组发病给药时间中位数为180 min(P=0.632),两组患者的TOAST病因分布差异有统计学意义(P=0.003),其他原因型(stroke of other determined cause, ODC)与不明原因型(stroke of undetermined cause, UND)患者较少将两组合并统计。大动脉粥样硬化型(largeartery atherosclerosis, LAA)的END发生率最高(60.00%),其次为心源性(cardiogenic embolism,CE)(31.41%),小动脉闭塞型(small-artery occlusion, SAO)最低,比例仅为2.86%。进一步组间比较结果发现两组患者的不同病因构成比中CE型(31.43% vs 13.61%)和SAO型(2.86% vs 23.51%)差异有统计学意义。(表1)

表1 END组和非END组的一般资料和基线特征比较
2.2 两组的危险因素分析 单因素分析得出END相关危险因素包括高血压病史、糖尿病病史、既往卒中病史、基线NIHSS评分、基线血糖、基线收缩压、空腹血糖,将上述因素作为自变量,将发生END作为因变量,进行Logistic多因素回归分析,得出入院时收缩压高、既往糖尿病病史、既往高血压病史与END的发生独立相关(P<0.05),为导致END发生的独立危险因素。既往患有糖尿病的患者发生END的风险是既往无糖尿病病史的患者的4.311倍;既往患有高血压病的患者发生END的风险是既往无高血压病史的患者的3.35倍;基线收缩压每增加1 mmHg,发生END的风险增加1.8%。(表2)
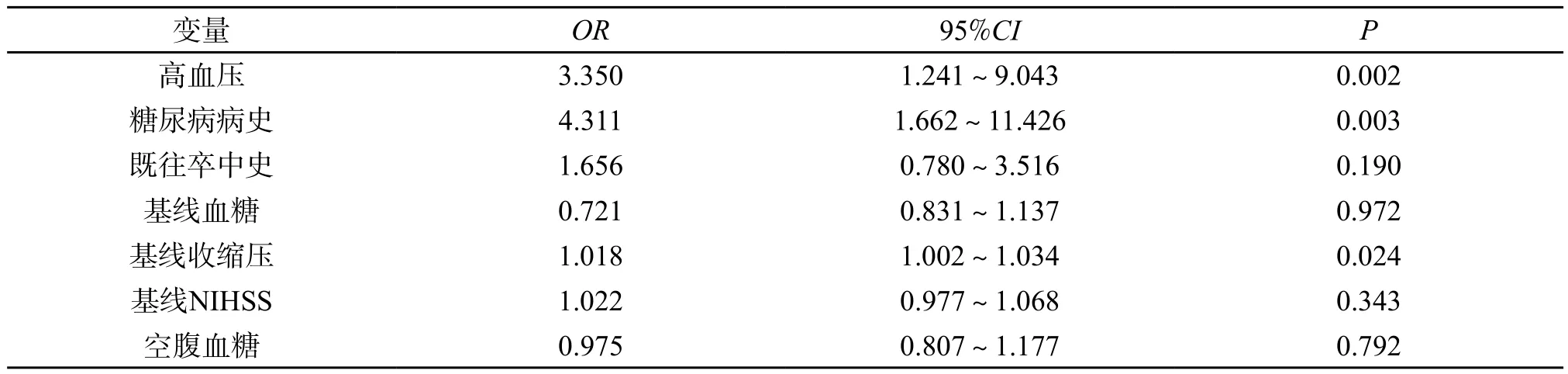
表2 影响END发生的多因素Logistic回归分析比较
2.3 两组患者的预后比较 定义90 d mRS评分>2 分为预后不良,END组预后不良的比例为60.00%,非END组预后不良的比例为26.98%,与非END组相比,END组预后不良的可能性更高(OR=3.687,95%CI:1.748~7.776)。END组的90 d病死率为14.29%,非END组90 d病死率为2.72%,与非END组相比,END组死亡的可能性更高(OR=7.231,95%CI:2.043~25.600)。对END患者的死亡原因进一步分析发现,END组的5 例死亡患者中,3 例死于症状性颅内出血,1 例死于恶性脑水肿,1 例死于重症感染。(表3,表4)

表3 END组和非END组90 d mRS评分情况

表4 END组和非END组的预后比较
3 讨论
END是AIS公认且严重的并发症,并进一步预示着远期不良预后[10],由于不同研究中END的定义不同,END的发生率也不尽相同,文献报道静脉溶栓患者END发生率占缺血性卒中的5%~40%[8]。本研究中END的发生率为7.97%,与国内外相关文献报道的发生率基本相符。
本研究分析了AIS静脉溶栓患者发生END的相关危险因素,以及END的发生对预后的影响。结果发现高血压病史、糖尿病病史、入院时NIHSS评分高、入院时随机血糖高、入院时收缩压高和空腹血糖水平高是致使END发生的危险因素,高血压病史、糖尿病病史和较高的基线收缩压是END发生的独立危险因素。END组的预后良好比例明显少于非END组,发生END的患者3 个月死亡的风险也显著高于非END组,END组的死亡原因主要是sICH。
高血压病是脑卒中的极其重要危险因素,缺血性卒中患者早期机体为了保障缺血区域脑组织的灌注压,应激性导致儿茶酚胺等升压物质分泌骤然增加,血中升压物质浓度上升,进而发生血压应激性升高,超过一定区域值的高血压将导致脑组织过度灌注,导致血脑屏障遭到破坏,使原有脑水肿加重甚至发生溶栓治疗后的出血转换,进而导致神经功能缺损程度加重甚至发生患者死亡。高血压导致血管玻璃样变致使脑血流动力学储备减少和侧支循环的缺乏与END有关[11]。脑损伤和脑水肿所致的死亡与初始血压水平较高有关,同时血压过低时也会加重缺血半暗带的程度。提示我们要积极控制较高的血压,同时避免将血压控制过低,以减少脑组织灌注不足或过度灌注而引发的END。
AIS患者中既往有糖尿病病史的患者特别在此次卒中发病时出现较高血糖水平的患者在溶栓治疗后发生END比例较高。一方面可能是高水平的血糖增加了血脑屏障的破坏,促进了sICH,其次高血糖本身或许也可以导致神经元的损伤,急性血糖升高导致了大脑产生大量的乳酸,促进了严重低灌注的危险组织转化为梗死病灶[12]。此外,糖尿病导致的微血管病变可能导致大脑自身调节能力减弱并影响缺血区域脑组织的侧支循环形成,致使患者在血压变化时更容易发生脑组织缺血。高血糖虽然不是导致END的直接原因,但其间接通过促进乳酸增加、sICH、脑水肿和缺血组织增加等机制导致了END的发生。
本研究显示发生END的患者,在出院90 d时有很高的死亡和不良预后(mRS>2 分)风险。这一发现与Grotta等[13]所发现的相似。这项研究还表明,溶栓治疗后END患者在3 个月时病死率较高,预后较差,在使用不同的END定义的研究中,该结论是一致的。
本研究论证了溶栓治疗后END的病因学危险因素。本研究两组间比较CE型卒中和SAO型卒中差异有统计学意义,其中仅有CE型患者的构成比END组高于非END组,其可能的机制为:心源性卒中常发病较急,未能建立有效的侧枝循环,导致大动脉狭窄或闭塞致使远端脑缺血区血流明显下降或中断,缺血区早期即可出现坏死水肿;静脉溶栓导致原有的心脏内或动脉血栓碎裂,出现新发栓子,再次引发缺血性卒中。本研究发现两组患者中LAA型卒中亚型的构成比均高于其他分型,但进一步组间比较发现两组患者LAA型卒中亚型差异无统计学意义。考虑LAA型卒中是AIS中最常见的类型,但因其存在长期缓慢的血管病变因素,可在卒中发生后建立有效的侧枝循环,可能进一步减少了END的发生。但先前对缺血性卒中患者进行静脉溶栓治疗的研究表明,动脉粥样硬化性卒中患者有脆弱的斑块,卒中急性期复发频繁,极易引起缺血进展,是END的独立预测因子[14]。由于AIS的发病机制是不同的,因此在溶栓治疗后,有必要采取针对病因学的处理策略,以获得最大化的预后效果。
END最常见的原因是缺血进展,其次是脑水肿和sICH,有必要根据神经进展的机制采取不同的治疗方法,以减轻溶栓治疗后的继发性神经元损伤。由于sICH所致的END较少见,而缺血进展最常见。对于具有高缺血进展风险和低出血风险的患者溶栓后及早启动抗栓治疗和(或)高强度的他汀类药物是否可以减缓缺血进展,需要进一步研究。
静脉溶栓在脑梗死的治疗过程中具有重要作用已是共识[15],而随着我们对溶栓后END的机制不断探索和对其危险因素的深入研究,将进一步揭示了一些潜在的评估病情和预后的指标,还提供了潜在的治疗方法,并可更科学地指导治疗方案。如何治疗和改善脑梗死所造成的神经功能缺损,减轻其为患者和社会带来的人力和经济负担是所有神经科医生和科研工作者的共同目标。
本研究有几个局限性:首先本研究两组的样本量不是很均衡,可能存在偏倚;其次,生化化验结果可能因卒中发作而改变,而无法反映卒中发作前患者的特征;最后,本研究基于标准剂量的rt-PA治疗(0.9 mg/kg),结果可能不适用于低剂量治疗(0.6 mg/kg)患者。

