硫酸吲哚酚对人牙周膜细胞增殖及炎症因子表达的影响
上海交通大学医学院附属第九人民医院·口腔医学院牙周病科,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海市口腔医学研究所,上海 200011
牙周炎是一种微生物相关的、宿主介导的、多因素参与并导致牙周附着丧失的炎症性疾病[1-2]。牙周炎通过龈下菌斑中的微生物及其产物引起全身免疫炎症反应,从而成为系统性疾病的危险因素。牙周炎与糖尿病、心血管疾病、呼吸系统疾病等全身疾病有关,近年研究[3]发现牙周炎与慢性肾病(chronic kidney disease,CKD)也有密切联系。
CKD在人群中的患病率为10%~12%,已成为主要的公共健康问题之一,超过50%的老年人有肾功能障碍[4]。横断面调查[5-7]显示,与普通人群相比,CKD患者[包括CKDⅡ~Ⅴ期患者、正在接受腹膜透析(peritoneal dialysis,PD)和血液透析(hemodialysis,HD)患者]的牙周炎患病率明显增加,探诊深度、探诊出血量、附着丧失程度、牙槽骨吸收程度等均高于年龄与之匹配的无系统性疾病健康个体,并且牙周炎患病率与CKD进展程度密切相关。目前关于牙周炎与CKD的相关性,大多来自流行病学调查,二者相关性机制尚不明确。
CKD患者体内存在一类能与蛋白质相结合且不能通过透析清除的毒素,其中最具代表性的为硫酸吲哚酚(indoxyl sulfate,IS)。CKD患者随着肾功能的恶化,血清IS浓度持续升高,可达正常人群的30倍以上。IS与CKD的进展以及CKD患者心血管疾病的不良结局密切相关[8],具有加剧纤维化、促进炎症基因表达、增加细胞内氧化损伤、诱导免疫紊乱及抑制细胞增殖等作用[9-11]。而氧化应激及炎症反应是牙周炎与全身疾病联系的重要桥梁,但目前尚未有IS对人牙周膜细胞(human periodontal ligament cells,hPDLCs)生物学作用的报道。
因此,本研究试图通过观察IS对hPDLCs的增殖活性、炎症因子表达和活性氧(reactive oxygen species,ROS)表达的影响,为CKD与牙周炎的相关性提供实验依据,也为伴CKD牙周炎患者的治疗提供理论基础。
1 材料与方法
1.1 材料
硫酸吲哚酚钾盐、2′, 7′-二氯荧光素二乙酸盐(2′,7′-dichlorofluorescin diacetate,DCFDA)(Sigma,美 国),DMEM培养基 (Hyclone,美国),胎牛血清(Gibco,美国),四甲基偶氮唑盐比色(methyl thiazolyl tetrazolium,MTT)试剂盒(碧云天,中国),总RNA提取试剂盒、RNA反转录试剂盒、SYBR® Premix Ex TaqTMⅡ(宝生物,中国),ELISA试剂盒(UBI,美国)。
1.2 hPDLCs的培养
采用组织块培养法进行hPDLCs的培养。收集上海交通大学医学院附属第九人民医院18~25岁患者临床因正畸需要拔除的、牙周健康的、无龋的前磨牙和第三磨牙,所有牙齿收集之前患者均知情同意。在超净台内用无菌PBS反复冲洗,刮取牙根中部1/3的牙周膜组织置于6 cm培养皿中,加入1 mL培养液使其在皿底铺平,吸弃多余培养液,于37 ℃ 5% CO2培养箱内孵育4 h后加入4 mL培养基。待细胞密度达70%~80%后常规传代,选取第3~5代细胞用于后续实验。
1.3 实验分组
对照组:含10%胎牛血清的DMEM培养液。
实验组:在含10%胎牛血清的DMEM培养液中加入IS,使其终浓度分别为62.5、125、250、500、1 000 μmol/L。
1.4 IS对hPDLCs细胞活性的影响
取第3~5代生长状态良好的hPDLCs,以1.6×104/mL密度接种于96孔板。于37℃ 5% CO2培养箱中培养24 h,按上述实验分组加入不同干预,再次培养24、48、72 h。加入配置好的0.5 mg/mL MTT溶液,避光孵育4 h,使用酶标仪检测OD (490 nm)。以未加细胞的培养基孔为基准进行调零。
1.5 IS对hPDLCs炎症因子基因和蛋白表达水平的影响
1.5.1 基因检测 将细胞以2×105/mL密度接种于6孔板,于37 ℃ 5% CO2培养箱中培养24 h,按实验分组加入不同干预,培养箱内孵育4 h。用RNAiso Plus裂解细胞,提取细胞总RNA,反转录获得cDNA,加入引物以及SYBR,在实时荧光定量系统内进行基因扩增。采用相对定量2-△△CT法计算目的基因的相对表达量。引物序列见表1。
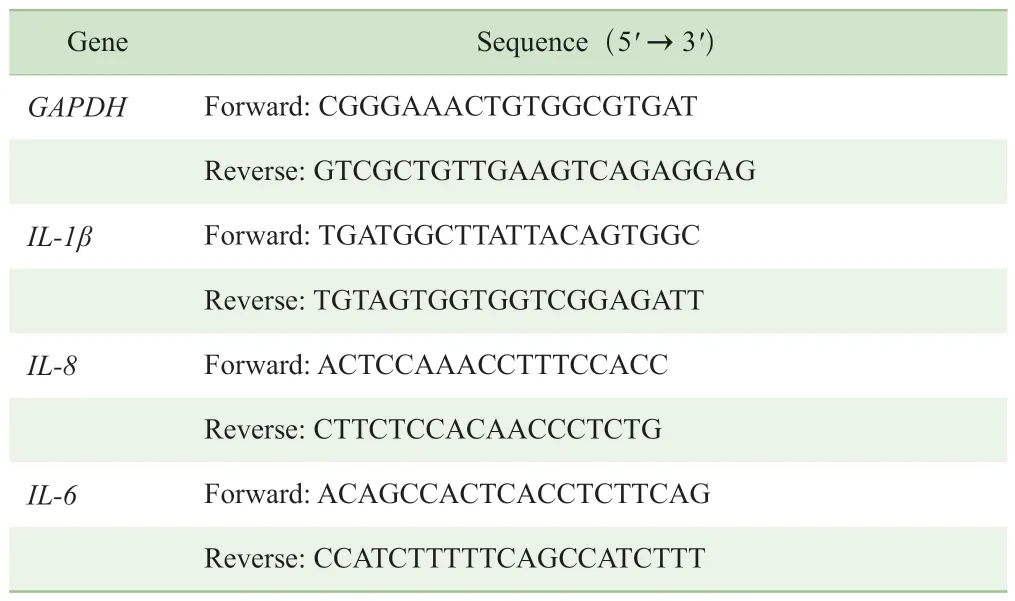
表1 基因引物序列Tab 1 Primer sequences for target genes
1.5.2 蛋白检测 将hPDLCs以2×105/mL密度接种于6孔板,于37 ℃ 5% CO2培养箱中培养24 h,按实验分组加入不同干预,培养箱内孵育4 h后收集上清。取上述不同浓度IS处理4 h后的细胞上清,按照ELISA试剂盒说明书要求检测IL-1β、IL-8、IL-6的浓度,实验重复3次。
1.6 IS对hPDLCs ROS表达的影响
hPDLCs以2×105/mL密度接种于24孔板,于37 ℃5% CO2培养箱中培养24 h,按实验分组加入不同干预,培养箱内孵育4 h,吸弃上清。用无血清培养液稀释荧光探针DCFDA,使其终浓度为10 μmol/L,每孔加入500 μL。置于培养箱内孵育30 min后用荧光酶标仪检测细胞内荧光强度(激发光495 nm,发射光525 nm),使用荧光显微镜观察、拍摄各组细胞的荧光图像。
1.7 统计分析
使用Graphad Prism 6.0软件对实验数据进行统计学分析。定量资料采用±s表示。采用单因素方差分析法进行数据统计分析,P<0.05表示差异有统计学意义。
2 结果
2.1 IS对hPDLCs增殖活性的影响
如图1所示:24 h时,与对照组相比,62.5 μmol/L IS浓度组细胞增殖活性无明显变化(P>0.05);125、250、500、1 000 μmol/L IS浓度组细胞增殖活性显著下降(P<0.05),且细胞活性与IS浓度呈负相关。48 h时,125、250、500、1 000 μmol/L IS浓度组可观察到细胞增殖活性受到抑制(P<0.05),且抑制作用与IS浓度呈正相 关。72 h时,125、250、500、1 000 μmol/L IS浓度组细胞增殖活性与对照组相比均受到抑制(P<0.05),且抑制作用与IS浓度呈正相关。125 μmol/L的IS作用于hPDLCs 72 h时的细胞相对生存率(0.706±0.039)较48 h时(0.849±0.038)显著下降(P<0.05)。500 μmol/L的IS作用于hPDLCs 72 h时的细胞相对生存率(0.417±0.097)也较48 h时(0.662±0.119)明显下降(P<0.05)。500、1 000 μmol/L IS浓度组的细胞增殖活性随着IS作用时间延长而下降。
结果表明,125 μmol/L的IS即可对hPDLCs的增殖活性产生抑制作用,IS对hPDLCs的抑制作用呈浓度和时间依赖性。
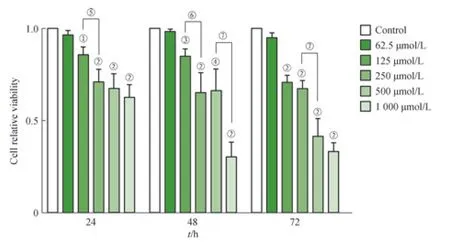
图1 IS对hPDLCs的增殖活性影响Fig 1 Effect of indoxyl sulfate on the cell viability of hPDLCs
2.2 IS对hPDLCs炎症因子mRNA表达水平的影响
如图2所示:IS刺激hPDLCs 4 h时,与对照组相比,62.5 μmol/L IS浓度组的IL-1βmRNA表达量增加,而IL-6、IL-8mRNA的表达无明显变化;125 μmol/L IS浓度组的IL-1β、IL-6和IL-8mRNA表达量均增加(P<0.05);IL-1β、IL-6和IL-8mRNA表达量与IS浓度呈正相关。结果显示hPDLCs炎症因子表达对IS呈浓度依赖性。
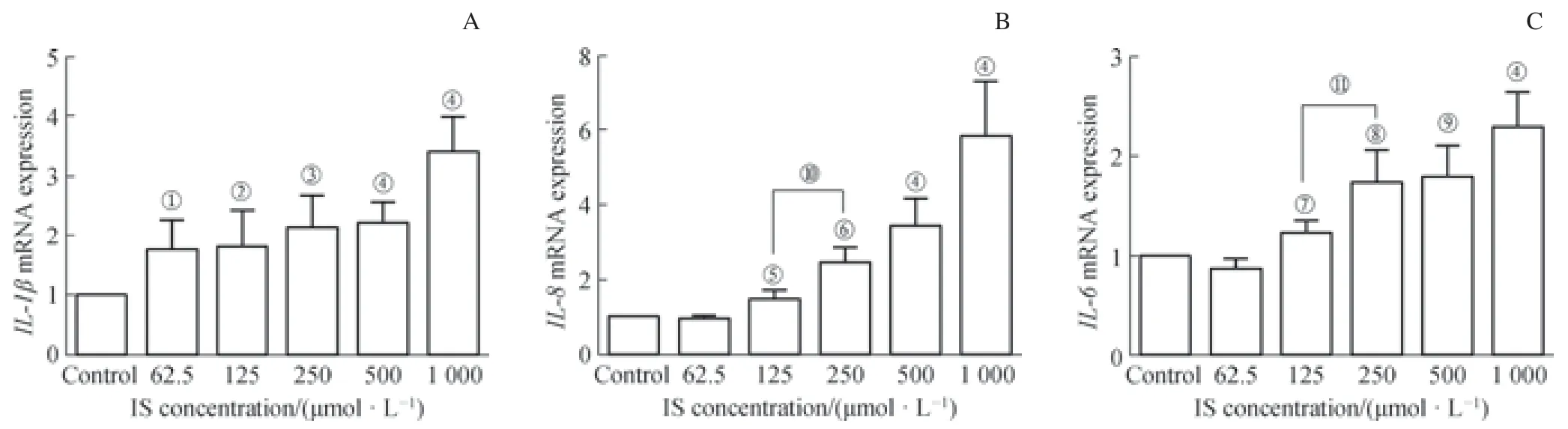
图2 IS对hPDLCs炎症因子mRNA表达的影响Fig 2 Effect of indoxyl sulfate on cytokines mRNA expression of hPDLCs
2.3 IS对hPDLCs炎症因子蛋白表达水平的影响
如图3所示:4 h时,与对照组相比,62.5 μmol/L IS浓度可上调细胞内IL-1β、IL-8蛋白的表达(P<0.05);125 μmol/L IS浓度可促进细胞内IL-6蛋白的表达(P<0.05)。结果表明,IS可促进hPDLCs细胞中炎症因子IL-1β、IL-8和IL-6蛋白的分泌,蛋白表达量与IS浓度呈正相关,且具有浓度依赖性。
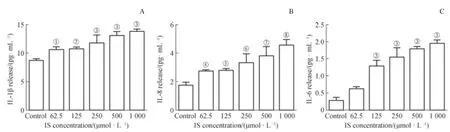
图3 IS对hPDLCs炎症因子蛋白表达的影响Fig 3 Effect of indoxyl sulfate on cytokines protein expressions of hPDLCs
2.4 IS对hPDLCs胞内ROS表达的影响
如图4所示:与对照组相比,125 μmol/L IS作用于hPDLCs 4 h时即可见细胞内ROS荧光强度增强,且随着IS浓度的增加hPDLCs胞内ROS荧光强度进一步增强。

图4 IS对hPDLCs ROS表达的影响Fig 4 Effect of indoxyl sulfate on ROS production in hPDLCs
3 讨论
牙周炎是一种由病原微生物感染所致的宿主炎性破坏性疾病。宿主免疫应答在牙周炎的发生发展中起重要作用,机体免疫系统紊乱会导致牙周感染概率或程度的增加[12]。近年来,氧化应激在牙周炎发展中的作用逐渐受到重视,许多研究认为氧化应激的直接和间接参与是导致牙周组织破坏的关键因素。牙周炎可以是氧化应激相关的全身疾病的局部表现,也可以通过氧化应激来加速全身疾病的进展[13]。IS是CKD患者肾功能衰退后在体内大量蓄积的毒素[14],尿毒症患者的血清内IS浓度较健康人群高43~88倍[15]。血液中IS的增加与肾小球硬化、肾纤维化和CKD的进展以及心血管疾病的不良结局密切相关[16]。IS可促进ROS表达增加,破坏体内抗氧化系统的平衡,造成内皮细胞、肾小管上皮细胞、神经细胞等损伤。IS以多种途径诱发炎症免疫反应:IS进入T细胞可使其向Th17细胞分化,引起免疫功能紊乱;IS与蛋白结合可影响单核细胞的趋化功能从而刺激促炎因子的释放,使机体处于炎症状态;IS可促进脂肪细胞TNF-α的表达,促进动脉粥样硬化斑块的形成。而氧化损伤及免疫炎症反应中产生的过量炎症介质与牙周炎的发生发展密切相关。
已有研究[17-18]表明,IS可抑制巨噬细胞、胶质细胞、内皮细胞、血管平滑肌细胞及肾脏细胞的增殖及代谢,且呈时间及浓度依赖性。本研究参考尿毒症患者体内平均IS浓度以及最大浓度(尿毒症患者体内平均IS浓度为211 μmol/L,最大浓度为940 μmol/L)[19]设立浓度梯度进行实验,发现125 μmol/L的IS可对hPDLCs的增殖活性产生抑制作用,且IS对hPDLCs的抑制作用呈浓度和时间依赖性。hPDLCs是一类具有多向分化能力的间充质干细胞,若hPDLCs的生物学功能受到损害,将会导致牙周组织再生修复能力下降[20]。IS可通过增加肾小管上皮细胞中ROS的表达以及细胞凋亡蛋白酶-3的表达,促进肾小管上皮细胞凋亡[21]。IS也可通过ROS的表达抑制肠黏膜上皮细胞增殖[22]。本研究中,经IS处理的细胞胞内ROS表达明显上升,IS浓度为125 μmol/L的细胞胞内ROS上升显著,与细胞增殖受抑制IS浓度一致。由此表明,ROS可能在IS抑制hPDLCs增殖中起作用。
菌斑微生物是牙周炎的始动因子,但牙周炎所造成的病理破坏不仅与菌斑微生物相关,还与免疫应答产生的炎性因子密切相关。牙周炎患者的龈沟液及血清中常可检测到多种炎症因子水平增高,而炎症过程中免疫细胞及牙周组织细胞产生的炎症因子又进一步促进牙周炎的发生发展[20]。体外实验研究[23-24]发现,经腹腔注射IS的小鼠肾脏组织中炎症因子IL-1β、IL-6水平明显上升,且与肾脏纤维化密切相关;IS还可激活单核巨噬细胞IL-1β的表达。IL-1β是牙周炎发展过程中重要的炎症因子,可激活淋巴细胞及单核细胞,其水平与牙周炎的一系列病理变化有关,包括上调炎症性细胞因子、趋化因子、转录因子、基质金属蛋白酶、黏附分子等;IL-1β还可抑制碱性磷酸酶表达,抑制组织形成,激活破骨细胞,刺激破骨细胞产生前列腺素E2并导致牙槽骨丧失[25]。IL-8是一种具有广泛生物学效应的促炎趋化因子,可激活体内中性粒细胞、嗜碱性粒细胞和淋巴细胞,使其释放溶菌酶,并增强溶菌酶的活性及吞噬效应,导致相应组织器官的病理损伤。Gamonal等[26]发现牙周炎患者龈沟液中的IL-8水平显著高于正常对照者,提示IL-8可能是牙周炎的标志性炎症因子之一。IL-6是一种多效应细胞因子,是牙周炎与CKD共同的炎症因子,在牙槽骨的破坏中充当重要角色,其浓度与牙周炎的发生发展及其破坏程度密切相关。IL-6可通过增加急性期反应蛋白的产生加重炎症反应,抑制hPDLCs生长,诱导破骨细胞的分化成熟,影响牙周组织健康[27]。Kobayash等[28]发现健康牙周组织中IL-6含量极少,在探诊深度>3 mm位点的牙周组织中分泌量增多,而在探诊深度>6 mm位点的牙周组织尤为明显,牙周组织中IL-6含量与探诊深度密切相关。本研究发现,IS在浓度为125 μmol/L时可上调hPDLCs炎症因子IL-1β、IL-6、IL-8mRNA和蛋白的表达水平,且促炎作用呈浓度依赖性,表明IS可诱导hPDLCs产生炎症反应。关于IS促进炎症因子释放,有研究[15,29]表明其可以通过体内ROS的产生以及激活核转录因子κB产生各种细胞因子和炎症介质,从而导致肾脏受损。本研究中,125 μmol/L的IS可以上调hPDLCs炎症因子、蛋白的表达,与ROS表达增加相符,与前述研究结果一致。
氧化损伤与牙周炎的严重程度密切相关,牙周炎患者的唾液和血液中的ROS水平高于牙周健康人群[30]。高水平ROS是牙周炎患者探诊深度、附着水平、牙龈指数的危险因素[31]。在正常生理情况下,机体内ROS的产生与清除处于动态平衡,ROS可维持在无害的极低水平。但当机体代谢异常时,大量ROS自由基的产生或机体抗氧化物质的不足可导致氧化与抗氧化失衡,使机体处于氧化应激状态,并进一步引发以细胞死亡和组织损伤为表现的一系列病理过程[32]。Lin等[33]发现浓度为10 μmol/L的IS可通过增加ROS水平导致细胞凋亡。ROS可通过直接破坏牙周支持组织以及间接免疫损伤造成牙周炎的发生发展[34-36]。本研究发现当IS浓度为125 μmol/L时可增加hPDLCs中ROS的表达,且ROS表达量与IS浓度呈正相关。氧化应激的产生是IS导致肾脏、血管平滑肌细胞损伤的最主要因素,其核心为IS导致细胞内炎性小体激活,使得炎症因子增加[37]。本研究与上述研究结果一致,hPDLCs增殖及炎症因子表达与ROS表达同步,表明ROS在IS对hPDLCs生物学特性的影响中可能起到重要作用,但其具体机制仍需进一步实验探究。
本研究通过使用生理范围内不同浓度的IS刺激hPDLCs,发现125 μmol/L浓度水平的IS可抑制其增殖,并上调相关炎症因子及ROS的表达水平。初步证实了IS可能是CKD患者更易罹患牙周炎的关键因素之一。该结果为CKD的治疗提供了潜在的新思路,但IS作用于hPDLCs的具体机制仍有待进一步研究。

