人血浆7α-羟基-4-胆固醇烯-3-酮及胆汁酸的超高效液相色谱-串联质谱定量方法研究
上海交通大学附属第六人民医院转化医学中心,上海200233
胆汁酸(bile acid,BA)是胆固醇在肝脏分解代谢的最终产物,是体内类固醇/甾醇排泄的主要形式[1]。研究[2-4]表明BA不仅在食物消化、吸收方面具有重要的生理功能,同时也是机体内一种重要的信号调节因子,在能量代谢、糖脂代谢等方面发挥非常关键的作用。BA的合成是由肝脏胆固醇首先在胆固醇7α-羟基化酶(cholesterol 7α-hydroxylase,CYP7A1)作用下进行7α-羟基化,或者在固醇27-羟化酶(sterol 27-hydroxylase,CYP27A1)作用下进行27-羟基化开始的,即BA合成的“经典途径”与“替代途经”[5]。人体中90%的BA主要靠经典途径合成[6-7]。在经典途径中,胆固醇的7α-羟基化是胆汁酸合成中的关键步骤,由限速酶CYP7A1所催化[8],随后经3β-羟基-Δ5-C27-类固醇脱氢酶(3β-hydroxyl-Δ5-C27-steroid dehydrogenase,HSD3B7)转化为7α-羟基-4-胆固醇烯-3-酮(7α-hydroxy-4-cholesten-3-one,C4)。既往研究[9]表明血浆C4的浓度水平与肝脏CYP7A1活性相关,因此,C4被认为是表征CYP7A1活性的重要代谢物,同时它也是合成胆酸(cholic acid,CA)、鹅去氧胆酸(chenodeoxycholic acid,CDCA)的前体物质。因此,C4是反映肝脏胆汁酸合成水平的重要生物标志物[10-13]。
研究报道检测血中C4的方法多集中于对C4单一物质的定量。Jean-Christophe等[14]通过对人血清C4的定量协助诊断胆汁酸吸收不良症;Akira等[15]使用液相色谱-串联质谱定量血清中C4的水平以反映BA的合成;DeBarber等[16]通过定量人血浆C4的含量快速、简便地诊断脑腱黄瘤病(cerebrotendinous xanthomatosis,CTX)。
本研究拟建立基于超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)技术的定量方法,同时定量C4及C4的下游代谢产物,即肝脏胆固醇分解代谢产生的2个初级胆汁酸CA和CDCA(可以反映肝脏胆固醇转化成胆汁酸时关键酶CYP7A1的活性,还在一定程度上表征了肝脏合成胆汁酸的水平),并将该方法应用于临床糖尿病患者血浆中C4、CA、CDCA的含量变化研究。
1 对象与方法
1.1 研究对象
连续纳入2019年4月—5月参与上海交通大学附属第六人民医院内分泌科口服葡萄糖耐量试验的志愿者35人,以世界卫生组织(World Health Organization,WHO)糖尿病诊断与分型标准为依据将35名志愿者分为3组:糖尿病前期组10人,糖尿病组15人,正常健康对照组10人;3组之间年龄、性别比较无统计学差异。所有患者均知情同意且签署知情同意书。
1.2 主要试剂
C4与氘代同位素7α-羟基-4胆固醇烯-3-酮(d7-C4),购自加拿大Toronto Research Chemicals公司,CA和CDCA标准品均购自美国Steraloids公司,氘代同位素胆酸(d4-CA)、氘代同位素鹅去氧胆酸(d4-CDCA)均购自加拿大C/D/N ISOTopes 公司,色谱纯的乙腈和甲醇购自美国Thermo Fisher Scientific公司,色谱纯甲酸购自美国Sigma-Aldrich公司,超纯水[电阻率18.2(MΩ·cm)]为Milli-Q纯水仪制备。
1.3 方法
1.3.1 样本前处理 分别使用含有肝素抗凝剂的负压采血管收集35名试验对象的静脉血各3 mL。采血后上下颠倒管子,使血液与肝素混合均匀。1 006×g离心10 min,分离,取上层得到血浆样本。血浆质控(quality control,QC)样本为所收集的35例试验对象的血浆各取100 μL混合而成,共3 500 μL。
测试血浆样本前处理过程:精密吸取各试验对象的血浆50 μL置于1.5 mL离心管中,加入200 μL的乙腈(含d7-C4、d4-CA、d4-CDCA同位素内标,浓度均为50 nmol/L),涡旋5 min。于-20 ℃下放置20 min后在4 ℃,20 375×g离心10 min,取上清液200 μL,待测。
标准曲线样本的前处理:C4的标准品储存液浓度为100 μmol/L,CA和CDCA的标准品储存液浓度为200 μmol/L。3种标准品储存液各取10 μL混合均匀,再加入970 μL甲醇稀释成C4为1 000 nmol/L、CA和CDCA均为2 000 nmol/L的标品混合液。之后用甲醇逐级稀释成8个浓度梯度(STD1~STD8),其中C4浓度梯 度 为5、10、25、50、100、250、500、1 000 nmol/L;CA和CDCA浓度梯度为10、20、50、100、200、500、1 000、2 000 nmol/L。分别精密吸取各浓度点的标准溶液50 μL置于1.5 mL离心管,按测试血浆样本的前处理过程处理。
1.3.2 仪器测定条件 色谱系统为Waters公司Acquity™UPLC,色谱柱为ACQUITY UPLC®BEH C18(2.1 mm×100 mm,1.7 μm),保护柱为ACQUITY UPLC®BEH C18 vanGuard™ Pre-Column(2.1 mm×5 mm,1.7 μm)。流动相A为含0.01%甲酸的去离子水,流动相B为含0.01%甲酸的乙腈-甲醇(体积比9:1),柱温45 ℃。梯度洗脱程序见表1。

表1 C4与BAs的梯度洗脱程序Tab 1 Gradient elution of C4 and BAs
试验的质谱系统为Waters公司Xevo®TQ,采用电喷雾电离(electrospray ionization,ESI)离子源,毛细管电压3kV(正离子模式,ES+),2.5 kV(负离子模式,ES-),干燥气温度500 ℃,干燥气流速1 000 L/h,锥孔气50 L/h,碰撞气流速0.14 mL/min,离子源温度150 ℃。数据采集采用多重反应监测模式(multiple reaction monitoring,MRM)。C4及其同位素内标d7-C4在正离子模式下监测,CA、CDCA与其同位素内标d4-CA、d4-CDCA在负离子模式下监测,C4、BAs及其同位素内标的定量离子对见表2。
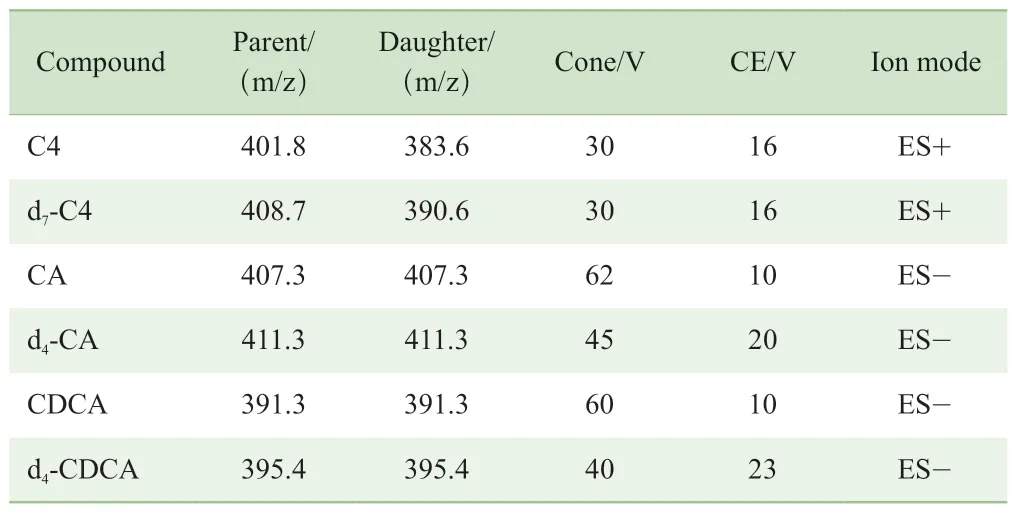
表2 C4、BAs和同位素内标的定量离子对Tab 2 Quantitative ion pairs of C4, BAs and isotopic internal standards
1.4 检测项目
1.4.1 提取溶剂的选择 为了有效地提取血浆中C4、CA和CDCA,本实验一共设计5组提取溶剂,为不同比例的乙腈-甲醇,体积比分别为1:0,4:1,1:1,1:4,0:1。平行取5份QC样本,每份50 μL,分别加入以上5种提取溶剂,按1.3.1的处理方法进行样本前处理,比较5种提取溶剂下C4、CA和CDCA的色谱峰形与响应值大小,确定最佳提取溶剂。
1.4.2 检出限、定量限和线性 检出限(limits of detection,LOD)和定量限(limits of quantitation,LOQ)是用一系列已知浓度的标准品溶液测试,计算不同浓度下各物质的信噪比(signal-noise ratio,S/N)。随着浓度的降低,每个物质测定的信噪比也会降低。本研究将一系列已知浓度的3种标准品混合溶液上机测试,C4、CA、CDCA浓度相同,分别为0.01、0.02、0.04、0.08、0.16、0.32、0.64、1.28、2.56 nmol/L。取S/N≥3的浓度作为各标准品的LOD,取S/N≥10的浓度作为各标准品的LOQ。
标准曲线样本按1.3.1中标准曲线样本处理方法处理后检测。以标准品的浓度为横坐标,以物质峰面积(compound peak area)和对应内标峰面积(internal standard peak area)的比值为纵坐标(response,R),建立线性回归方程,考察方法的线性。
1.4.3 重复性 平行取6份标准品混合液(C4浓度为100 nmol/L,CA和CDCA浓度为200 nmol/L),6份QC样本,按1.3.1方法处理后测试,分别计算6次测试浓度的相对标准偏差(relative standard deviation,RSD),评估方法的重复性。
1.4.4 日内精密度、日间精密度 取3份标准品混合液(C4浓度为100 nmol/L,CA和CDCA浓度为200 nmol/L),3份QC样本,按1.3.1中对应样本处理方法处理后,1 d内测试3次,每次重复测试3针,分别计算所测试浓度的RSD,考察日内精密度。
取9份标准品混合液(C4浓度为100 nmol/L,CA和CDCA浓度为200 nmol/L),9份QC样本,按1.3.1中对应样本处理方法处理,每日处理3份,1 d内测试3次,每次重复测试3针,连续3 d,分别计算每日所测试浓度的RSD,考察日间精密度。
1.4.5 加标回收率 混合QC中分别加入低、中、高浓度的C4、CA和CDCA的标准品混合液后,按1.3.1中QC样本处理方法处理,通过标准曲线计算加入标准品混合液前后QC样本中C4、CA和CDCA的浓度,计算各自的加标回收率。
1.4.6 稳定性 取3份QC样本,按1.3.1中QC样本处理方法处理后,每份取30 μL提取液立即测试作为0 h结果,每份剩余提取液密封存放于4 ℃冰箱保存,并分别于12、24、48、72、96 h和7 d,6个时间点每份各取30 μL进行测试,通过比较每份其余各时间点的浓度与0 h浓度的RSD,评估样本在4 ℃存放的稳定性。
1.4.7 方法应用 用本文建立的方法,分别测试每个血浆样本中C4、CA、CDCA的离子对峰面积,并采用标准曲线法定量每个血浆样本中C4、CA、CDCA的含量。计算糖尿病前期组、糖尿病组、健康对照组中C4、CA、CDCA的平均值,考察并比较这3种物质在各组中的变化情况。
1.5 统计学分析
使用GraphPad Prism 8.0软件进行显著性分析,采用t-test双尾检验,P<0.05为差异有统计学意义。使用SPSS 22.0软件进行相关性分析,采用Spearman相关检验方法,P<0.05为有相关性。
2 结果
2.1 提取溶剂
5种提取溶剂测试结果显示:不同提取溶剂提取QC样本,对C4的提取效率影响最大。其中纯乙腈提取C4的峰强度最强,干扰峰最少,而对CA、CDCA的影响相对较小。综合考虑,确定乙腈为最终提取溶剂,提取离子峰见图1。

图1 C4、CA和CDCA的提取离子流色谱图Fig 1 Extracted ion chromatograms of C4, CA and CDCA
2.2 C4、CA和CDCA的检出限、定量限和线性
通过计算标准品溶液测定结果的信噪比(S/N)确定3种物质C4、CA和CDCA的LOD分别为0.16、0.02和0.04 nmol/L,LOQ分别为0.32、0.04和0.16 nmol/L。线性结果显示:C4在5~1 000 nmol/L浓度范围内,CA、CDCA在10~2 000 nmol/L浓度范围内均具有良好的线性关系,满足定量要求(表3)。
2.3 C4、CA和CDCA的重复性
标准品溶液和QC样本各自平行处理6份,6份测试结果的RSD显示该方法C4、CA和CDCA的重复性良好,标准品溶液和QC样本中3种物质的RSD均低于3%,如表4所示,满足定量要求。
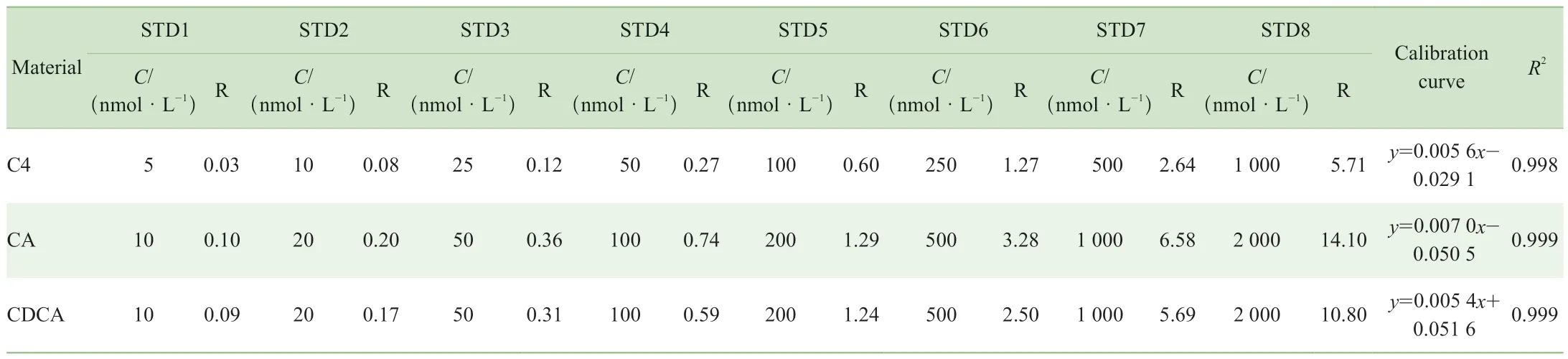
表3 C4、CA 和CDCA的浓度梯度与线性关系Tab 3 Concentration gradient and linear relationships of C4, CA and CDCA
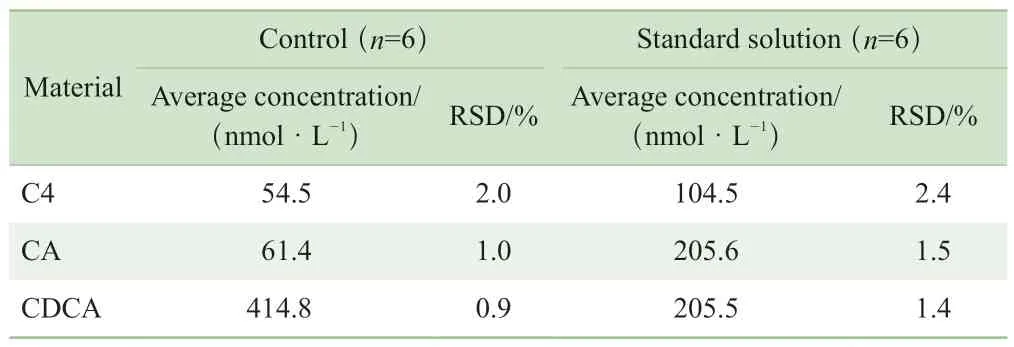
表4 C4,CA 和CDCA的重复性Tab 4 Repeatabilities of C4, CA and CDCA
2.4 C4、CA和CDCA的日内精密度和日间精密度
标准品溶液和QC样本中C4、CA和CDCA的日内精密度的RSD均低于5%;两者日间精密度第1日结果在6%以内,第2日结果在4%以内,第3日结果在5%以内。如表5所示,该方法的日内精密度与日间精密度良好,RSD符合定量要求。
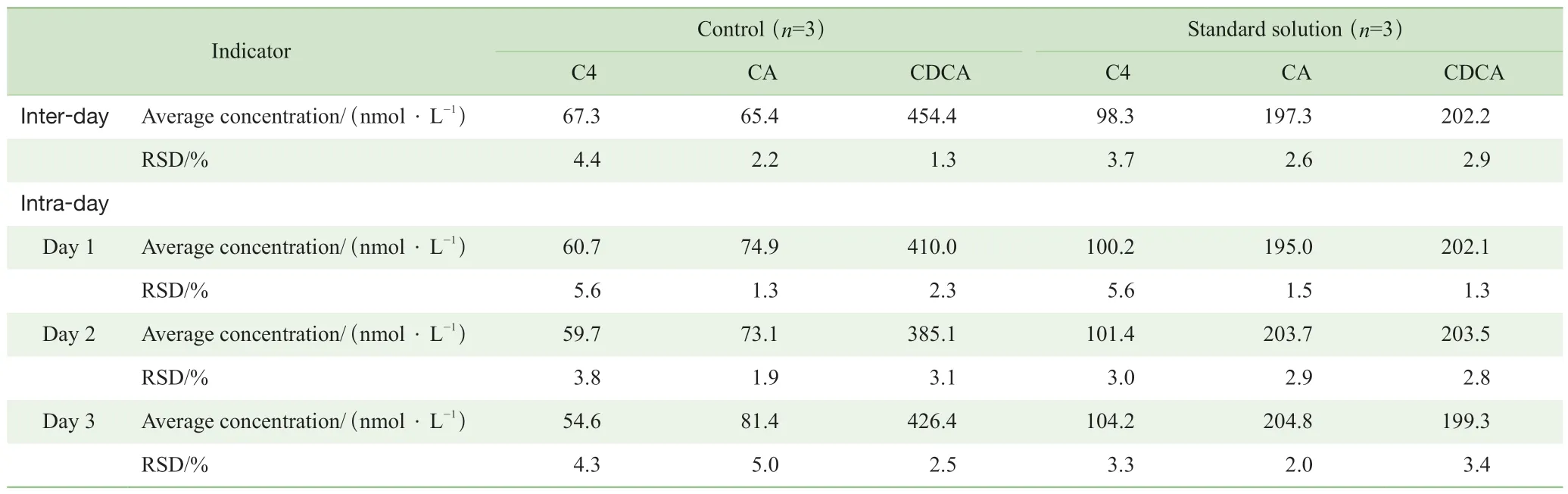
表5 C4、CA 和CDCA的日内精密度与日间精密度结果Tab 5 Inter-day and intra-day RSDs of C4, CA and CDCA
2.5 C4、CA和CDCA的加标回收率
加标回收率结果显示,C4、CA、CDCA的平均加标回收率分别是97.7%、113.3%、105.0%,且3种物质在中、高2个浓度下的回收率良好(表6)。

表6 C4、CA 和CDCA的加样回收率Tab 6 Recovery rates of C4, CA and CDCA
2.6 C4、CA和CDCA的稳定性
通过将12、24、48、72、96 h及7 d各时间点QC样本的测试结果与0 h的测试结果相比较,得出C4、CA和CDCA在各时间点的浓度与0 h浓度的RSD均小于10%(表7),说明经该方法处理后样本在4 ℃条件下能够稳定存储(7 d内)。
2.7 方法应用
本研究采用上文建立的方法,对10例健康对照、10例糖尿病前期和15例糖尿病患者血浆中C4、CA和CDCA的浓度进行了定量测定。结果表明,糖尿病组血浆C4浓度与健康对照组相比显著下降(P<0.05),但糖尿病前期组与健康对照组相比血浆C4浓度没有显著性改变。同时,糖尿病前期组与糖尿病组相比血浆C4浓度差异无统计学意义。同样的,血浆中CA和CDCA与C4表现出相似的情况(图2)。
进一步通过相关性分析可知,血浆中C4浓度与血浆CDCA的浓度呈现明显的正相关关系(r=0.554,P=0.000),如图3所示。
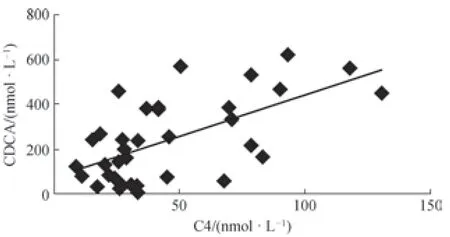
图3 血浆中C4与CDCA浓度的相关性Fig 3 Correlation of C4 and CDCA in plasma
3 讨论
血浆中C4被看作是肝脏合成BA时表征CYP7A1活性的一个重要生物标志物[17-18],一直以来备受关注,也诞生了各种检测手段。质谱检测仪器的高灵敏度与高特异性,使得检测结果更为准确可靠。而相对于气相色谱-质谱联用技术(gas chromatography-mass spectrometry,GCMS),UPLC-MS/MS由于在样本前处理部分不需要进行衍生化而缩短了样本制备时间,大大降低了检测的时间成本。而BA除了在脂肪乳化中的传统作用外,还是机体重要的信号分子。因此,在生物学和医药学领域内的BA研究日益增多,对检测的敏感性要求也更高[19]。根据研究报道,绝大多数基于质谱的检测方法都集中在对C4的定量,而未同时定量BA合成的实际水平。本研究建立了一种能同时定量C4和BA含量的方法,经验证具有高灵敏度、准确度和快速等特点。
本研究建立的方法经过对血样进行简单前处理后,采用UPLC-MS/MS对C4,以及C4下游合成的CA和CDCA同时进行定量。该方法经方法学考察符合准确定量的要求,适用于临床样本的定量检测。其中C4的加标回收率结果显示,在加入低浓度标准品溶液时,由于基质效应的影响,C4的加标回收率结果较差(78.0%)。随着加入的标准品溶液浓度增大,这种影响会降低,能够得到较好的回收率结果,这与Jean-Christophe 等[14]的实验结果一致。使用该方法对所收集的临床糖尿病患者血浆样本进行C4、CA和CDCA定量,发现糖尿病患者血浆中C4含量显著低于健康人水平,表明糖尿病患者BAs合成能力下降。且C4合成的下游BA CA和CDCA水平均分别低于健康对照组,这也印证了BA合成的减少。由于CYP7A1是经典胆汁酸合成途径中唯一的限速酶,因此C4的含量高低与CYP7A1的活性呈正相关,C4浓度水平的下降主要反映CYP7A1活性的减弱,而胆汁酸合成中的经典途径主要合成CA和CDCA 2种初级胆汁酸,CYP7A1活性的减弱会直接影响到这2种初级胆汁酸的合成水平,这与我们的检测结果是一致的。同时,血浆C4浓度与CDCA浓度呈现显著的正相关关系,表明C4浓度的下降将主要影响到CDCA的合成,提示糖尿病患者血胆汁酸水平的降低可能与初级胆汁酸CDCA的合成减少有直接关系,这为研制靶向药物及制定临床干预措施提供了重要的依据。
综上所述,利用UPLC-MS/MS同时定量C4和CA、CDCA的方法简单可靠、实用性强。结合胆汁酸水平,可以获得人体胆汁酸代谢情况,为临床疾病的预后和诊断提供依据。

