工程水质简分析中应注意的问题及数据的合理性检验
毛雪梅
(甘肃省地质矿产勘查开发局第四地质矿产勘查院,甘肃 酒泉 735000)
建设生态文明的现代化强国是国家战略之一,相关部门在进行决策和监管时,水质检测作为基础依据,精准以及合理的水质检测结果尤为重要。然而,在水质检测过程中,检测环节多、水质成分复杂等都可能会影响到检测数据的准确性、科学性,为了保证数据的科学性,需要进行合理性、科学性分析。我国自然界中蕴含着丰富的水资源,这些水资源的水质成分原本就比较复杂,伴随着工农业发展,加剧水质成分的复杂化。但总的来说,水质成分中存在耦合关系,其表现为相对固定性,对于部分元素而言,其耦合性表现亲密,则规律性有稳定的特征。水质检测是否科学,除了借助内在规律判断,耦合关系也是一个重要指标,通过两者,可以合理性分析实验室检测水质检测所得的数据[1]。
1 水质简分析中应注意的问题及解决方法
1.1 莫尔法测定水中的Cl-
在实际试验操作中,莫尔法选取的指示剂一般为K2CrO4,对Cl-的滴定则选取AgNO3溶液,一般需要在弱碱性或者中性环境中进行。在进行滴定时,判定滴定是否达到终点的标准是从黄色的溶液颜色变成微砖红色。采用莫尔法来测定水中的Cl-时,有以下几点需要操作人员注意:
(1)莫尔法对溶液的PH值有很高的要求,原因如下:①在滴定过程中,当溶液PH值大于10.5时,溶液中会产生黑色的沉淀,其成分为氧化银。为了不影响检测结果,需中和溶液,选用醋酸,浓度为1%作为中和试剂即可。②在滴定过程中,当溶液PH值小于6.5时,由于溶液过强的酸性,会拖后终点。为了不影响检测结果,需中和溶液,选用碳酸钠,浓度为0.5%作为中和试剂即可。
(2)在滴定作业过程中,会出现难以判断滴定终点的情况。作为指示剂,铬酸钾使用量过少,红色会过早出现;使用量过多,红色会较晚出现,这些都影响着终点颜色的出现和观察。通过大量的实验数据,发现将铬酸钾加入试剂时,应当保持0.1g/100ml的比例,这样做出来的铬酸钾指示剂效果最好。同时,为了防止出现终点提前,在滴定过程中,应当摇晃滴定瓶以避免出现氯化银,氯化银会吸附溶液中Cl-,影响效果。滴定瓶的摇晃,应当在不溅出溶液以及保证滴定瓶完好无损的情况下,剧烈晃动。
(3)在进行滴定时,水样中过高含量的Cl-对滴点终点的观察不利,主要是因为氯化银这种白色沉淀物的产生。所以,进行测定前,要适当稀释溶液中的Cl-。
1.2 EDTA滴定水中的Ca2+、Mg2+
试验原理:
在实验过程中,所生成配合物的稳定性CaIn-最小、依次为MgIn-、MgY2-,CaY2-最大。在进行滴定前,溶液的PH要先调到10,然后加入少许铬黑T指示剂,在与Mg2+发生反应后生成MgIn-,颜色呈现酒红色。进行滴定时,溶液中游离的镁离子、钙离子与ED-TA发生化学反应结合成MgY2-、CaY2-,其化学反应式为:

该方法在具体操作中,所选用的指示剂会因PH值的不同而有不同的选择,指示剂选用铬黑T适用于在PH=10;指示剂选用紫脲酸铵适用于PH值在12~13范围内。在实际操作中,常见的问题以及解决办法如下:
(1)在测定水硬度时,滴点应当在加入指示剂和缓冲溶液后立即进行,并且要在5分钟内完成滴点,以免影响测定质量。滴点过程中,溶液的浓度会发生改变,颜色表现为:酒红、浅红、紫、蓝。在操作过程中,溶液颜色会发生变化,在颜色由浅红色向紫色转变时,说明反应已经差不多完成,所以,要放慢滴定的速度。将1滴EDTA分别滴入每份溶液后,试验人员要剧烈晃动滴定瓶。判断滴定是否为到达终点的标准就是滴定瓶溶液颜色呈现蓝色[2]。
(2)Fe3+、AI3+等金属离子会对指示剂造成干扰,进而影响滴定结果。因此,滴定时,在将缓冲溶液加入溶液前,为了消除金属离子的不利影响,应当将在溶液中加入三乙醇胺,以便能消除溶液中的各种金属离子[3]。
1.3 测定水溶液中的电导率
对物理物理导电能力表征,并对其定量,可用电导率这一物理量表示。本文所指的电导率是水体导电能力的表征。无杂质的水,导电能力微弱;但大自然中的水体一般都含有无机物、有机物,所以其具有一定的导电性。在水质检测中,矿化度采用重量法测定,主要对无机矿物质在水体中的含量进行定量表征。采用重量法测定矿化度,有可能出现误差,其来源主要是以下3方面:
(1)在对水体样本做烘干和蒸发操作时,样本重量会出现减
(2)在烘干水体样本时,NO3-和Cl-会出现部分丢失的情况,如出现MgCl2转化为MgO·MgCl2等情况,就会诱发负误差。
(3)对盐类物质进行烘干操作时,一般选取温度为103℃~105℃。即便进行了烘干操作,因盐类的吸水性,会使得依然含有少量结晶水,这会导致在做质量测定时,出现正误差。水体中离子的种类和含量对水体的矿化度和导电性有影响,有些影响是关键性的。固定的矿化度和导电性取决于水体离子的分布是否相对固定。
2 数据的合理性检测
2.1 电导率与可溶离子总量之间的关系
作为水溶液电阻倒数,电导率是对溶液传导电流能力的表示,在对水样检测时,可通过间接的方式推算出可溶离子的总量。水质比较好的情况下,水中含有少量的可溶性离子,这样电阴大,而电导率小;相反,在水质较差的情况下,水中含有大量的可溶性离子,电阴小,而电导率大。因此,通常判断水质情况可依据可溶离子总量和电导率之间的关系。
2.2 溶液pH值与碱度、游离CO2间的关系
作为审查其他实验结果的依据之一,PH值还同很多实验的分析方法和结果有着紧密的关系。判断水中是否存在或可能存在的游离CO2和碱度,可通过PH值判定,主要是依据OH-、、、CO2相间隔时不能共存,在相邻时可共存的原理。在pH<4时不存在 ;、OH-在pH<8.4时不存在;游离CO2在pH>8.4时不存在;、CO2在PH>12时不存在。
对于干净的天然水而言,PH值在水中含有HCO3-和游离状态的CO2,可用PH=6.37+lg[HCO3-]-lg[CO2]表示;PH值在水中含有HCO3-和时,可 用PH=10.25+lg[CO32-]-lg[HCO3-]表示;PH的实测值和计算所得数值,误差一般不大于0.3。

表1 水样①、②碱度、PH值和游离CO2的关系
由表1可知,PH实测值和计算值在两个水样中相差都不大于0.3,这充分表明了对水样分析所得结果是合理的。在实际操作中,当PH实测值和计算值相减大于0.3时,需要做定性判断。出现这种情况主要是因为各项离子和PH值的测定会有一定误差,特别是在矿化度大、含有较多有机物质的水的情况下。
2.3 总硬度与总碱度之间的关系
总硬度由两部分组成,分别是非碳酸盐硬度和碳酸盐硬度,是对水体中含有碳酸氢根、氯离子以及氢氧根离子总量的反映。当水中碳酸盐和重碳酸盐含量小于Ca2+和Mg2+时,多出来的Ca2+和同水中硝酸盐、硫酸盐以及氯化物发生反应而形成的硬度,即非碳酸盐硬度又称为永久性硬度;水中的碳酸盐和重碳酸盐同Mg2+和Ca2+发生反应而形成的硬度,即碳酸盐硬度又称为暂时硬度。
永久硬度在总硬度<总碱度时,不存在;永久硬度在总碱度<总硬度时,存在;永久硬度=总硬度一暂时硬度。
例如某水样测试结果如表2所示。
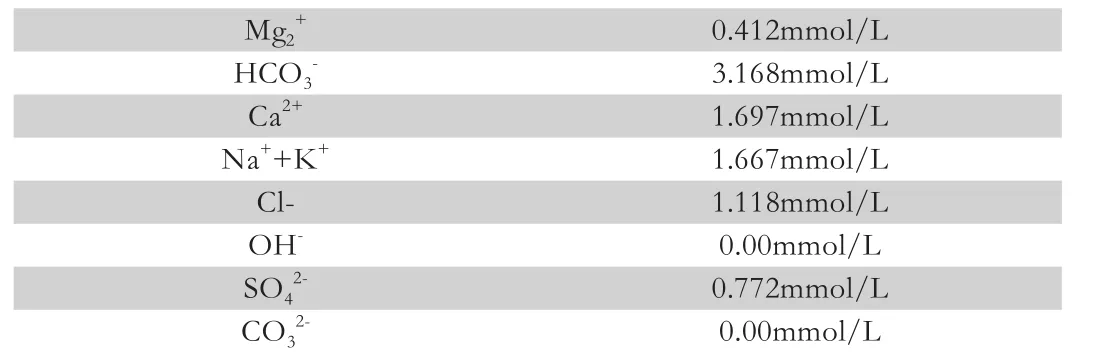
表2 某水样部分离子测试结果
经过验证总碱度和总硬度两者的关系,充分证明了试验结果的科学性和合理性。在验证后,出现矛盾的离子关系时,则要查出原因,并进行纠正。
2.4 水中阴、阳离子摩尔浓度的关系
水中的阴阳离子存在着相互制约、相互联系的关系,只有在阴离子的摩尔浓度和阳离子大致相同的情况下,才能保持水溶液中的阳离子和阴离子的电荷相平衡。基于电荷平衡关系,在对以Ca2+、Mg2+为主的阳离子进行简易的水质分析时,选用“差减法”来计算Na++K+的浓度。当有未测定的其他金属离子或者检测数据有错误时,则会出现Na++K+的浓度为负数,这种情况下,需要采用其他办法对Na+、K+的含量进行测定或重新检查阴阳离子的测定是否准确[4]。
3 总结
本文针对在水质单项检测时需要注意的问题以及解决的办法。为了能更好更真实的反映水体的基本情况,应当避免出现文中所列举的注意事项。在日常的水质检测工作中,应当多实践、多分析,多积累,遇到问题及时查找原因,合理解决,以保证结果的合理性、准确性和科学性。对分析结果用化学平衡原理进行校正和审查,进而提高分析质量。水质成分具有复杂性,在测定时,既要综合考虑,也要综合历史资料,相互验证和核对,以便进行全面分析得出科学合理的结论。

