木炭还原氧化铜实验的分析与改进
刘车


摘要:根据木炭还原氧化铜的热力学数据和反应物的特点,采用蜡烛炭黑代替木炭粉末,进一步增大了固体药品间的接触面积,使木炭还原氧化铜的反应速率更快,现象十分明显。
关键词:接触面积,炭黑,氧化铜
文章编号:1008-0546(2020)05-0096-02 中图分类号:G632.41 文献标识码:B
doi:10.3969/j.issn.1008-0546.2020.05.026
木炭还原氧化铜是人教版九年級化学中的一个重要实验,也是一个现象不明显而又耗时的实验。在酒精灯加热的条件下木炭与氧化铜反应的速率十分缓慢,实验过程中能观察到澄清石灰水变浑浊,但很难观察到黑色粉末逐渐变红的现象,通常只能观察到黑色混合物中的少量固体有不明显的变红迹象。因此,许多教师尝试了不同的改进方法。
一、分析反应原理
木炭还原氧化铜实验可以追溯到我国古代的火法炼铜。古代人们利用炭火灼烧铜矿石得到了大量的青铜。那么,是什么原因导致演示该实验时反应速率缓慢,现象不明显的呢?木炭还原氧化铜是固相反应:2CuO(s)+C(s)=2Cu(s)+CO2(g)。在298.15K时,该反应的热力学数据如表1。
这些数据说明,炭还原CuO既是焓减少的反应又是熵增加的反应,可以自发进行。但是,由于实验中用到的木炭和氧化铜都是固体颗粒,而固体颗粒的大小、形状及混合程度都会影响到药品间的接触面积。如果木炭颗粒和氧化铜颗粒不能充分接触,那么这两种固体间就很难反应。所以,这两种固体间的实际接触面积小是导致该反应需要高温加热,而且速率缓慢的主要原因。要使该反应顺利地快速进行,关键是要增大固体间的接触面积,同时还要利用反应本身放出的热量加快反应速率。因此,实验中所用的木炭粉末和氧化铜粉末应该是越细越好,并且要将两种粉末混合后充分研磨,使木炭粉末和氧化铜粉末最大程度地互相接触,再将混合粉末堆放在试管底部,而不能平铺在试管底部。
二、部分文献中的改进方法
木炭还原氧化铜实验一直是许多教师和教研工作者的研究对象,为了能够观察到明显的实验现象,缩短反应时间,不少教师从改变药品、装置或热源等方式进行了改进。穆玉鹏把表面形成氧化铜薄膜的铜片埋人滑性炭中,用酒精灯加热,发现铜片变亮,氧化铜被还原。李颖等在自制的胖肚管内分别做了木炭粉和氧化铜粉末反应,以及木炭粉和表面有氧化铜的铜条反应两个实验,现象比较明显。庭开军证实了在木炭和氧化铜的混合物中加入CaCl2、MgCl2等金属氯化物可降低反应的温度要求,用酒精灯小火加热就可以反应,且加热时间短,反应速率快,成功率高达100%。周文元使用酒精喷灯加热平卧型装置中的烧烤用机制炭粉末和氧化铜粉末的混合物,得到了亮红色铜块。虽然这些改进方法取得了成功,但是与课本中的实验相比有较大的不同。还有一些教师采用降低炭粉或氧化铜粉末颗粒大小的方法进行了改进。任娟等将木炭和固相反应法制备的纳米氧化铜混合,用酒精灯的外焰加热试管底部约1分钟,发现澄清石灰水逐渐变浑浊,试管底的反应物产生红热现象,冷却后得到了红色的铜。马本良等使用碳素墨水和氧化铜融合后晾干的方法,取得了成功。可见,降低反应物颗粒大小的改进方法是可行的。但制备这些颗粒更细小的炭粉或氧化铜粉末的过程相对比较复杂。
三、木炭还原氧化铜实验的改进
炭黑颗粒非常细小,属于纳米粒子,用于制造油墨、油漆等,也用于做橡胶的补强剂。蜡烛炭黑是最常见的一种炭黑,它是极细的黑色粉末,有非常大的表面积,且易于收集。用蜡烛炭黑代替木炭粉末与氧化铜反应能进一步增大接触面积,加快反应速率。
1.实验仪器及药品
铁架台、试管、酒精灯、灯罩、导管、弹簧夹、胶皮管、蜡烛炭黑、氧化铜粉末、澄清石灰水等。
2.实验装置
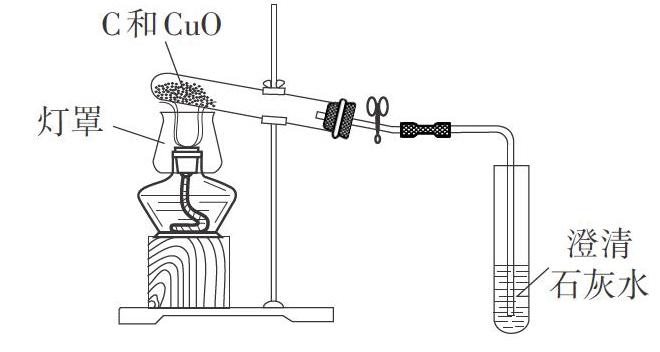
改进后的实验装置如图1所示。酒精灯上的灯罩有防止火焰摆动,提高温度的作用。导管的中部连有胶皮管,并配上弹簧夹,这是为了防止在停止实验并冷却时空气进入试管导致生成的铜再被氧气氧化。
3.实验步骤
(1)用蒸发皿的底部接触蜡烛火焰,收集蜡烛炭黑(也可以在蒸发皿中加入适量的水,降低蒸发皿的温度,能收集较多的炭黑);
(2)按木炭与氧化铜最佳质量比1:10和1:11称取两种药品共1.1g和1.2g,并在研钵内充分研磨(研磨5-10分钟);
(3)将充分研磨后的固体混合物加入试管,堆放在试管底部,按图1所示方式连接仪器,用加有灯罩的酒精灯加热药品,观察现象;
(4)等到导管口不再有气泡冒出时,用于弹簧夹夹紧胶皮管,将导管从试管中取出,熄灭酒精灯。
(5)待试管冷却后,将试管中的药品倒在白纸上观察固体粉末颜色的变化。
4.改进后的实验现象
预热后,用酒精灯的外焰加热十几秒钟就可以发现导管口冒出气泡的速率明显加快,澄清石灰水变浑浊,这是反应开始的标志,数据如表2。同时,固体混合物红热剧烈反应,并在红热的固体上方出现了少量黑烟,导管口冒出气泡的速率进一步加快,试管里的石灰水几乎要喷出试管口。固体红热后,很快导管口不再有气泡冒出,说明反应已经停止。在实验过程中,从预热到反应结束用时不到两分钟,有效缩短了反应时间。冷却后,倒出试管中的固体,发现绝大部分的黑色固体已经变成了紫红色。
5.“异常”现象分析
在炭黑和氧化铜剧烈反应的红热固体上方出现了少量黑烟。这是因为炭黑粉末的密度远小于氧化铜粉末的密度,而且十分细小,所以剧烈反应产生的大量二氧化碳气体促使了部分未反应的炭黑颗粒与氧化铜颗粒互相剥离,产生了黑烟。取少量反应后剩余的黑色粉末于试管中,加入足量的稀硫酸,加热,充分反应后可以发现溶液由五色变成淡蓝色,同时液面上少量有黑色颗粒,说明氧化铜和炭黑都有少量剩余。这也是在加入药品时,炭黑与氧化铜的质量比要大于理论比的主要原因之一。

