化学合成原料药中起始原料的相关要求
闫希路
(山东科源制药股份有限公司,山东济南 251600)
1 研究背景
药品注册全球统一化的发展推动着世界各国药品注册的统一,欧、美等国的药品管理机构发起ICH组织,ICH组织针对药品研发的指导原则进行了多次协调沟通,并初步起草了药品研发指导原则:2000年《Q7原料药GMP指南》、2012年《Q11原料药研发与生产》。其中Q11原料药研发与生产中对起始原料要求进行了初步规范。起始原料要求的规范不仅确保了原料药品研发的安全性,同时也使原料药品研发质量得到有效的控制。起始原料基本要求的规范为我国仿制药品的研发奠定了良好的基础,推动着我国国内制药企业的进一步发展。
2 我国起始原料选择在化学药品注册环节中存在的问题
在原料药品制备的环节中起始原料作为基础,对最终的药品质量有直接影响,涉及到制药企业的药品生产安全,但是我国的起始原料指导原则中并未明确指出企业在制药的过程中如何选择起始原料,而中小型的化工制药企业通过生产加工与原料药品相关的中间体,售卖给原料药品生产制造企业,存在部分原料药品生产企业为了提升药品生产利润,应用中间体进行原料药品的生产,虽然这一方式缩短了原料药品的合成路线,相应地降低了生产成本,但是原料药品的生产质量和安全性并不能够得到保证。
3 我国起始原料选择与ICH原则对比
我国起始原料选择ICH Q11要求对比见表1。

表1 ICH Q11要求与中国发挥及指导原则的对比

续表
通过表1 中的内容可以明确,我国对于起始原料方面所制定的法规要求与ICH Q11对比,在原料药品相关结构性、信息提交这两个方面较为相似,但是在起始原料的选择上ICH Q11较为笼统。起始原料ICH CTD与国内CTD的对比分析见表2。

表2 起始原料方面ICH CTD 与国内CTD的对比分析
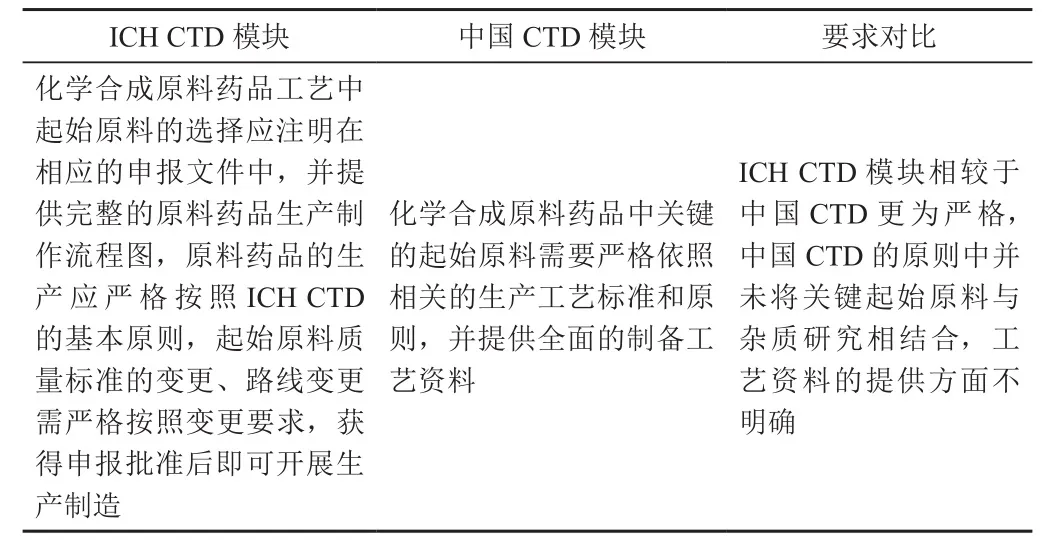
续表
4 起始原料的选择要求和分析建议
化学合成原料药品的生产工艺应根据ICH Q 11的基本原则与国内各监管法规要求进行选择,目前ICH Q11与各国的审评机构在起始原料的选择与审批方面主要侧重于:组成化学合成原料药品结构的重要片段;起始原料的化学合成工艺步骤,粗品的合成工艺步骤;合成工艺步骤中是否包含关键步骤;起始原料的确定对最终原料药品杂质谱的影响;关键起始原料属性需针对其建立相应的质量控制策略。本文通过参考世界各国在起始原料选择与审批方面所设定指导原则,考虑起始原料的选择与审批应从工艺控制、变更控制与分析控制三个方面展开。首先工艺控制中申请者需要明确起始原料的来源,是大宗物料、还是已经定制合成的中间体。其次起始原料如果由中小型的生产制造企业提供,那么企业的运营效益会随着原料药品的生产而随之不断的变更生产规模,生产规模的变更中一旦生产工艺发生转变,必须要及时的申报接受审批,保证最终原料药品质量,同时要求中小型生产制造企业所提供的起始原料必须是开发好的,做好起始原料扩产药品安全风险的控制。起始物料的选择一般涉及到起始原料的结构确认、起始原料的未定型、起始原料在研发过程中不同供应企业的多批次分析数据、起始原料工艺变更对杂质谱存在的营销、所选择的起始原料能够证实潜在的杂质。原料药品审批机构常用0.1%杂质或0.05%杂质作为限度,对原料药品中的杂质出现概率进行鉴定,如果起始原料中存在新的杂质,且在后续的原料药品生产环节中需要明确这些新杂质的去向。
5 结束语
本文所提出的起始原料的选择要求与审批要求是参考ICH Q11及各国的审批机构要求,建议我国亟需不断的完善和健全原料药品中起始原料的相关要求、指导原则。对起始原料相关要求的研究是保证人用药品安全性的关键。ICH Q11中所涉及到的起始原料选择原则需对其综合考量,并侧重于合成工艺与研究结果的科学性,起始原料的合理选择还应具备用药安全机制、杂质控制机制等,建议起始原料中不能含有不可控的成分,这样才能够从本质上确保用药安全。

