大鼠丘脑酪氨酸羟化酶调控丙泊酚诱导的镇静作用
张一佳,傅风华,曹燕卿,邵 帅,谭 博,苏瑞斌
(1.烟台大学药学院,山东 烟台 264005;2.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850)
镇静剂是一类通过抑制中枢神经系统使机体活动减少的药物。临床代表药物有芬太尼、右美托咪定、咪达唑仑和丙泊酚等[1],常用于治疗失眠及围手术期诱导麻醉。前期研究表明,镇静剂主要通过作用于中枢抑制性受体或抑制性配体门控离子通道发挥药效[2],这些受体和离子通道主要由蛋白质组成。但目前对镇静过程中发挥关键作用的蛋白质研究甚少,缺乏对介导镇静作用相关靶标分子的确证,极大地限制了新型镇静药物的研发。因此有必要对参与调控药物镇静作用的蛋白质展开研究。
近年来,以磷酸化蛋白质为研究对象的磷酸化蛋白质组学技术快速发展,已成为发现药物靶标、揭示疾病发生机制的新手段[3-4]。单个或多个特定位点快速、高效的磷酸化修饰往往是蛋白质功能的开关[5-7]。一项睡眠需求分子底物定量磷酸化蛋白质组学研究表明,长时间清醒会导致脑内相关蛋白质过度磷酸化,而睡眠则会促进脑内相关蛋白质的去磷酸化[8]。提示与睡眠过程类似的镇静过程极有可能与脑内蛋白质的磷酸化、去磷酸化水平密切相关。磷酸化蛋白质组学将为阐述镇静药物的作用机制提供新思路。
酪氨酸羟化酶(tyrosine hydroxylase,TH)是一种存在于中枢神经系统的非血红素铁酶,可催化酪氨酸的羟基化反应,从而形成L-3,4-二羟基苯丙氨酸,是儿茶酚胺神经递质生物合成中的限速步骤[9]。儿茶酚胺包括多巴胺、去甲肾上腺素和肾上腺素,其既可作为中枢和周围神经系统的递质,又可作为内分泌系统激素发挥作用。儿茶酚胺在脑内可调节谷氨酸或γ-氨基丁酸(γ-aminobutyric acid,GABA)等神经递质的作用[10]。丙泊酚是GABAA受体变构调节剂,因其起效快、代谢快和毒副作用低等药理学优点成为最受欢迎的“麻醉乳”[11-13]。在丙泊酚发挥镇静作用的同时常伴发意识丧失,其机制与丘脑参与神经环路的调控密切相关。丘脑由上部、下部、腹侧和背侧4部分组成,是位于2大脑半球之间的复合体[14],功能性脑成像研究证实,丘脑是介导药物镇静和麻醉作用的关键脑区[15-19]。
本研究通过观察丙泊酚诱导动物镇静后丘脑磷酸化蛋白质表达水平及组学变化,以期发现参与镇静作用的潜在蛋白质,进而探讨TH参与调控丙泊酚镇静作用的机制。
1 材料与方法
1.1 动物
SPF级雄性SD大鼠(体质量200~220 g)和SPF级雄性C57BL/6J小鼠(体质量18~22 g)均由北京斯贝福生物技术有限公司提供,实验动物生产许可证号:SCXK(京)2019-0010。实验动物饲养于军事医学研究院行为实验中心,12 h昼夜交替,室温25℃,湿度55%~65%,自由摄食饮水。
1.2 试剂和仪器
丙泊酚(英国AstraZeneca公司);同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术标记试剂盒(加拿大AB SCIEX公司);SDS裂解液(上海碧云天生物技术有限公司);BCA试剂盒、质谱级乙腈和质谱水(美国Thermo Scientific公司);PMSF(美国Amresco公司);三氟乙酸(上海生物工程股份有限公司);无水乙醇和异丙醇(上海GENERALREAGENT公司);胰酶(北京华利世公司);甲酸(德国CNW Technologies GmbH公司);小鼠抗人TH单克隆抗体(美国Sigma公司);兔抗人TH第19位丝氨酸磷酸化多克隆抗体(上海爱必信生物科技有限公司);兔抗人GAPDH多克隆抗体(美国CST公司);辣根过氧化物酶标记的山羊抗鼠多克隆IgG二抗和山羊抗兔多克隆IgG二抗(美国Jackson Immuno Research公司);5×上样缓冲液、电泳缓冲液、转移缓冲液和RIPA裂解液(北京博迈德基因技术有限公司);显影液(美国Millipore公司);甲基酪氨酸(metyrosine,美国Selleck公司)。
Tanon-5200显影仪(中国天能公司);T4.0 AH SLO-BLO酶标仪(美国Molecular Devices公司);TGL-16A台式冷冻离心机(上海卢湘仪离心机仪器有限公司);DYY-6C SDS-PAGE凝胶电泳仪(北京市六一仪器厂);ST-360酶标仪(上海科华实验系统有限公司);FA2004B电子天平(上海越平科学仪器有限公司)。Q Exactive HF质谱仪、Ultimate 3000液相系统、Acclaim PepMap100色谱预柱(100 μm×2 cm)、Acclaim PepMap RSLC色谱分析柱(75 μm×15 cm)(美国Thermo Fisher公司)。
1.3 丙泊酚诱导镇静模型的生物学样品制备
SD大鼠分为丙泊酚组和正常对照组,分别ip给予丙泊酚100 mg·kg-1或等体积生理盐水。诱导大鼠翻正反射消失第30分钟时处死大鼠并分离鼠脑,于冰上迅速取出丘脑置于无菌冻存管中,投入液氮中快速冻存后转入-70℃冰箱备用。
1.4 磷酸化蛋白质的提取、酶解标记和肽段富集
蛋白质提取:取1.3制备的丘脑样品,加入SDS裂解液(包含PMSF 1 mmol·L-1),冰上超声破碎,14 300×g离心10 min取上清,用BCA法测定蛋白质浓度。
酶解标记:参考超滤管酶解法[20]将蛋白质样品进行酶解,向酶解后的蛋白质溶液加入iTRAQ试剂,涡流混匀,3757×g离心5 min并重复1次,室温放置2 h后加入200 μL水反应30 min,得到标记肽段,冻干后于-80℃保存。
肽段富集:向已标记的肽段中加入磷酸化肽富集液(含2%三氟乙酸和60%乙腈的谷氨酸饱和溶液)100 μL溶解样品,涡旋混匀15 min,瞬时离心使液体沉积于管底。按照蛋白质∶TiO2=1∶4的质量比例加相应体积TiO2溶液,涡旋15 min,3757×g离心1 min,弃上清并加400 μL洗涤液1(含0.5% 三氟乙酸和50%乙腈)涡旋15 min,3757×g离心1 min弃去上清,并重复一次。向沉淀中加400 μL洗涤液2(含0.1%三氟乙酸和50%乙腈)涡旋15 min,3757×g离心1 min弃上清,并重复一次。加10%NH3·H2O 100 μL 洗脱磷酸化肽段,涡旋 15 min,6356×g离心3 min,收集上清液,再重复一次。最后合并收集的上清液,14 300×g离心5 min收集上清液,用真空浓缩仪旋干备用。
1.5 采用色谱和质谱法蛋白质定量
色谱条件:经1.4收集的样品以300 μL·min-1的流速经色谱柱分离。流动相(体积比):A相为水-甲酸(99.9∶0.1)、B相为乙腈-水-甲酸(80∶19.9∶0.1)。梯度洗脱条件:0~5 min,3%~7%B;5~125 min,7%~25%B;125~140 min,25%~35%B;140~145 min,35%~95%B;145~150 min,95%B。
质谱条件:在正离子模式下,一级质谱质量分辨率60 000,自动增益控制值4×105;质谱扫描设定为全扫描质核比范围350~1550,并对其中10个最高峰进行质谱扫描;所有质谱图谱采集使用数据依赖型的正离子模式下的高能碰撞裂解完成,碰撞能量38。质谱的分辨率15000,自动增益控制1×105,动态排除时间40 s。数据处理:实验数据采用Proteome DiscovererTM2.2软件分析,所用数据库为Uniprot大鼠数据库。控制丙泊酚组及对照组肽段鉴定的假阳性率<1%。将绝对肽段数>1且评分>0的蛋白质确定为可信蛋白质。丙泊酚组与对照组间差异磷酸化蛋白筛选标准为:变化倍数值>1.2(上调)或<0.833(下调)且具有统计学意义(P<0.05)。差异磷酸化蛋白质基因本体(gene ontology,GO)富集分析。
利用OmicsBean组学数据整合分析云平台,对差异磷酸化蛋白进行了GO富集分析和功能注释。GO功能注释包括生物过程(biological process)、细胞组成(cellular component)和分子功能(molecular function)3个层面。
1.6 Western印迹法检测大鼠丘脑TH第19位丝氨酸磷酸化水平
1.3制备的丘脑组织加入300 μL裂解液(包含磷酸酶抑制剂和蛋白酶抑制剂)后匀浆、离心、取上清并测定蛋白质浓度。蛋白质经沸水浴变性后进行SDS-PAGE电泳,并转印至PVDF膜,5%脱脂牛奶封闭1 h。加入一抗(稀释倍数为1∶1000)4℃过夜,二抗(稀释倍数为1∶5000)室温孵育1 h,进行图像采集。利用Gis Analysis软件分析蛋白质条带积分吸光度,以TH第19位丝氨酸磷酸化蛋白积分吸光度值与TH总蛋白积分吸光度值的比值反映其磷酸化水平。
1.7 TH抑制剂对丙泊酚诱导的C57BL/6J小鼠镇静作用实验
将小鼠分为5组,分别ip给予丙泊酚70,80,90,100和120 mg·kg-1(n=18~23),并分别于给予丙泊酚前30 min ip给予TH抑制剂甲基酪氨酸20 mg·kg-1,观察各组小鼠翻正反射消失的诱导时间、持续时间(未出现翻正反射消失的小鼠,持续时间记为0 min)和翻正反射消失率。
1.8 统计学分析
利用GraphPad Prism 5进行统计,计量资料均以±s表示。大鼠丙泊酚诱导差异磷酸化蛋白质筛选和小鼠翻正反射消失诱导时间采用Studentt检验。小鼠翻正反射消失持续时间采用无重复测量two-way ANOVA及Bonferroni检验;采用Log(agonist)vs.normalized response-Variable Slope模块进行量效关系分析,并计算ED50及95%置信区间。P<0.05表示差异有统计学意义。
2 结果
2.1 丙泊酚诱导镇静模型大鼠丘脑TH第19位丝氨酸磷酸化
质谱分析结果显示,丙泊酚(100 mg·kg-1)组大鼠丘脑内共筛选出92个差异磷酸化蛋白质,其中41个(45%)上调,51个(55%)下调。根据差异磷酸化蛋白质结果,GO富集分析出30个具有显著性的条目(表1~表3),这些条目主要包含25个差异磷酸化蛋白质(表4和表5)。GO生物过程分析结果显示(表1),TH 参与了前脑发育(GO:0030900)、对生物碱反应(GO:0043279)、对盐应激(GO:0009651)、酪氨酸的多巴胺生物合成(GO:0006585)、对光刺激的反应(GO:0009416)等多种生物过程(P<0.05)。GO分子功能分析结果显示(表2),TH的分子功能与TH活性密切相关(GO:0004511)(P<0.05)。GO细胞组分分析结果(表3)显示,TH分布在滑面内质网(GO:0005790)和黑素体膜(GO:0033162)。质谱结果显示(表4和表5),TH第19位丝氨酸磷酸化显著下调(P<0.01),提示该蛋白质可能参与调控丙泊酚诱导的镇静作用。

Tab.1 Gene ontology(GO)biological process analysis of differentially expressed phosphorylated proteins in SD rat thalamus induced by propofol 100 mg·kg-1

Tab.2 GO molecular function analysi of differentially expressed phosphorylated proteins in SD rat thalamus induced by propofol 100 mg·kg-1

Tab.3 GO cellular component analysis of differentially expressed phosphorylated proteins in SD rat thalamus induced by propofol 100 mg·kg-1
2.2 丙泊酚诱导大鼠丘脑TH第19位丝氨酸磷酸化变化
Western印迹法对TH第19位丝氨酸磷酸化和TH表达水平检测结果显示(图1),与正常对照组相比,丙泊酚处理组大鼠丘脑p-TH(Ser19)/TH的比值显著降低(P<0.05)。表明丙泊酚(100 mg·kg-1)诱导大鼠丘脑TH第19位丝氨酸磷酸化显著下调,与质谱结果变化趋势一致。
2.3 甲基酪氨酸对丙泊酚诱导C57BL/6J小鼠翻正反射消失行为的影响
TH抑制剂甲基酪氨酸干预丙泊酚镇静作用行为实验结果(图2,表6)表明,单用丙泊酚70~120 mg·kg-1可剂量依赖性地增加C57BL/6J小鼠翻正反射消失率,丙泊酚120 mg·kg-1致翻正反射消失率为 100%,ED50为 92.32 mg·kg-1(95%CI:90.60~94.08,R2=0.9969);甲基酪氨酸+丙泊酚组较单用丙泊酚组翻正反射消失率升高,量效曲线左移,ED50为85.38 mg·kg-1(95%CI:81.30~89.67,R2=0.9768)。甲基酪氨酸+丙泊酚100或120mg·kg-1组翻正反射消失的诱导时间较单用丙泊酚组显著缩短(P<0.01)。甲基酪氨酸+丙泊酚组较单用丙泊酚组持续时间延长(F1195=24.42,P<0.01),其中,甲基酪氨酸+丙泊酚90,100和120 mg·kg-1翻正反射消失持续时间较单用丙泊酚组显著延长(P<0.01)。提示TH抑制剂甲基酪氨酸可显著增强丙泊酚的镇静作用。

Tab.4 Up-regulation of phosphorylated proteins in thalamus in propofol-induced sedative SD rats
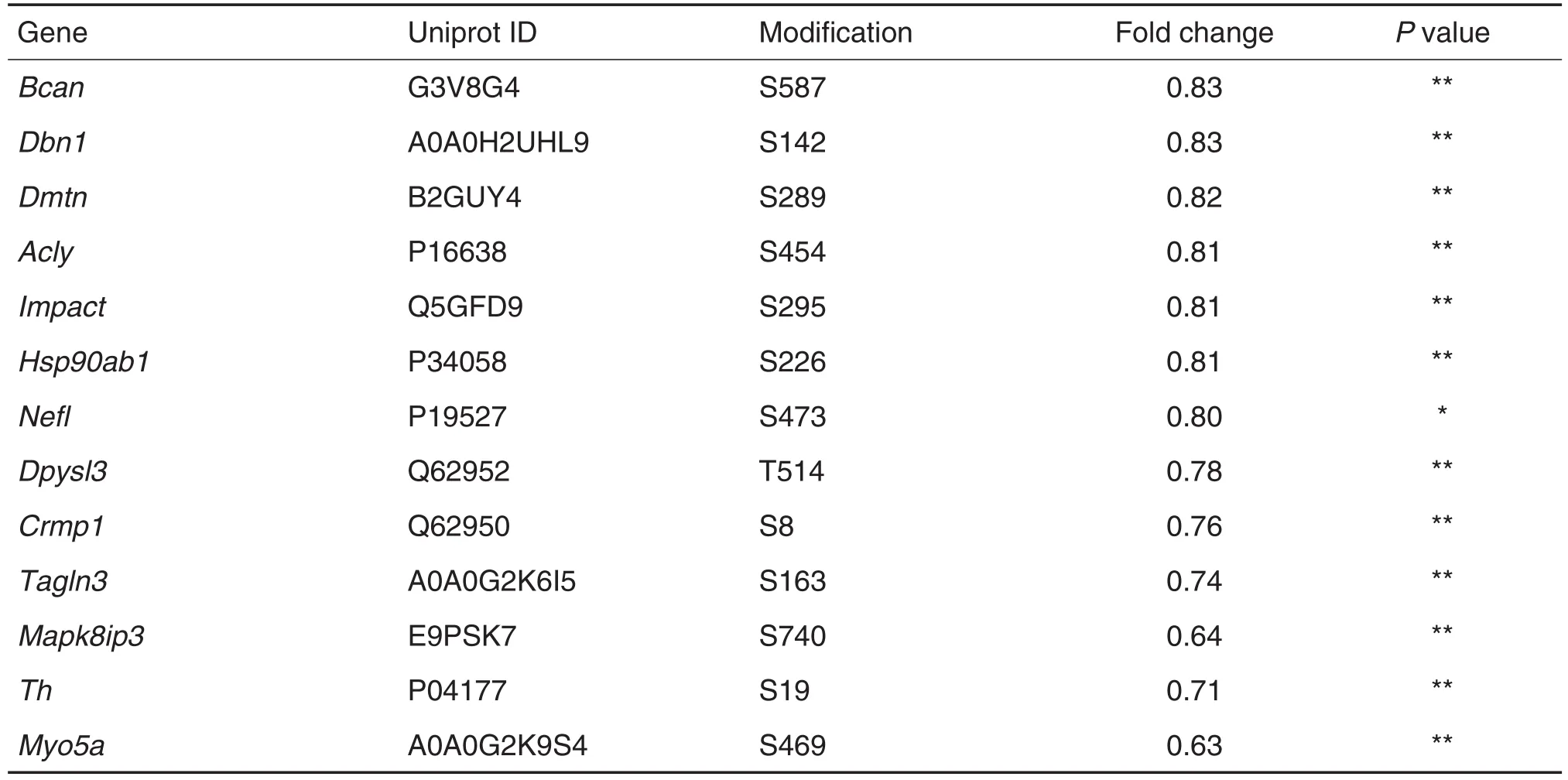
Tab.5 Down-regulation of phosphorylated proteins in thalamus of propofol-induced sedative SD rats

Fig.1 Confirmation of changes of tyrosine hydroxylase phosphorylation at Ser19[p-TH(Ser19)]in thalamus of rats by Western blotting.See Tab.1 for the rat treatment,each lane corresponding to a rat.B was the quantitative analysis result of p-TH(Ser19)/TH.±s,n=3.*P<0.05,compared with saline group.

Fig.2 Dose-response effect of metyrosine on ratio of LORR induced by propofol.C57BL/6J mice were injected with metyrosine(20 mg·kg-1,ip)30 min before propofol(70,80,90,100 and 120 mg·kg-1,ip).Non-liner regression was performed between propofol doses and LORR ratio,ED50was estimated from dose-response curve.n=18-23.
3 讨论
丙泊酚镇静作用机制复杂且可能与中枢神经系统内功能性蛋白质的功能密切相关[8]。蛋白质的磷酸化及去磷酸化修饰在蛋白质功能调节中发挥重要作用。前期研究表明,蛋白质磷酸化通过调节配体门控离子通道的功能参与胞内信号转导[21]。此外,异常的磷酸化蛋白质与许多疾病的发生密不可分,如tau蛋白的过度磷酸化是阿尔茨海默病发病机制的重要原因[22]。通过磷酸化蛋白质组学筛选并分析丙泊酚镇静作用导致的磷酸化蛋白质变化,明确其作用机制具有重要意义。
磷酸化蛋白质组学是蛋白质组学的重要分支,可从整体角度研究某一阶段细胞或组织内蛋白质的表达状态,并为研究药物作用机制提供蛋白质磷酸化修饰位点及数量。文献报道,快速起效的吸入类麻醉药物异氟烷诱导小鼠镇静模型的海马体磷酸化蛋白质组学显示,给药后30 min发现丝裂原活化蛋白激酶、糖原合成酶激酶-3β等重要蛋白质的磷酸化发生变化[23]。因此,本研究将动物镇静模型与定量磷酸化蛋白质组学相结合,在丙泊酚诱导翻正反射消失第30 min后取出样本,研究镇静大鼠丘脑内蛋白质磷酸化及去磷酸化水平变化,发现了92个磷酸化水平发生变化的蛋白质,并明确了它们的磷酸化位点。一方面提示丘脑中可能存在多种磷酸化蛋白质参与调控丙泊酚诱导的镇静作用,另一方面为进一步阐述丙泊酚或其他中枢镇静剂的药理学机制及关键靶分子提供线索。
与以往单一蛋白质功能研究相比,本研究采用的定量质谱方法高通量筛选出磷酸化蛋白质,表达信息数据规模较大。进一步结合生物信息学,对研究发现的差异磷酸化蛋白质按照生物过程、细胞组分、分子功能3个层面归类,并从中筛选出与多巴胺生物合成相关的TH开展后续研究。

Tab.6 Effect of metyrosine on the propofol-induced LORR in C57BL/6J mice
Western印迹结果表明,丙泊酚诱导的镇静模型大鼠丘脑TH第19位丝氨酸磷酸化水平显著下调,与磷酸化蛋白质组学质谱检验结果一致。行为学研究发现,丙泊酚70~120 mg·kg-1可剂量依赖性地诱导小鼠翻正反射消失率增加,与文献[24]报道一致。甲基酪氨酸可使丙泊酚镇静作用量效曲线左移,显著延长高剂量丙泊酚诱导的小鼠翻正反射消失持续时间,说明抑制TH活性可增强丙泊酚的镇静效应。
文献报道,TH第19位丝氨酸磷酸化由钙调蛋白依赖性蛋白激酶Ⅱ激活[25-26],而该激酶激活还可引起其他反应,如调控腺苷酸环化酶催化环磷酸腺苷的合成与分解[27],这些同步效应是否协同参与丙泊酚的镇静作用仍需进一步研究。
综上,本研究基于磷酸化蛋白质组学初步发现了多种可能参与丙泊酚镇静作用的磷酸化蛋白质,并结合生物信息学分析和行为药理学研究方法发现,抑制TH活性可增强丙泊酚镇静作用,为深入研究镇静类药物的作用机制提供了线索。

