聚肌胞存在下利培酮与牛血清白蛋白的相互作用及金属离子的影响
刘 里, 杨晓丽
血清白蛋白(serum albumin ,SA)是血浆中含量最丰富的载体蛋白。当药物通过血浆储存和运输到目标受体靶点时,就会发生药理作用。因此,作为药物载体的SA在药物对靶分子发挥功效过程中起到了十分重要的作用[1]。研究药物与SA之间的相互作用不仅对明确药物的转运具有重要意义,还对药物的代谢过程,药代动力学,以及药物的毒性也意义非凡。然而研究一种药物与SA相互作用的报道较多,但两种药物与SA的相互作用却鲜有报道。实际上,人们大多数情况下都是联合用药,所以多种药物与SA相互作用的相关研究就尤为重要。利培酮(risperidone,RI)是用于治疗急治疗精神分裂症、双相情感障碍和与自闭症相关的易激性有关的常用药[2]。一种人工合成的双链核糖核酸-聚肌胞(polyinosinic-polycytidylic acid,Poly I:C)是一种干扰素诱导剂,由于其具有抗病毒并调节免疫的作用,用于治疗慢性乙型肝炎、流行性出血热流行性乙型脑炎、病毒性角膜炎、带状疱疹、各种疣类和呼吸道感染等[3]。牛血清白蛋白(bovine serum albumin,BSA)与人血清白蛋白(human serum albumin,HSA)非常相似,具有76%的相同DNA序列,由于其价格便宜易得,常被用研究药物做血清白蛋白模型[1]。因此,现以BSA为血清蛋白模型研究Poly I:C对RI与BSA的相互作用的影响。
1 材料与方法
1.1 荧光光谱测定
1.1.1猝灭机制的探讨实验 荧光光谱的测定使用F-4600型荧光光谱仪(日本日立公司),并固定10.0 nm狭缝宽度,400 V的光电倍增管负高压。在10.0 ml比色管中,依次加入2.0 ml NaCl溶液(0.50 mol/L),1.0 ml Tris-HCl缓冲溶液(0.10 mol/L,pH=7.40,使用上海虹益仪器仪表有限公司pHS-3C型精密酸度计调节酸度),1.0 ml BSA溶液(1.0×10-5mol/L,上海阿拉丁生物技术有限责任公司),0.5 ml Poly I:C(0.089 6 g/L,上海江莱化学科技有限公司,含量99%)和不同体积的RI溶液(4.146 3×10-7mol/L)用超纯水定容。把配置好的溶液分别放到25.9 ℃、35.9 ℃和45.9 ℃温度下的超级恒温水浴(DHG-9035 A型,上海一恒科技有限公司)内孵育30 min后,测定光谱曲线,并得到最大激发波长(λex)和最大发射波长(λem),并测定荧光强度值即F0(无RI时体系的荧光强度)和F(不同浓度RI存在时体系的荧光强度)。绘制Stern-Volmer关系曲线[4](其方程表达式为F0/F=1+KsvCRI=1+Kqτ0CRI,式中τ0是荧光寿命,Kq是速率常数;Ksv是猝灭常数;CRI为RI浓度)。
1.1.2金属离子对体系影响的实验 在Poly I:C-RI-BSA体系中分别加入1×10-5mol/L MgSO4、CoCl2、MnCl2、CuSO4和CrCl3之后,然后在上述实验条件下,把配置好的溶液在25.9 ℃温度下反应30 min后,在λex下扫描光谱曲线并记录F0(无金属离子加入时体系在λem处的荧光值)和F值(金属离子加入时体系在λem处的荧光值)。
1.1.3同步荧光光谱的测定 按照1.1.1方法配置溶液,并在上述实验条件下,固定Δλ=15 nm和60 nm,扫描荧光光谱曲线。
1.2 紫外-可见光谱研究按照1.2.1方法配置溶液,用Cary 50型紫外-可见光谱仪(美国瓦里安技术中国有限公司)扫描其随着RI浓度增加,体系的吸收谱图。
1.3 统计学处理用SPSS 19.0统计软件进行显著性分析,采用Excel 2013 软件进行处理数据,测定3次取平均值。以P<0.05为差异有统计学意义。
2 结果
2.1 荧光发射光谱固定Poly I:C和BSA浓度不变,改变RI浓度,研究RI的存在对Poly I:C-BSA荧光发射光谱的影响,见图1。在300~450 nm范围内RI和Poly I:C本身无荧光发射,对实验结果无干扰(图1中的11曲线所示)。Poly I:C-BSA体系的λem在345 nm处(图1曲线所示),而RI的加入对其λem几乎无影响,只是荧光强度(F值)明显随着RI浓度的增加而逐渐减弱。表明在poly I:C存在下RI对BSA有显著的抑制作用。
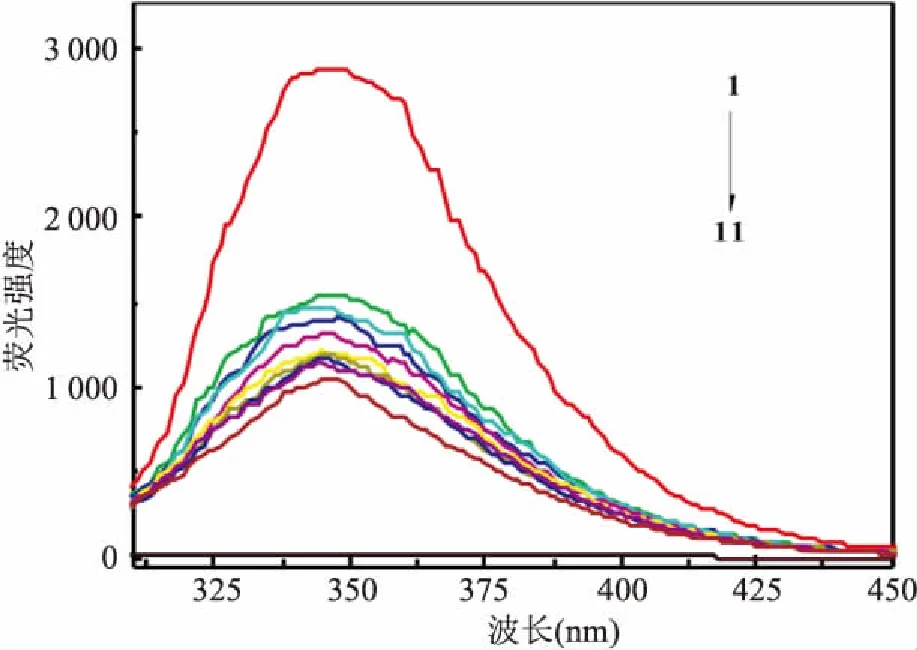
图1 在不同RI浓度下poly I:C-BSA的荧光发射光谱
1→10:CBSA =1×10-6mol/L, CRI=(0、0.332、0.415、0.622、1.037、1.202、1.368、1.576、1.783、1.990)×10-7mol/L;11: CRI=3.32×10-8mol/L, CPoly I:C=0.004 48 g/L
2.2 猝灭荧光机制探究为了探讨这两种药物对BSA的机制,选用最经典的Stern-Volmer关系曲线来研究其荧光猝灭机制。按照1.2.1方法测定试液的F0和F,以F0/F为纵坐标,CRI为横坐标见图2。三个温度的线性方程列入表1中,对比由表1中三个线性方程的斜率即Ksv值可知,温度越高,直线斜率越大,表明RI和poly I:C对BSA荧光的猝灭符合动态猝灭机制。
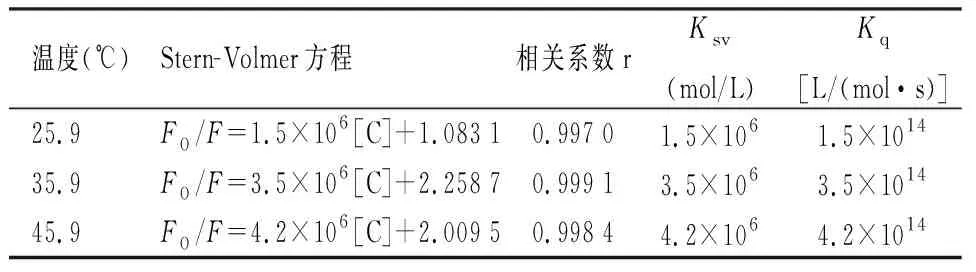
表1 poly I:C-RI-BSA和的Stern-Volmer方程
采用不受离子强度影响的紫外-可见光谱来研究poly I:C-RI-BSA荧光抑制机制,其吸收光谱图(图3)。对比图3中曲线1(poly I:C-BSA体系)和曲线2-10(固定Poly I:C和BSA的浓度,逐渐增大RI的浓度即RI-poly I:C-BSA体系)可知,伴随着RI浓度的增加,虽然poly I:C-BSA体系的吸收强度增加,但其紫外光谱曲线的峰形与峰位没有发生改变。此实验结果表明其完全没有如静态猝灭机制那样,由于有新物质的生成,而改变紫外谱线。
2.3 结合位点数及结合常数的测定应用lg[(F0-F)/F]=lgKb+nlg[C]方程计算测定在poly I:C存在条件下,药物小分子RI与BSA生物大分子的结合常数(Kb)与每一个BSA与药物结合的位点数(n)。分别在25.9 ℃、35.9 ℃和45.9 ℃温度条件下测定不断加入RI后,体系的荧光强度,然后以lg[C]为横坐标,lg(F0-F)/F为纵坐标做双对数曲线(图4所示),得到的双对数方程利于表2中。表2中Kb和n变化较大,表明Kb和n对温度很敏感,即蛋白质对药物的运输受温度的影响较大。当温度在25.9 ℃时,Kb和n达到最大值,n约等于1,可形成1个结合位点;当温度高于298.9K时,n很小,几乎不可以形成1个结合位点。总之,温度增加不利于蛋白质运载药物。而对比三个温度的Kb值,我们发现,室温下(25.9 ℃)的Kb值比分别是35.9 ℃和45.9 ℃温度下的Kb值的50倍和24倍。这也印证了高于室温时,温度越高对药物与蛋白的结合越不利。

表2 Kb和n的值

图3 poly I:C-BSA(1)和poly I:C-RI-BSA(2-5)紫外吸收光谱
1→5:CBSA=1×10-6mol/L, Cpoly I:C=0.004 48 g/L,CRI=(0、1.368、1.576、1.783、1.990)×10-7mol/L
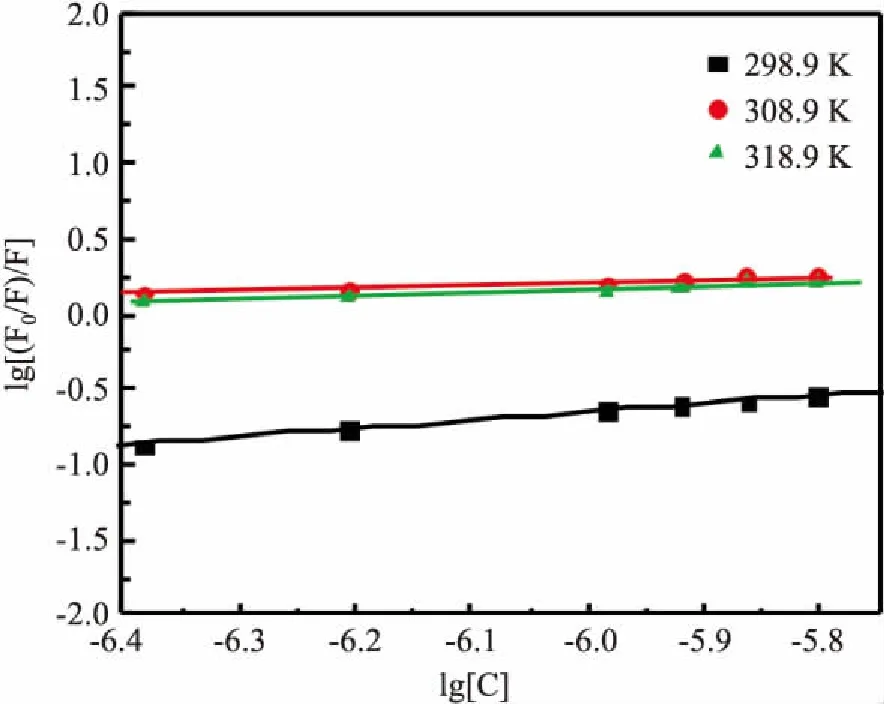
图4 双对数曲线
2.4 相互作用力BSA 与poly I:C和RI两种药物相互作用的热力学函数通过van’t Hoff方程求得。其方程表达式为:
lnKb=(-ΔH/RT)+ΔS/R
(1)
ΔG=-RTlnKb=ΔH-TΔS
(2)
公式中Kb为不同温度下的结合常数, R是摩尔气体常数,其数值为8.314 J/(mol·K),T为热力学温度,ΔG、ΔH和ΔS分别代表吉布斯自由能变、焓变和熵变。根据公式(1)和(2)计算ΔG、ΔH和ΔS结果列于表3中。ΔG<0表明聚肌胞和利培酮与BSA结合是自发反应,ΔH<0表明该结合反应属于放热反应。
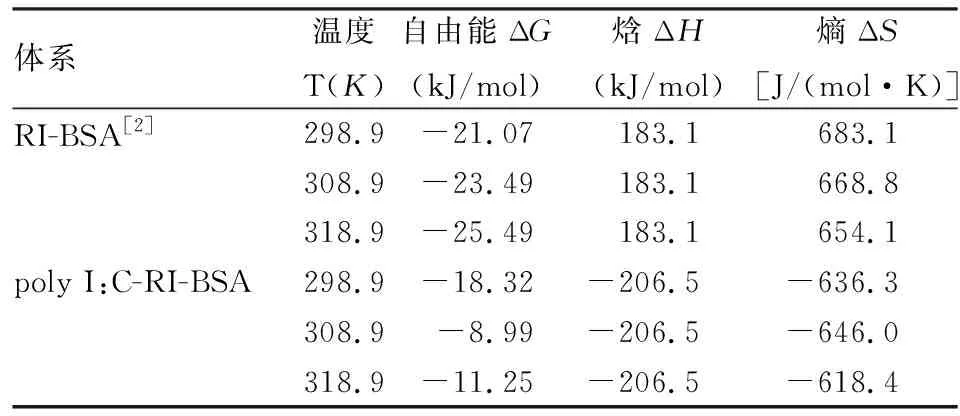
表3 热力学函数
2.5 结合部位的确定BSA分子由3个同源结构域组成即域(Ⅰ~Ⅲ),每个域相应地产生两个子域(IA、IB等)。BSA中有两个特异性与配体结合的位点,即结合位点Ⅰ(在亚结构域ⅡA)以及Ⅱ(在亚结构域ⅢA中)。药物分子作为配体与BSA结合的部位可以从相互过程中色氨酸残基和酪氨酸残基的实际参与情况推断出。首先分别在λex=280 nm/295 nm 激发时扫描体系的发射光谱,然后由λem处的荧光值绘制荧光猝灭曲线(图5所示)。
2.6 药物协同性通过Hill曲线(其曲线方程为lgH/(1-H)=lgK+nHlg[C],式中H为结合饱和分数,K为结合常数,nH为Hill系数,[C]为药物的浓度)来推断聚肌胞和利培酮的药物协同性。首先利用F和F0的值计算出B=(F0-F)/F0,以1/[C]为横坐标,1/B为纵坐标做线性图,1/Bm为直线的截距,从而能算成Bm值。然后在计算出H/(1-H)值,其值等于B/(Bm-B),最后求出Hill方程,结果见表4。由表4中实验结果显示,温度改变时,nH值变动不大,表明温度对药物协同性的影响不明显。温度的提升会增加nH值,这与上述描述的动态猝灭机制相吻合。
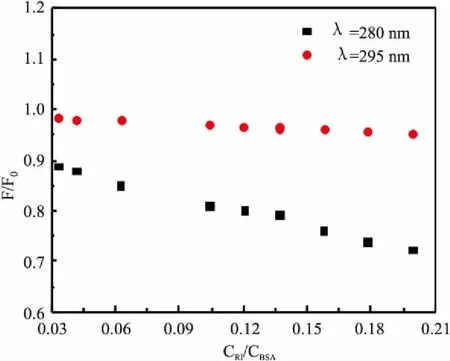
图5 F/F0与CRI/CBSA关系曲线
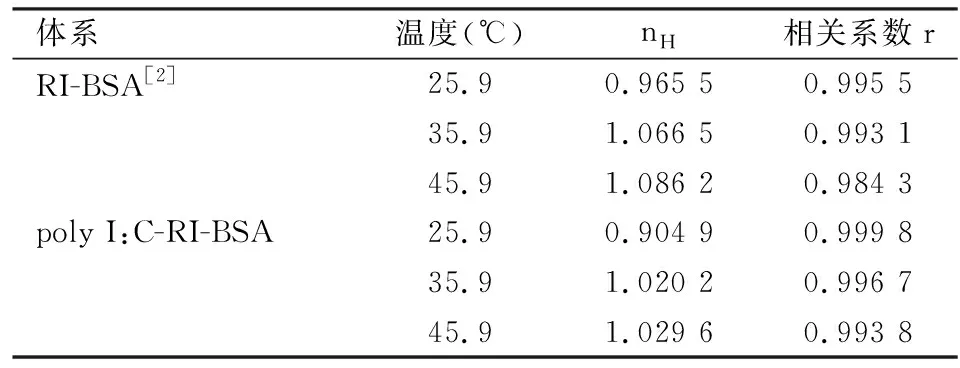
表4 不同温度下的nH值
2.7 聚肌胞和利培酮对血清白蛋白构象的影响当波长间隔(Δλ)固定在15 nm或60 nm处时,同步荧光能分别给出酪氨酸残基(Tyr)和色氨酸残基(Trp)的特征信息。聚肌胞和利培酮对BSA的同步荧光光谱的影响如由图6所示。当增大药物浓度时,F值逐渐降低,酪氨酸残基的λem向短波移动约2 nm,色氨酸残基的λem向长波移动约4 nm,表明聚肌胞和利培酮药物的加入几乎不改变了Tyr和Trp所处的微环境。
2.8 金属离子的影响常见离子广泛分布于人体或动物血液中。因此,应该考虑有很多血液系统和生物体中的对结合蛋白质有特定能力的微量金属离子。因此,一些常见金属离子(如Mg2+、Co2+、Mn2+、Cu2+和Cr3+)作为研究对象,来探究其对药物与BSA结合的影响(表5)。由表5可知,金属离子不同,Kb′和n差别较大,由于原子结构决定性质,才会使结合参数值改变很大。Cu2+、Cr3+和Mn2+的存在,增大了Kb和n值,这表明金属离子促进了药物与蛋白质的结合作用。其中Cr3+的存在最大程度地影响药物与蛋白的相互作用。然而Co2+和Mg2+的存在减小了原本的Kb和n值,说明Co2+和Mg2+对聚肌胞和利培酮与BSA结合产生了竞争作用。它们能阻碍了药物与BSA的结合作用,缩短了聚肌胞和利培酮在血液中的停留时间,从而使药效得到增强。
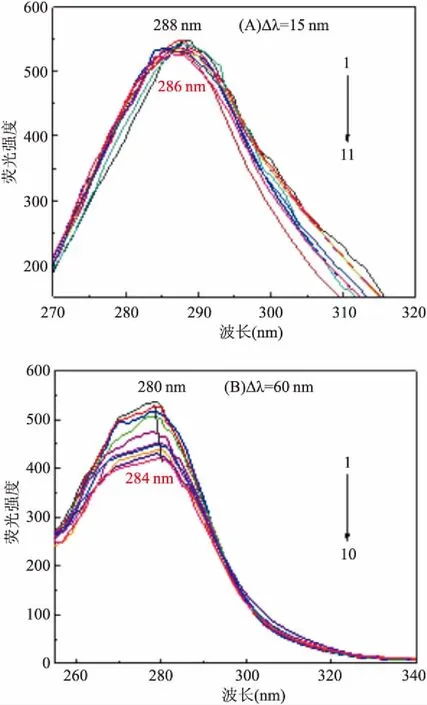
图6 同步荧光光谱图
1→10:CBSA=1×10-6mol/L, CPoly I:C=0.004 48 g/L,CRI=(0、0.332、0.415、0.622、1.037、1.202、1.368、1.576、1.783、1.990)×10-7mol/L
3 讨论
本研究小组已经报道RI和poly I:C都能猝灭BSA发生的荧光[2-3],而上述结果进一步表明RI和poly I:C能同时猝灭BSA的荧光,RI能抑制poly I:C-BSA体系的荧光强度,为探讨poly I:C存在下RI对BSA抑制机制提供了研究前提条件。表1中三个Kq都大于最大动态猝灭速率常数2.0×1010L/(mol·s)值[4],上述实验结果似乎有悖于动态猝灭机制的结合。有文献[4]报道离子强度会增大Kq值,为了模拟人体的生理条件,我们体系的NaCl浓度较高(0.1 mol/L),故导致其Kq值超过了其极值。这就需通过其它方法进一步确定其猝灭机制。紫外光谱这充分印证了药物只改变BSA的激发态,不影响紫外吸收光谱发生动态猝灭的结果[4]。综上所述,poly I:C-RI-BSA体系的作用机制为动态猝灭,与无poly I:C存在条件下,RI对BSA的猝灭机制[2]相同。
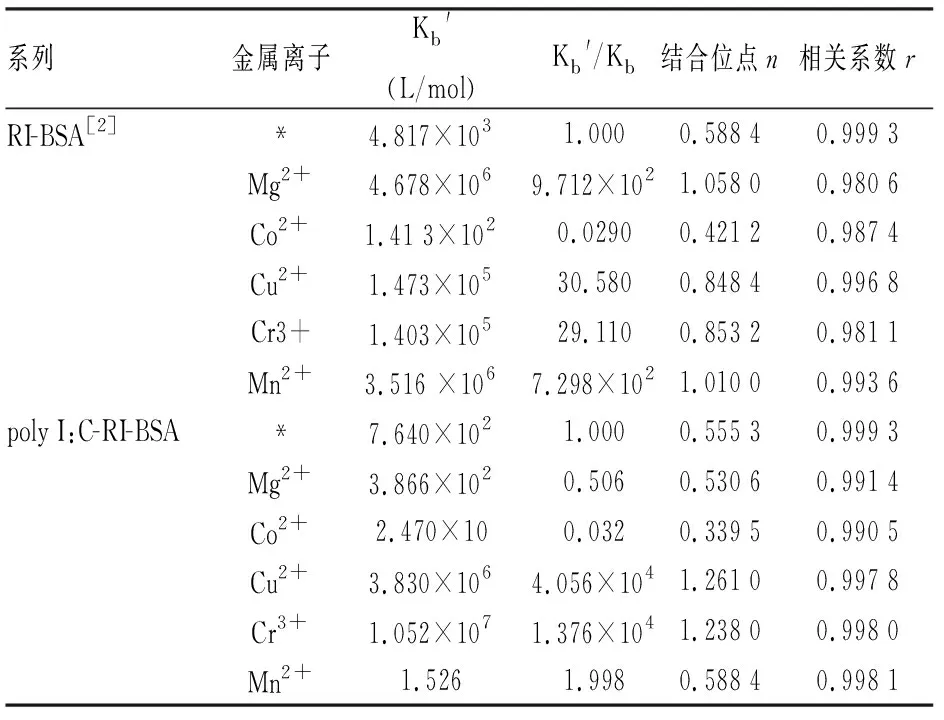
表5 金属离子对药物与BSA结合常数的影响
Kb和Kb′分别表示在金属离子不存在和存在时聚肌胞和利培酮与BSA的结合常数;“*”代表无任何金属离子情况
为了对比单一药物与两种药物同时与蛋白结合的作用,我们同时对比了相应的n和Kb值。当只有一种药物RI与BSA相作用时,n随着温度的升高而增大,跟室温下poly I:C和RI同时与BSA相互作用时的n值相差不大。但高于室温后,两种药物与BSA结合的n值就明显较小,反而不能形成结合位点。这表明poly I:C加入使RI-BSA体系结合位点减少,不利于药物在血液中的运输。对比表3中Kb(RI-BSA)[2]和Kb(poly I:C-RI-BSA)值,我们发现在室温时Kb(RI-BSA) 值为Kb(poly I:C-RI-BSA) 的2.8倍;当温度升高10 ℃后,Kb(RI-BSA)值是Kb(poly I:C-RI-BSA) 的2 800倍;当温度升高20 ℃时Kb(RI-BSA) 值是Kb(poly I:C-RI-BSA)的2 100倍。以上实验数据表明聚肌胞的加入使体系的稳定性减弱,推测由于Poly I:C与RI发生了相互作用,导致Kb减小,从而缩短了药物停留时间,增大血液中的药物浓度,对药效产生有益影响。
根据ΔH和ΔS值的正负情况,利用Ross et al[5]总结出的药物与大分子相互作用的模型可以推断出其分子间作用力类型。ΔH<0且ΔS<0表明在聚肌胞存在下,利培酮与BSA直接的作用力以氢键和范德华力为主。这与只有利培酮存在时,与BSA的作用力(疏水作用力)[2]类型不同,推测其原因为在聚肌胞与利培酮同时存在时,改变其与BSA的分子间的力的类型。由图 5可知,两种激发波长下,Poly I:C -RI-BSA体系的猝灭曲线是独立的两条曲线没有相交和重叠的区域,而且F/F0值在λex=280nm时比λex=295nm激发时的高,这表明在色氨酸和酪氨酸残基都参与利培酮和聚肌胞与BSA的相互作用[6-8],ⅡA是结合部位,这与只有利培酮存在下和BSA结合的部位相同[2]。三个温度下的nH均接近1,说明聚肌胞和利培酮与BSA结合过程中,聚肌胞和利培酮与BSA分子之间几乎没有协同作用。由表4可知:nH(RI-BSA)[2] 聚肌胞和利培酮使BSA伸展,减少了氨基酸残基间的能量传递,从而猝灭BSA荧光[9],色氨酸的猝灭程度大于酪氨酸,表明聚肌胞和利培酮与BSA的结合位点更加接近于色氨酸残基,这与利培酮对BSA构象影响相同。Cu2+、Co2+、Mg2+和Mn2+存在时,Kb′(poly I:C-RI-BSA) 综上所述,聚肌胞和利培酮同时存在时与BSA之间的猝灭机制为动态猝灭机制。氢键和范德华力起了主要作用,聚肌胞和利培酮分子之间几乎没有协同性,三元体系结合位置位于BSA的亚螺旋域ⅡA中。poly I:C-RI对BSA的构象产生很小的影响。此外,在常见金属的存在时会影响聚肌胞和利培酮与BSA的结合。Poly I:C的加入对RI药效的增强起到了有益作用。这些研究对今后联合用药的临床指导提供重要参考价值。

