miR-106a-5p靶向ERK2逆转胃癌细胞MGC-803对顺铂化疗的耐药性
刘 耿,李永坤,刘洪锋
胃癌是世界上最常见的癌症之一,具有较高的发病率和死亡率,给社会造成巨大经济负担。而诱发胃癌的因素众多,包括饮食、遗传、幽门螺杆菌感染等,与年龄和性别也存在相关性,且由于前期隐匿性较强导致延误治疗[1]。目前,顺铂化疗作为晚期胃癌的一线治疗方案,在对患者的治疗中体现出不同的治疗效果,而这可能是由于癌组织中基因表达异常导致化疗药物耐药性产生所造成的。有研究[2]显示miRNA的异常表达可能是降低化疗敏感性的重要原因。近年来,对miRNA的深入研究[3]显示miRNA在肿瘤的发生发展中扮演着重要角色,可作为恶性肿瘤诊断和预后标志物。miR-106a-5p作为miR-17家族的一员,被报道调控多种肿瘤和癌症发生发展,如:肾细胞癌[4]、骨肉瘤[5]、星形细胞瘤[6]等。已有相关研究显示,miR-106a-5p前体miR-106a可以逆转人脑胶质瘤细胞对顺铂和吉非替尼的耐药性[7]。而细胞外调节蛋白激酶(Extracellular regulated protein kinases, ERK),包括ERK1和ERK2,是调控细胞增殖分化、凋亡和癌变的关键因子。现通过研究miR-106a-5p对胃癌细胞中ERK2的表达以及对临床胃癌顺铂化疗的敏感性的影响,为临床上癌症的治疗提供依据和新思路。
1 材料与方法
1.1 材料RPMI 1640培养基、胎牛血清购自美国Hyclone公司;人胃癌细胞系 MGC-803购自上海吉凯基因化学技术有限公司;顺铂(DDP)购自美国Hospira公司;TRIzol Reagent、TaqMan miRNA反转录试剂盒、TaqMan miRNA定量PCR试剂盒购自美国Thermo Fisher公司;反转录试剂盒、PCR试剂盒购自日本TaKaRa公司;Lipofectamine® 2000试剂购自美国Invitrogen公司;EDU细胞增殖检测试剂盒、hochest33342染料购自北京索莱宝公司;E-钙黏蛋白(E-Cadherin,E-Cad)、N-钙黏蛋白(N-Cadherin,N-Cad)、GAPDH抗体均购自美国CST公司。
1.2 细胞培养及耐药株细胞的建立胃癌细胞MGC-803培养于含10% FBS的RPMI 1640培养基,放置于5% CO2、37 ℃的培养箱内,传代3次后用于后续试验。在胃癌细胞MGC-803生长到对数期时从低浓度DDP(0.5 mg/L)开始诱导细胞,每2 d更换培养液,去除死亡细胞后待细胞状态稳定且再次达到对数生长期继续传代细胞,且增加25%的药物浓度。持续诱导6个月后,以细胞能够稳定的存活于含高浓度(5 mg/L)的DDP培养液中且可以连续传代培养,无细胞的明显死亡后说明顺铂耐药细胞株MGC-803/DDP建立成功。耐药细胞株MGC-803/DDP的培养方式与胃癌细胞MGC-803相同。
1.3 RT-PCR检测将两种细胞均以1×105个/孔培养于6孔板,待细胞贴壁,用PBS清洗细胞并提取总RNA,通过超微量核算蛋白测定仪测定浓度。用TaqMan miRNA反转录试剂盒或Takara反转录试剂盒合成cDNA。引物序列如下:miR-106a-5p正向:5′-GATGCTCAAAAAGTGCTTA CAGTGCA-3′;miR-106a-5p反向:5′-TATGGTTGTTCTGCTCTCTGTCTC-3′;ERK2正向:5′-AGGCTGTTCCCAAATGCT-3′;ERK2反向:5′-CGTCACTCGGGTCGTAAT-3′。miR-106a-5p PCR 扩增条件:预变性 95 ℃、10 s,变性95 ℃、10 s,退火60 ℃、20 s,40个循环。ERK2扩增条件:预变性94 ℃、10 s,变性45 s,退火59 ℃、45 s,35个循环,结果采用2-ΔΔCt法进行计算。
1.4 细胞转染将MGC-803/DDP细胞以1×105个/孔的密度培养于6孔板,待其生长密度达到50%时才可用于转染。操作步骤按照转染试剂盒执行即可,转染8 h后将培养液更换为含10% FBS的RPMI 1640培养基进行培养,48 h后用于后续试验。
1.5 荧光素酶报告基因检测应用生物信息学软件PicTar、Targetscan数据库对miR-106a-5p可能的靶基因进行预测。构建ERK2野生型(WT)和突变型(MUT)pGL3-荧光素酶报告载体。将耐药细胞株MGC-803/DDP细胞分为WT组、MUT组、WT+miR-106a-5p mimics组和MUT+miR-106a-5p mimics组,培养于24孔板,每组3个复孔,按分组情况分别进行转染,48 h后通过荧光素酶报告基因检测系统检测荧光素酶活性。
1.6 MTT检测细胞活性将ERK2构建到pcDNA3.1质粒,转染空载质粒和pc-ERK2至耐药细胞株MGC-803/DDP中,48 h后通过RT-PCR检测ERK2表达情况,确认过表达成功。分别转染miR-106a-5p mimic和pc-ERK2至耐药细胞株MGC-803/DDP,并分为Control(对照)组、mimic NC(阴性对照)组、miR-106a-5p mimic (miR-106a-5p高表达) 组、ERK2(ERK2高表达)组和mimic+ERK2(共转染)组。将转染后细胞以5×103个/孔的密度培养于96孔板,各组6个复孔。加入20 μmol/L 的DDP 5 μl处理细胞24 h,每孔加入10 μl MTT溶液,继续孵育4 h。各孔加入100 μl Formanzan溶解液,孵育至紫色结晶会全部溶解。在570 nm测定吸光度。
1.7 EdU染色转染后各组细胞中加入20 μmol/L 的DDP 5 μl处理24 h,后续步骤按照EDU细胞增殖检测试剂盒操作说明进行。每孔加入50 μmol/L EdU 100 μl至培养基孵育2 h,PBS清洗细胞,每孔加入4%多聚甲醛固定30 min,弃去固定液;每孔加入甘氨酸中和固定液,PBS清洗;每孔加入100 μl渗透剂后孵育10 min;PBS清洗;每孔加入100 μl的1×Apollo染色液,孵育30 min,弃去染色反应液;加入100 μl 0.5% Triton X-100清洗2~3次;每孔加入100 μl甲醇清洗后再PBS清洗。每孔加入100 μl 1× Hoechst 33342反应液,孵育30 min后,PBS清洗;图像获取及分析。
1.8 Hochest33342染色检测细胞凋亡将MGC-803/DDP细胞培养于有细胞爬片的6孔板,分组同上。分别将miR-106a mimics和pc-ERK2按分组转染至MGC-803/DDP细胞,48 h后换液,除对照组外均加入DDP处理24 h。各孔弃去培养液,PBS清洗细胞3次,加入hochest33342染液,于保温箱中孵育30 min后弃去染液,PBS清洗3次,滴加抗荧光淬灭封片液于载玻片上,盖上贴有细胞的盖玻片。激发波长350 nm左右,发射波长460 nm左右,荧光显微镜下检测拍照。
1.9 Transwell检测细胞侵袭将各转染组胃癌细胞以1×105/ml密度,接种200 μl于铺有Matrigel基质胶的Transwell小室上室,下室加入600 μl含20% FBS的RPMI 1640培养基。37 ℃、5% CO2条件下培养24 h后,用棉签擦去基质胶和上室未穿膜细胞,甲醇固定10 min,Giemsa染色30 min,镜下随机5个视野(1×100) 观察结果并拍照、计数,取均值。
1.10 Western blot检测将各转染组胃癌细胞以1×105个/孔培养于6孔板,细胞贴壁后,DDP 处理24 h,用PBS清洗细胞,用含有PMSF的RIPA裂解液裂解细胞,提取总蛋白。BCA试剂盒检测蛋白浓度后,经10% SDS-PAGE凝胶电泳进行电泳,分别孵育相应的一抗、二抗,加入BCL,进行曝光。
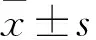
2 结果
2.1 miR-106a-5p和ERK2在两种细胞系中表达量的差异通过RT-PCR检测miR-106a-5p和ERK2在胃癌细胞株MGC-803和顺铂耐药细胞株MGC-803/DDP中的表达差异。如图1所示,以胃癌细胞株MGC-803为对照组,miR-106a-5p在顺铂耐药细胞株中的表达降低(t=10.31,P<0.05),而ERK2 mRNA的表达上升(t=8.95,P<0.05)。由此可见,miR-106a-5p、ERK2在胃癌细胞株MGC-803和顺铂耐药细胞株中的表达量呈相反趋势。
A:两种细胞系中miR-106a-5p表达量;B:两种细胞系中ERK1表达量;与MGC803比较:*P<0.05
2.2 miR-106a-5p靶向下调ERK2基因将miR-106a-5p转染到MGC-803/DDP细胞,通过RT-PCR检测miR-106a-5p的表达量。与对照组相比,miR-106a-5p mimic转染组中miR-106a-5p的表达量升高(t=21.14,P<0.05),见图2A。生物学预测miR-106a-5p与ERK2的靶向关系。ERK2基因序列上存在miR-106a-5p的结合位点,见图2B。通过荧光素酶报告基因试验进一步证实miR-106a-5p与ERK2的靶向关系。miR-106a-5p靶向下调ERK2的表达(t=5.38,P<0.05),见图2C。由此可见,miR-106a-5p靶向作用于ERK2基因,且下调ERK2的表达量。
2.3 miR-106a-5p过表达逆转ERK2诱导的胃癌细胞活性增强与增殖将pc-ERK2转染到MGC-803/DDP细胞,通过RT-PCR确认ERK2的过表达。ERK2组中ERK2的表达量高于对照组(t=18.22,P<0.05),见图3A。将miR-106a-5p mimic和pc-ERK2分别转染到MGC-803/DDP细胞,经20 μmol/L DDP处理后通过MTT法检测细胞活力。与对照组相比,miR-106a-5p mimic组的细胞活力下降(t=25.37,P<0.05),而ERK2组细胞活力上升(t=9.32,P<0.05),见图3B。与ERK2组相比,mimci+ERK2组的活力下降(t=4.82,P<0.05)。通过EDU染色检测各组细胞增殖情况。与对照组(42±14)相比,miR-106a-5p mimic组(12±8)的细胞增殖数量下降(t=7.86,P<0.05),而ERK2组(75±17)细胞增殖数量上升(t=13.66,P<0.05)。与ERK2组相比,mimic+ERK2组(51±12)细胞增殖数量下降(t=4.26,P<0.05),见图3C。由此可见,ERK2的高表达可以提高MGC-803/DDP细胞在顺铂作用下的细胞活性并诱导其增殖,而miR-106a-5p的高表达则可以逆转ERK2高表达带来的影响。
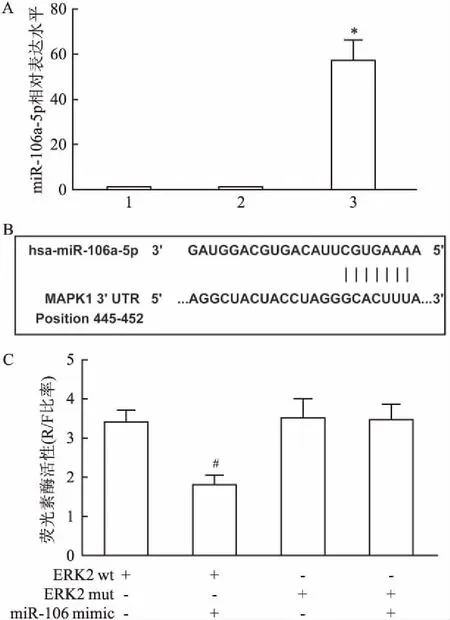
图2 miR-106a-5p与ERK2基因的靶向关系
A:miR-106a-5p转染效果;1:Control组;2:mimic NC组;3:miR-106a-5p mimic组;B:miR-106a-5p与ERK2基因靶向序列预测;C:荧光素酶报告实验检测靶向关系;与Control组比较:*P<0.05;与ERK2 wt组比较:#P<0.05
2.4 miR-106a-5p过表达逆转ERK2诱导的MGC-803/DDP细胞凋亡减少通过hochest33342染色检测各组MGC-803/DDP细胞凋亡情况。与对照组(3.9±2.0)相比,miR-106a-5p mimic组(42.4±6.8)细胞凋亡数量升高(t=17.02,P<0.05),而ERK2组(2.0±1.7)细胞凋亡数量减少(t=15.85,P<0.05)。见图4。与ERK2组相比,mimic+ERK2组(10.2±4.2)中细胞凋亡数量上升(t=8.80,P<0.05)。由此可见,miR-106a-5p过表达可逆转ERK2过表达诱导的MGC-803/DDP细胞凋亡水平降低。
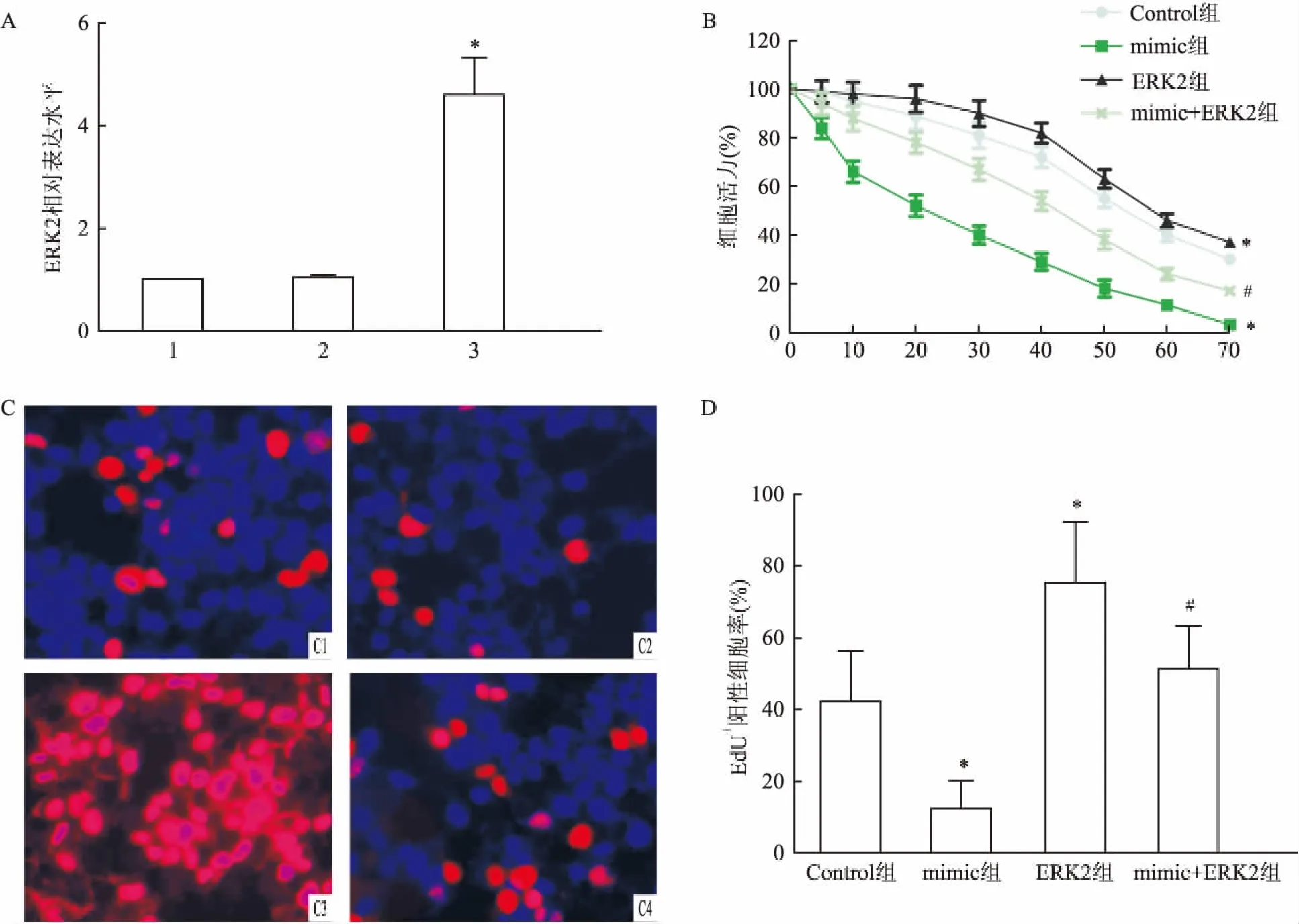
图3 MTT法和EDU染色法检测胃癌细胞MGC-803/DDP的活力与增殖情况
A:pc-ERK2转染效率;1:Control组;2:Vector组;3:ERK2组;B:MTT检测不同浓度DDP处理下MGC-803/DDP细胞活力;C:EdU检测MGC-803/DDP细胞增殖 ×400 ;1:Control组;2:mimic组;3:ERK2组;4:mimic+ERK2组;D:EdU+阳性细胞率;与Control组比较:*P<0.05;与ERK2组比较:#P<0.05
图4 Hochest33342染色法检测MGC-803/DDP细胞的凋亡情况
A:Hochest33342检测细胞凋亡 ×400;1:Control组;2:mimic组:3:ERK2组;4:mimic+ERK2组;B:MGC-803/DDP细胞凋亡百分率;与Control组比较:*P<0.05;与ERK2组比较:#P<0.05
2.5 miR-106a-5p过表达逆转ERK2诱导的MGC-803/DDP细胞侵袭力增强通过Transwell检测各组MGC-803/DDP细胞侵袭力的改变。如图5所示,与对照组(63±19)相比,miR-106a-5p mimic组(10±7)中细胞侵袭数量下降(t=9.09,P<0.05),而ERK2组(159±39)中的细胞侵袭数量上升(t=15.49,P<0.05)。与ERK2转染组相比,mimci+ERK2组(54±16)细胞侵袭数量下降(t=11.24,P<0.05)。由此可见,miR-106a-5p过表达逆转了ERK2诱导的MGC-803/DDP细胞侵袭数量增加。

图5 Transwell检测MGC-803/DDP细胞的侵袭力
A:Transwell检测细胞侵袭 ×400;1:Control组;2:mimic组;3:ERK2组;4:mimic+ERK2组;B:MGC-803/DDP细胞侵袭数量;与Control组比较:*P<0.05;与ERK2组比较:#P<0.05
2.6 miR-106a-5p过表达逆转ERK2对EMT标志性蛋白表达量的影响通过Western blot检测各组细胞中E-cad、N-cad蛋白的表达情况。如图6A所示,与对照组相比,miR-106a-5p mimic组中E-cad表达量上升(t=9.45,P<0.05),N-cad的表达量下降(t=13.24,P<0.05);而ERK2组中E-cad表达量较对照组下降(t=24.88,P<0.05),N-cad表达量上升(t=30.22,P<0.05)。与ERK2组相比,mimci+ERK2组中E-cad表达量上升(t=18.42,P<0.05),而N-cad表达量下降(t=15.43,P<0.05)。由此可见,miR-106a-5p过表达可逆转ERK2过表达对上皮细胞-间充质转化中标志性蛋白表达量的影响。

图6 Western blot检测MGC-803/DDP细胞中E-cad、N-cad的蛋白表达量
A:Western blot检测细胞E-cad蛋白表达量;B:Western blot检测细胞N-cad蛋白表达量;1:Control组;2:mimic组;3:ERK2组;4:mimic+ERK2组;与Control组比较:*P<0.05;与ERK2组比较:#P<0.05
3 讨论
胃癌是一种常见的消化道恶性肿瘤疾病,目前临床上对于胃癌的治疗方案主要是采用铂类化疗药物进行治疗[8]。但是随着化疗次数的增多,肿瘤细胞会对铂类化疗药物(包括顺铂)产生耐药性,而肿瘤细胞对铂类药物产生耐药性的机制较为复杂,如靶点异常表达、药物作用通路抑制、癌细胞对药物的外排增强、DNA修复能力增强等。因此,逆转顺铂的耐药性将成为提高癌症化疗效果的关键。
ERK包括ERK1和ERK2,是将信号从表面受体传导至细胞核的关键,磷酸化激活的ERK1/2由胞质转位到核内,进而参与细胞增殖与分化、细胞形态维持、细胞骨架的构建、细胞凋亡和细胞的癌变等多种生物学反应,其中ERK2即MAPK1。miR-106a-5p是miR-106a 的剪切成熟体,参与着对基因表达的调控。近年来大量研究证实ERK在癌症的发生发展中扮演着重要的角色。李登举 等[9]发现,ERK信号转导途径的抑制导致磷酸化ERK1和ERK 2蛋白质低表达,并连续下调端粒酶活性,最终提高卵巢癌细胞COC1/DDP对DDP的敏感性。除此之外,Ye et al[10]发现,鼻咽癌患者血清或NPC细胞中miR-106a-5p过表达,且参与下调MARK1信号传导途径活性以改变细胞增殖和分化。因此推测,miR-106a-5p可以下调ERK2的表达,进而逆转MGC-803/DDP细胞对顺铂的耐药性。
为了证实我们推测,我们通过RT-PCR检测了miR-106a-5p和ERK2在胃癌细胞株MGC-803和顺铂耐药细胞株MGC-803/DDP中的表达情况。结果显示,106a-5p和ERK2在胃癌细胞株MGC-803和顺铂耐药细胞株MGC-803/DDP中的表达量均在负相关性。为了进一步确定miR-106a-5p和ERK2存在靶向关系,本研究通过软件分析预测了miR-106a-5p和ERK2存在的作用关系,并通过荧光素酶报告基因检测确定了miR-106a-5p和ERK2存在靶向关系。
为了探明miR-106a-5p和ERK2在胃癌细胞耐药性中的相互关系,本研究进一步将miR-106a-5p mimic和pc-ERK2分别转染至顺铂耐药细胞株MGC-803/DDP中,并将DDP作用于实验组中各组细胞,检测各组细胞活性、增殖能力、凋亡水平以及侵袭能力的改变。研究结果显示,miR-106a-5p可以靶向ERK2,降低DDP作用下顺铂耐药细胞株MGC-803/DDP细胞活性,并诱导其凋亡水平的升高,同时降低其增殖能力和侵袭能力。研究结果表明,miR-106a-5p可以靶向ERK2,逆转顺铂耐药细胞株MGC-803/DDP细胞对DDP的耐药性。
在多种癌症的发生发展中,上皮细胞失去细胞极性和与基底膜连接的粘附作用进而转化为具有间质表型的细胞的过程称为上皮细胞-间充质转化(EMT)。大量研究显示,EMT的过度活化在上皮细胞来源的恶性肿瘤细胞中起着增强癌细胞的迁移、侵袭能力的关键作用[11]。细胞黏附因子E-cad表达下调, 而N-cad表达上调是EMT过程中的标志性特征[12-14]。有相关研究显示,ERK的磷酸化和EMT的激活有助于增强卵巢癌细胞SKOV-3对DDP的抗性,而ERK的抑制剂PDK8059可以逆转其耐药性的产生[15]。本研究结果显示,miR-106a-5p可以抑制ERK2诱导的E-cad低表达及N-cad的高表达,这表明,miR-106a-5p可以靶向ERK2而抑制EMT过程,降低胃癌细胞的迁移、侵袭能力。
综上所述,miR-106a-5p可以靶向抑制ERK2基因的表达,降低DDP作用下顺铂耐药细胞株MGC-803/DDP细胞活性,并诱导其凋亡水平的升高,同时降低其增殖能力和侵袭能力,逆转EMT过程,最终实现逆转顺铂耐药细胞株MGC-803/DDP细胞对DDP的耐药性。目前,关于 miRNA 在胃癌耐药中的研究多见于细胞株,而其对胃癌患者化疗耐药的影响研究仍较少,因此后期我们将通过建立胃癌模型大鼠,观察miR-106a-5p对大鼠顺铂化疗效果的影响。

