低剂量伽玛刀照射对癫痫大鼠皮层及海马神经细胞内游离Ca2+水平的影响
尹 昱,王晓晗,王贺波,孙增鑫,董长征,李文玲,赵文清,赵振彪
目前关于伽玛刀照射作为开颅手术治疗癫痫的替代方案的研究日益增多[1-2]。临床研究[3-4]显示低剂量伽玛刀可控制难治性癫痫患者的痫性发作,并可保护该类患者的认知功能,但作用机制仍不十分明确。目前认为钙离子与学习、记忆等认知功能密切相关,而研究[5]显示钙稳态失调还可诱发痫性发作,当细胞内的钙浓度超过正常水平,但剂量未达到产生兴奋毒性的程度时,钙浓度异常升高可能引起神经细胞异常放电进而导致癫痫。低剂量伽玛刀是否通过影响神经细胞内Ca2+浓度水平而发挥抗癫痫和保护认知的作用,有待进一步深入探讨。现利用激光共聚焦显微镜检测戊四氮(pentylenetetrazole,PTZ)致痫大鼠额叶及海马神经细胞内游离Ca2+水平,并观察低剂量伽玛刀对其的影响,以期为伽玛刀治疗癫痫提供实验依据。
1 材料与方法
1.1 动物分组与癫痫模型制备选取清洁级健康雄性Wistar大鼠32只,由河北医科大学实验动物中心提供,起始体质量180~220 g,均在同一实验室按清洁级大鼠要求饲养,22~25℃环境温度,12 h光亮/黑暗条件,自由进食水。根据大鼠是否应用PTZ致痫及接受低剂量伽玛刀照射,随机均分为4组:正常对照组、伽玛刀对照组、PTZ致痫组、PTZ致痫+伽玛刀组。采用腹腔连续注射PTZ溶液(Sigma 公司,美国)(35 mg/kg)制备癫痫大鼠模型,每24 h注射1次,连续注射4周,每次注射后观察大鼠出现痫性发作的表现。采用修正RacineⅥ级评价标准对大鼠癫痫发作情况进行评定[6]。在大鼠4周连续应用PTZ期间内,如Ⅳ级以上的癫痫发作连续出现3次,即被视为癫痫模型制备成功,并用于后续的实验,此后仍每周腹腔注射1次相同剂量的PTZ以维持发作。正常对照组大鼠腹腔注射同等容量的生理盐水;伽玛刀对照组仅给予伽玛刀照射;PTZ致痫组大鼠由PTZ制备癫痫模型;PTZ致痫+伽玛刀组大鼠经PTZ制备癫痫模型后再接受低剂量伽玛刀照射。
1.2 低剂量伽玛刀照射PTZ连续注射4周,癫痫模型制备成功后,应用Leksell伽玛刀系统(ELEKTA,瑞典)对实验大鼠进行单次低剂量伽玛刀照射,实验大鼠麻醉后(腹腔注射水合氯醛,35 mg/kg)固定在动物架上,再将其置于伽玛刀的Leksell框架上,应用核磁共振仪(Signa 1.5T)对大鼠进行定位扫描,以大鼠双侧额叶为照射靶区,并根据核磁图像在Gamma Plan系统上确定双侧额叶的坐标轴,以50%等剂量线包围靶区,边缘剂量为15 Gy,用4 mm准直器进行照射[3]。

表1 两组大鼠不同时间点痫性发作程度的比较(n)
与PTZ致痫组比较:*P<0.05
1.3 激光共聚焦扫描显微镜检测各组大鼠分别于伽玛刀照射后12周常规断头迅速取脑,在低温操作台上分离出额叶及海马组织。经DMEM培养基漂洗,用0.25%胰蛋白酶37 ℃恒温消化30 min,再经DMEM培养基漂洗终止消化反应。后用不同口径的玻璃吸管将脑组织轻柔吹打成单细胞悬液。悬液经滤网过滤后,加入钙离子荧光探针Fluo-3/AM(Biotium 公司,美国)(含0.1% F-127),终浓度为5 μmol/L。再将细胞悬液避光孵育30 min(37 ℃),用DMEM培养基漂洗2~3次。在载玻片上滴一定量的细胞悬液,待细胞贴壁后,再将其放置于激光共聚焦显微镜(Leica,德国)的载物台上。先在低倍镜(×10)下找到悬液中的神经细胞,再在高倍镜(×20)下选取不同视野的神经细胞进行扫描。发射光为530 nm,激发光为488 nm。以荧光强度最强的扫描层面为标准值,每个样本取20个神经细胞,取其平均值作为每样本的Ca2+荧光像素值。
2 结果
2.1 癫痫大鼠模型制备情况实验大鼠于腹腔注射PTZ 3~6次后出现痫性发作,如头面部抽动、四肢抽动及阵挛、全身肌阵挛发作、跌倒及周身翻滚等。每次于注射后3~5 min出现,随着注射数次增加,发作程度逐渐加重。每次发作持续40~60 min后逐渐缓解。16只大鼠中共有12只模型制备成功,于注射12~16次后连续出现3次Ⅳ级以上的痫性发作,成功率为75%。
2.2 各组大鼠癫痫发作情况对照组及伽玛刀对照组大鼠行为正常,无痫性发作。PTZ致痫组大鼠连续注射4周PTZ后每周再次注射时,绝大部分可出现Ⅳ级以上发作。PTZ致痫+伽玛刀组大鼠经低剂量伽玛刀照射后,随时间的延长,每周再次注射PTZ,发作程度逐渐减轻。实验将Ⅰ~ Ⅲ级发作定为轻度,Ⅳ~Ⅴ级定为重度,于照射后第12周,两组大鼠发作差异有统计学意义(P<0.05),见表1。
2.3 各组大鼠额叶皮层及海马神经细胞内Ca2+水平共聚焦显微镜检测结果显示,与正常对照组相比,伽玛刀对照组大鼠额叶及海马神经细胞内的Ca2+荧光强度轻度升高,但差异无统计学意义(P>0.05);PTZ致痫组较正常对照组升高;PTZ致痫+伽玛刀组较PTZ致痫组降低,差异有统计学意义(F皮层=20.936、F海马=26.189,P<0.001)。见表2和图1、2。
表2 各组大鼠皮层及海马神经元内Ca2+荧光像素值的比较
与正常对照组比较:*P<0.05; 与PTZ致痫组比较:ΔP<0.05
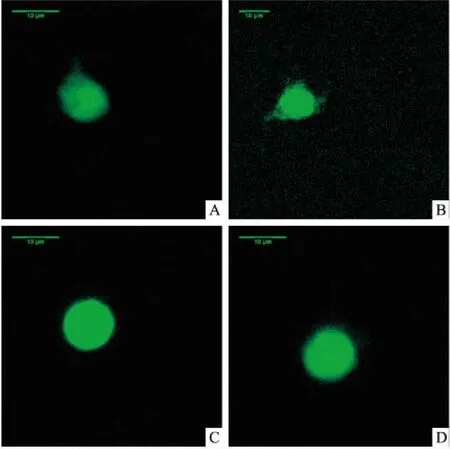
图1 各组大鼠皮层神经元内Ca2+荧光强度
A:正常对照组; B:伽玛刀对照组; C:PTZ致痫组; D:PTZ致痫+伽玛刀组

图2 各组大鼠海马神经元内Ca2+ 荧光强度
A:正常对照组; B:伽玛刀对照组; C:PTZ致痫组; D:PTZ致痫+伽玛刀组
3 讨论
Ca2+广泛分布于机体细胞与体液当中,作为细胞内最重要的第二信使,在信号转导中发挥着重要作用,参与多种生理功能的调节。正常生理状态下,神经细胞外的Ca2+浓度约为细胞内的2万倍,细胞可通过多种调控机制维持细胞内的钙稳态,如细胞内钙库摄取及释放,Ca2+跨膜转运等。目前研究[7]表明,Ca2+在各种神经退行性疾病的病生理过程中起着至关重要的作用,细胞内钙稳态失衡是癫痫发生的触发因素。关于神经细胞内钙稳态失衡影响癫痫发病的实验证据日益增多[8]。癫痫发作时大脑神经细胞内的Ca2+急剧升高超过阈值,神经细胞受到损伤或异常放电,可能是癫痫发生的直接原因。Raze et al[9]研究发现慢性癫痫大鼠海马神经元内Ca2+浓度升高,并且在致痫后1年神经元内Ca2+浓度仍维持较高水平。 Pal et al[10]将海马神经元在无Mg2+培养液中培养3 h,发现神经元内的Ca2+水平显著升高,并出现痫性放电。Ghotbeddin et al[11]应用膜片钳实验表明,杏仁核点燃可增强电压门控Ca2+通道电流,而T型Ca2+通道的选择性阻断可抑制杏仁核点燃的进展[12]。以上研究显示无论离体还是在体的痫性神经元均存在钙稳态的变化。本研究显示,致痫大鼠额叶皮层及海马的神经细胞内Ca2+浓度明显升高,与近年来的文献报道一致。
目前大量资料表明,Ca2+作为神经细胞内的重要信使与学习记忆密切相关,Ca2+内流入突触后膜是触发形成LTP的必要条件之一。本研究表明PTZ致痫大鼠额叶皮层及海马神经细胞内Ca2+浓度升高,而癫痫大鼠学习和记忆受损[3],提示钙稳态失衡与癫痫大鼠的认知障碍密切相关。课题组前期研究[13]还显示,PTZ致痫大鼠脑组织N-甲基-D-天氡氨酸(N-methyl-D-aspartate, NMDA)受体亚基1、NMDA受体2A及NMDA受体2B过度表达,故推测皮层和海马组织NMDA受体活性增强,可能是导致癫痫大鼠神经细胞内游离Ca2+水平升高的重要机制。
近年来研究[14]已证实伽玛刀照射可有效地控制颞叶癫痫的癫痫发作,并对该类患者的认知功能、心理、情绪没有明显影响。目前认为低照射剂量(边缘剂量10~20 Gy)在不损害正常神经元的同时可提高癫痫灶的阈值,产生抗痫作用[15]。但其生物学作用机制仍不明确。本研究结果显示,边缘剂量15 Gy的伽玛刀照射可显著降低癫痫大鼠皮层和海马神经细胞内Ca2+水平,而对正常脑组织影响较小,提示低剂量伽玛刀可能是通过调节神经细胞钙稳态而起到抗癫痫作用的。然而,伽玛刀照射对神经细胞内Ca2+的调控机制尚不清楚。目前研究集中在电离辐射对Ca2+异化扩散和细胞膜的Ca2+通道的影响。结合课题组前期的研究结果,低剂量伽玛刀照射后神经细胞内Ca2+浓度降低可能与癫痫病灶NMDA受体活性减低有关,具体机制有待进一步深入探讨。

