多巴胺修饰表面原位还原纳米银的关键影响因素
许克惠, 王 爽, 崔文迪,李娇娇,陈佳龙
钛及其合金广泛用于牙科种植体和骨科矫形并取得良好的临床效果,但感染发生率仍较高。材料表面整合纳米银(Nanosilver,AgNPs),赋予其广谱抗菌能力,也避免抗生素导致的耐药菌[1]。近年来,一种简单而环保的液相多巴胺原位还原纳米银的方法被研究[2-3],即利用多巴胺的邻苯二酚与材料表面羟基缩合[4]或金属配位[5]而结合在材料表面,再螯合溶液中的银离子并还原,如在钛金属[1]、氮化硼纳米片[6]、纸[7]的表面沉积多巴胺后,浸泡于银溶液,获得载纳米银表面。
目前,多巴胺原位还原纳米银过程中调控因素的系统性研究很少,故研究以多巴胺修饰的多孔钛作为基材,通过调整硝酸银溶液的浓度和pH制备出不同的载银表面,研究各表面理化性能和抗菌性能,为多巴胺介导的纳米银合成提供指导。
1 材料与方法
1.1 材料纯钛购自山西宝鸡有色金属有限公司;多巴胺、硝酸银购自美国Sigma Aldrich公司;丙酮、Tris购自上海阿拉丁试剂有限公司;NaoH购自上海国药集团化学试剂有限公司;脑心浸液肉汤(Brain Heaet Infusion Broth, BHI)购自青岛高科园海博生物技术有限公司;活/死细菌染色试剂盒购自美国Invitrogen公司。
1.2 材料制备及表征将钛片(直径为1 cm)依次经过80、150、400、600、800、1 000、1 500、2 000目砂纸打磨后。再依次经过丙酮,无水乙醇,去离子水超声清洗,标记为Ti。将钛片浸没于5 mol/L NaOH溶液中60 ℃处理12 h后,浸入沸水处理2 h,标记为pTi;将pTi浸没于2 mg/ml的多巴胺溶液中(pH 8.5),室温下敞口静置24 h,去离子水超声清洗,样品标记为pTi-Da。将pTi-Da浸没于不同pH(4、7、10)、不同浓度(2、4、6 mg/ml)硝酸银溶液中,室温下反应4 h,去离子水超声清洗3次,每次30 s,干燥后得到表面沉积纳米银的样品,总体标记为pTi-Da-Ag。为便于记录,对不同pH、不同浓度分别标记为pH4/2、pH7/2、pH10/2、pH4/4、pH7/4、pH10/4、pH4/6、pH7/6 和pH10/6。制备过程如图1所示。
各组选1个样品干燥后喷金30 s,利用扫描电子显微镜(HitachiS-480,SEM)观察表面形貌的变化。各组选5个样品,室温下测量表面水接触角。各组选1个样品利用硝酸/盐酸(1 ∶3)混合液溶解表面的银,通过电感耦合等离子体原子发射光谱法(ICP-AES)测定钛片表面载银量。
1.3 抗菌性能评价为评价制备材料的抗菌能力,选择导致种植体感染的主要细菌(金黄色葡萄球菌),细菌密度为107CFU/ml进行以下评价。将2 ml菌液加入到放有灭菌样品的24孔板中,37 ℃培养24 h后,① 每组取出2个样品,PBS漂洗,采用活/死细菌试剂盒染色 20 min后,荧光显微镜下观察活/死细菌;② 每组取1个孔,吸取10 μl的菌液,PBS稀释1 000×后,取100 μl涂板,通过涂板法评价材料对溶液中细菌增殖的影响;③ 每组取5个孔,吸取0.2 ml溶液用酶标仪在波长为660 nm下测量吸光度,通过浊度法评价材料抗菌能力;④ 取细菌密度为107CFU/ml的菌液20 μl加入琼脂培养板并涂布涂匀,然后每组取1个样品正面向下放置在琼脂培养基上,37 ℃培养24 h,测量抑菌圈直径。
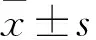
2 结果
2.1 样品表征扫描电子显微镜(图2)展示了各步骤样品表面形貌的变化。与表面光滑的Ti相比,碱处理后的表面(pTi)具有均匀的多孔形貌,孔径大小为50~100 nm,并有大量的杆状物;多巴胺修饰表面(pTi-Da)未有变化;pH 4的3组样品中,pH4/2表面可见极少量的、粒径为20 nm左右的球形纳米银(红圈所示),pH4/4、pH4/6表面同样出现少量的球形或多角形纳米银颗粒,粒径在20~60 nm不等;pH 7的3组样品中,纳米银的数量有所增加,粒径分布在20-50 nm,随着浓度的升高,可见表面纳米银的数量依次增加(pH7/6由于表面颗粒较多,未用红圈标注);pH为10的3组样品表面均有大量的纳米银颗粒,pH10/2表面纳米银粒径约为20 nm, pH10/4和pH10/6表面纳米银尺寸更加均匀、更小,且数量更多,已经填满孔洞。以上结果直接证明载银表面构建成功。
材料表面亲水性结果差异具有统计学意义(F=70.52,P=0.00),见表1,Ti、pTi、pTi-Da的水接触角分别为(62.40±7.55)°、(10.02±2.74)°、(34.51±4.08)°,组间差异有统计学意义(P<0.01),说明碱热活化和多巴胺水相沉积成功实现。pH4/2、pH7/2、pH10/2、pH4/4、pH7/4、pH10/4、pH4/6、pH7/6、pH10/6的水接触角分别为(22.85±2.61)°、(20.06±2.07)°、(30.97±3.72)°、(22.84±3.41)°、(20.18±2.34)°、(34.20±5.03)°、(24.09±1.50)°、(15.98±1.69)°、(36.31±1.12)°。pH4和7的各组样品与pTi-Da差异均有显著性(P<0.01),而pH10的3组样品与pTi-Da差异无统计学意义。相同pH下,不同浓度的样品间,只有pH10/2和pH10/6间差异有统计学意义;相同浓度下,不同pH的样品组间,pH10与pH4和7差异均有统计学意义(P<0.01)。结果间接证明pH4和pH7下,载银表面构建成功。

图2 各样品的表面形貌 ×100 000

表1 各组样品静态水接触角和24 h细菌增殖结果比较
ICP-AES检测钛片表面载银量,见表2。由表可见,相同pH值下,制备表面的载银量随着溶液中硝酸银的浓度增加而增加,但增幅不大;相同硝酸银浓度下,制备表面载银量随着pH值增加而大幅增加,尤其pH10的处理组的表面载银量较对应浓度的pH7处理组增加1倍以上。该结果与扫描电镜结果相吻合。

表2 各钛片表面含银总量(μg)
2.2 抗菌评价原位活/死荧光染色法直接检测材料表面抗菌能力。如图3所示,Ti、pTi和pTi-Da的表面快速粘附大量细菌且活细菌比例高(绿色);pH4和pH 7的处理组表面黏附细菌量降低,且死细菌比例(红色)增加;pH 10的3组样品黏附细菌量极少,且以死细菌为主,证明该pH值下制备表面抑菌和杀菌性能最佳。

图3 经活/死细胞荧光染色法各样品显微照片,×100
图中绿色代表活菌,红色代表死菌;A:Ti; B:pTi; C:pTi-Da; D:pH4/2; E:pH7/2; F:pH10/2; G:pH4/4; H:pH7/4; I:pH10/4;J:pH4/6; K:pH7/6; L:pH10/6

图4 稀释涂布平板法结果
涂板法(图4)直接反映溶液体系中细菌的数量。Ti、pTi、pTi-Da的涂板中已经长满细菌;pH 4和pH 7的处理组中,细菌数量略有下降;pH10的3组样品的细菌数量大幅下降,且菌落数量随着硝酸银浓度增加而降低,pH10/2菌落均独立分布,未连成片,pH10/4上零星的几个菌落,而pH10/6上几乎看不到菌落,证明碱性环境且高浓度下制备表面的抗菌能力最好。
图5是浊度法测量溶液体系中细菌数量,统计学结果(表1)显示差异具有显著性(F=110.67,P=0.00)。Ti、pTi和pTi-Da培养体系中菌液的吸光度值最大,分别为1.18±0.16、1.21±0.21和1.30±0.13,两组间比较差异无统计学意义,证明3种样品不具有抑制周围细菌增殖的能力。载银表面pH4/2、pH7/2、pH10/2、pH4/4、pH7/4、pH10/4、pH4/6、pH7/6、pH10/6的光密度分别为0.37±0.01、0.39±0.03、0.07±0.00、0.36±0.04、0.29±1:Ti; 2:pTi; 3:pTi-Da; 4:pH4/2; 5:pH7/2; 6:pH10/2; 7:pH4/4; 8:pH7/4; 9:pH10/4; 10:pH4/6; 11:pH7/6; 12:pH10/6;与Ti、pTi、pTi-Da比较:*P<0.05;与pH10/2比较:#P<0.05; 与pH10/4比较:△P<0.05; 与pH10/6比较:▽P<0.05
0.11、0.06±0.00、0.44±0.08、0.34±0.05、0.06±0.00,结果显示,与Ti、pTi和pTi-Da培养体系相比,载银表面均抑制了体系中细菌的增殖,且差异具有统计学意义(P<0.05)。在所有载银表面中,pH4和pH7的6组样品间差异无统计学意义,pH10的3组样品间差异无统计学意义,pH10的3组样品对细菌的抑制能力强于pH4和pH7的6组样品,且差异具有统计学意义(P<0.05)。该结果证明载银表面均具有良好的抑制周围细菌增殖的能力,其中以碱性条件下制备表面抑菌能力最强。

图5 各样品的细菌增殖结果

图6 各样品抑菌环实验结果
黑色虚线代表抑菌圈;左下方黑色数字代表抑菌环大小;A:Ti; B:pTi; C:pTi-Da; D:pH4/2; E:pH7/2; F:pH10/2; G:pH4/4; H:pH7/4; I:pH10/4;J:pH4/6; K:pH7/6; L:pH10/6
抑菌圈试验评价了样品对周围细菌生长的抑制能力。如图6所示,未载银的表面(Ti、pTi、pTi-Da)周围没有出现抑菌圈,载银样品周围都出现了大小不等的抑菌圈(黑圈所示),图片左下角的黑色数字为抑菌圈的数值,数值越大,说明抑菌效果越好。相同硝酸银浓度下,随着pH升高,抑菌圈逐渐增大;相同pH下,随着硝酸银浓度增加,抑菌圈逐渐增大。
3 讨论
研究通过热碱处理形成微纳米多孔表面,并显著改善表面的亲水性,这2种改变都可以改善种植体的骨整合能力[1]。热碱处理的另一个优势是可以在钛片表面形成大量的羟基,这有利于多巴胺的沉积。多巴胺涂层包含许多官能团(酚羟基、醌基、氨基和亚胺),酚羟基和醌基可以螯合Ag+并能将Ag+还原为纳米单质银,这种方法相较于其它纳米银制备方法,具有操作简便、环保等优点。
目前多巴胺介导的载银表面构建均采用碱性环境,且对于构建载银表面过程的关键调控因素的系统研究很少;另外,AgNPs虽然具有广谱抗菌能力、不易产生耐药性[8]等优势,但其可能对生物系统产生的负面影响(如细胞毒性)不容忽视[9],所以探究制备载纳米银表面的关键影响因素、筛选低载银量且具有良好抗菌能力的表面制备方法非常重要[10]。考虑到纳米银制备过程中的主要变量为硝酸银浓度和溶液pH,本实验对酸性、中性、碱性3种pH的硝酸银溶液制备表面评价,结果显示碱性环境还原的纳米银数量大、尺寸小、分布均匀。Fernando et al[11]研究表明,在酸性和中性条件下,纳米银不稳定,容易聚集形成大尺寸的颗粒;在碱性条件下,纳米银表面大量的羟基导致其不易聚集,均匀分布且颗粒尺寸小。Csapó et al[12]也研究了pH对柠檬酸修饰的银纳米的影响,结果同样显示pH>7时,纳米银稳定且不易聚集。
本研究进一步评价各制备表面的抗菌能力,原位活/死荧光染色法、稀释涂布平板法、浊度法和抑菌圈试验均表明,随着溶液pH值升高,制备样品不但表面的抑菌和杀菌能力增强、且对周围环境中细菌的抑制能力也增强,碱性环境制备表面的抗菌能力最好,推测其与表面载银量密切相关;另外,硝酸银浓度对制备表面抗菌性能也有影响,随着浓度增加,抗菌能力增强,但增强幅度远小于pH的影响,只有在较敏感的抗菌评价方法中表现明显(如活死细菌染色和抑菌圈),推测活死细菌评价与表面纳米银的量直接相关,抑菌圈评价中由于加入细菌数量很少导致微小的银释放即可达到抑菌的目的,故这两个方法可以证明浓度的影响;而涂板法和浊度法反映了溶液体系中的细菌增殖量,这与材料表面银释放量和释放速度、溶液体系大小、溶液中初始细菌数量都有关系,所以导致结果无法与制备体系中银浓度产生明确的关系。制备溶液中硝酸银浓度和pH值都可以影响多巴胺表面纳米银的沉积,相较于硝酸银浓度,溶液pH值对表面制备影响更大,碱性环境更利于纳米银沉积,且制备表面的抗菌性能更好。
另外,表面改性的种植体具有适当骨整合作用,实验表明,含适量银的生物材料与哺乳动物细胞(包括成骨细胞)相容[13]。然而,有研究表明,多巴胺原位还原纳米银的表面具有明显的细胞毒性,可归因于银的快速浸出和在培养基中的积累[14],如Zhang et al[1]观察到多巴胺载纳米银涂层对成骨细胞黏附和增殖有抑制作用,但为了模拟体内环境,将样品浸泡于模拟体液7d后,表面形成矿化层,不但促进了细胞的黏附和增殖,且促进了碱性磷酸酶的表达,推测其植入体内会随着植入时间延长而表现出良好的促成骨效果,本研究所使用的硝酸银浓度远低于该研究使用浓度,故推测其可能具有更好的效果。
本研究系统评价了硝酸银溶液浓度和pH值对制备载纳米银表面的影响,证明两者对制备表面的抗菌能力有影响,且pH值影响更大,对多巴胺修饰生物材料表面载银涂层构建具有指导意义,即可以根据使用部位感染发生概率而调控制备参数,获得合适的表面抗菌性能并减少银离子的浪费,进而减少环境污染。

