CD147通过Wnt/β-catenin 途径抑制前列腺癌细胞对多西紫杉醇敏感性
方 芳, 徐海月,李 强,陈 爽,王立国
随着生活方式的改变,我国前列腺癌(prostate cancer, PCa)的发病率和死亡率呈逐年上升趋势[1]。雄激素阻断疗法(androgen deprivation therapy, ADT)是中晚期PCa主要治疗手段。然而,大多数患者在接受ADT治疗2~3年内由雄激素依赖性前列腺癌(androgen-dependent prostate cancer, ADPC)转化为生存期短、易转移和侵袭的去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC),中位生存期只有1~2年。多西紫杉醇(docetaxel, DOC)是治疗CRPC的一线化疗药物,能有效提高患者生存率,但效果较短暂,极易产生耐药,从而影响临床治疗的效果。因此,克服DOC的耐药问题有望改善CRPC难治的现状。
细胞外基质金属蛋白酶诱导因子(extracellular metalloproteinase inducer,EMMPRIN),又称CD147。CD147属于跨膜免疫球蛋白超家族成员,过表达在多种肿瘤细胞表面。CD147参与肿瘤细胞增殖、转移和侵袭等作用[2-3]。研究[4]表明,在化疗药物抵抗的肿瘤细胞中CD147表达增高。CD147表达阳性的肿瘤患者接受铂类化合物治疗后生存期短、预后差[5]。该研究旨在探讨CD147在前列腺癌细胞DOC耐药中的作用,并对其可能机制进行初步研究,从而为逆转PCa对DOC化疗耐药提供新的研究靶点。
1 材料与方法
1.1 细胞和主要试剂人前列腺癌PC-3细胞购自上海中科院细胞库;DOC和溴化四氮唑蓝购自美国Sigma公司;细胞核蛋白提取试剂盒和Annexin V/碘化丙啶(propidium iodide, PI)凋亡检测试剂盒购自南京碧云天生物有限公司;DMEM-F12培养基及胎牛血清(fetal calf serum, FCS)购自美国Gibco公司;β-连环蛋白(β-catenin)、P 糖蛋白(P-glycolprotein,P-gp)和β-actin 抗体、Wnt 通路激活剂 LiCl 购自美国Cell Signaling Technology公司。辣根过氧化物酶标记的山羊抗兔 IgG购自北京中杉金桥生物技术有限公司。
1.2 实验方法
1.2.1细胞培养 低表达 CD147 的实验组PC-3细胞(PC-3/shCD147)和阴性对照组细胞PC-3细胞(PC-3/Scramble)由吉林医药学院抗体工程实验室保存[6]。细胞用 DMEM-F12 完全培养基(含10% 胎牛血清)于37 ℃、5% CO2培养箱中培养,隔日换液。
1.2.2MTT法检测细胞IC50取对数生长期PC-3/Scramble细胞和PC-3/shCD147细胞,调整细胞浓度为1 ×1010/L,体积为200 μl,分别接种于96孔板内,于37 ℃、5% CO2条件培养24 h。分别加入不同浓度(0、1、5和10 μmol /L) DOC培养液,每组设3个复孔,体外继续培养 72 h。MTT 法测定吸光度( A) 值,实验重复 3 次,计算细胞抑制率:抑制率(%) = (1-实验组平均A 值/对照组平均 A 值)×100%,计算各组细胞IC50值。
1.2.3Annexin V/PI法检测细胞凋亡率 5 μmol/L DOC处理PC-3/Scramble和PC-3/shCD147细胞 24 h 后,胰酶消化收集细胞。用预冷无菌的PBS充分洗涤细胞2次,收集细胞调整细胞数为5×105个,加195 μl Annexin V-FITC结合液轻轻重悬细胞;加入5 μl Annexin V-FITC,轻轻混匀。室温、避光孵育10 min;加入10 μl 碘化丙啶染色液,轻轻混匀,冰浴避光放置,流式细胞仪进行分析。
1.2.4Western blot检测蛋白表达 取对数生长期的细胞,5 μmol/L DOC处理细胞 72 h 后。加入细胞裂解液,用细胞刮器刮取细胞,4 ℃ 超声裂解细胞,分别提取细胞总蛋白和细胞核蛋白,收集上清液测蛋白浓度。取 30 μg 蛋白进行SDS-PAGE分离并转移到聚偏二氟乙烯(PVDF) 膜上。室温下PVDF 膜在封闭缓冲液中2 h,加兔抗β-catenin(1 ∶1 000)、P-gp(1 ∶1 000)和 β-actin抗体(1 ∶4 000),4 ℃ 过夜。次日,TBST洗膜,分别加 HRP 标记的山羊抗兔抗体(1 ∶5 000)室温避光孵育 2 h。TBST洗膜,加底物发光显影。使用Quantity One软件扫描并做灰度分析。
2 结果
2.1 沉默CD147表达增强PC-3细胞对DOC的敏感性分别用1、5和10 μmol /L DOC作用细胞72 h后,MTT结果表明,与PC-3/Scramble细胞比较,DOC对PC-3/shCD147细胞的抑制率升高,并随DOC浓度的增加而增高(F=11.28,P<0.05;F=397.15,P<0.01;F=60.69,P<0.01)(图1)。计算DOC对PC-3/Scramble和PC-3/shCD147细胞IC50值。结果显示,PC-3/Scramble细胞的IC50值 为(12.47±1.71)μmol/L,PC-3/shCD147细胞的IC50值为(2.38±0.13)μmol/L。提示CD147具有抑制PC-3细胞对DOC的敏感性作用。
2.2 沉默CD147表达促进DOC干预的PC-3细胞凋亡通过上述实验结果,采用0或5 μmol/L DOC作用细胞24 h,流式细胞仪对PC-3/Scramble和PC-3/shCD147细胞进行凋亡检测。结果显示,与PC-3/Scramble组细胞比较,5 μmol/L DOC作用后CD147干扰组细胞凋亡率增高(F=111.26,P<0.01)(图2)。提示CD147 能够抑制PC-3细胞在DOC作用下的细胞凋亡。
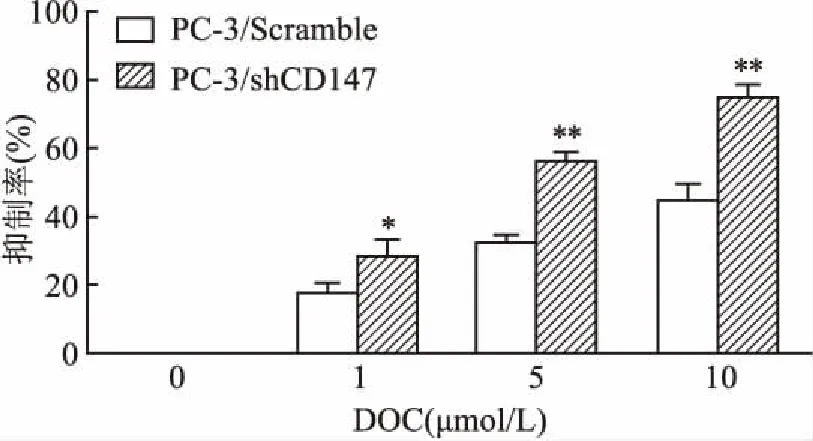
图1 沉默CD147增强DOC抑制的PC-3细胞生长作用
与PC-3/Scramble组比较:*P<0. 05,**P<0. 01

图2 沉默CD147促进DOC作用PC-3细胞凋亡
与5 μmol/L DOC作用PC-3/Scramble组比较:**P<0.01
2.3 CD147通过Wnt/β-catenin信号通路抑制DOC对PC-3细胞的敏感性采用0或5 μmol/L DOC作用细胞72 h,Western blot检测PC-3/Scramble和PC-3/shCD147细胞β-catenin和P-gp的表达。结果表明,与对照组PC-3/Scramble的β-catenin和P-gp的表达比较,PC-3/shCD147细胞中β-catenin和P-gp表达下降(F=73.83,P<0.01;F=10.97,P<0.05);与5 μmol/L DOC作用PC-3/Scramble细胞比较,5 μmol/L DOC作用PC-3/shCD147细胞导致β-catenin和P-gp的表达显著降低(F=159.05,P<0.01;F=110.47,P<0.01);与PC-3/shCD147细胞比较,5 μmol/L DOC作用PC-3/shCD147细胞导致β-catenin和P-gp的表达降低(F=160.27,P<0.01;F=8.63,P<0.05)(图3)。结果提示,CD147可能通过Wnt/β-catenin信号途径抑制PC-3细胞对DOC的敏感性作用。

图3 沉默CD147抑制DOC作用PC-3细胞β-catenin和P-gp的表达
a: PC-3/Scramble组;b: PC-3/Scramble+DOC组;c: PC-3/shCD147组;d: PC-3/shCD147+DOC组;与PC-3/Scramble组比较:*P<0. 05,**P<0. 01; 与5 μmol/L DOC作用PC-3/Scramble细胞比较:##P<0. 01; 与PC-3/shCD147细胞比较:ΔP<0. 05,ΔΔP<0.01
为了进一步证实Wnt/β-catenin信号通路参与CD147降低PC-3细胞对多西紫杉醇的敏感性。Wnt信号通路激活剂氯化锂(LiCl) (10 μmol/L)作用5 μmol/L DOC干预的PC-3/shCD147细胞6 h,MTT、Western blot检测结果显示,PC-3/shCD147细胞抑制率为(50.4±4.16)%,LiCl干预PC-3/shCD147细胞组的抑制率为(28.7±3.9)%,两组比较具有显著差异(F=43.53,P<0.01)。与PC-3/shCD147细胞β-catenin和P-gp表达比较,LiCl干预的PC-3/shCD147细胞后β-catenin和P-gp的表达增加(F=43.14,P<0.01;F=95.45,P<0.01)(图4)。
a: PC-3/shCD147组; b: LiCl组;c: PC-3/shCD147+LiCl组;与PC-3/Scramble细胞比较:**P<0. 01
3 讨论
化疗是治疗CRPC的主要方法。自2004年美国食品及药品管理局批准DOC用于CRPC的治疗,目前已成为CRPC的一线治疗药物,能有效提高患者的生存率。但药物治疗最大障碍之一是多数患者都会对DOC产生耐药性,从而影响临床治疗效果。克服CRPC的耐药问题,将改善CRPC的治疗困境。研究[7-10]表明,DOC引起的耐药机制比较复杂,包括凋亡信号通路的改变、微管蛋白的突变、铜转运蛋白的过表达、P-gp和多药耐药相关蛋白等改变。以及PI3K/Akt、MAPK和Wnt/β-catenin多信号通路参与肿瘤的细胞耐药[10-13]。P-gp是导致肿瘤细胞耐药的重要分子之一。研究[14]发现,在DOC耐药的CRPC细胞 DU-145R中 P-gp 的表达水平明显高于它们的亲代细胞 DU-145,并且应用P-gp 抑制剂能够一定程度上逆转 DU-145R 细胞对DOC的耐药性。在CRPC细胞PC-3中沉默P-gp的表达,PC-3细胞对DOC的敏感性明显增强[14]。
CD147是在PCa细胞中高表达,是促进肿瘤细胞转移和侵袭的重要分子。研究[15-16]表明,在头颈鳞状细胞癌和宫颈癌细胞中抑制CD147的表达能够促进对多西紫杉醇的药物敏感性。并且我国学者已经利用CD147单克隆抗体干预宫颈癌细胞后能够逆转细胞对紫杉醇的天然耐药[16]。证实CD147可能是一个理想的能够抑制细胞多西紫杉醇耐药的靶点。本研究发现,沉默CD147的表达能够提高CRPC细胞PC-3对DOC的敏感性,导致细胞凋亡升高。课题组前期研究[17]表明,沉默CD147能够抑制LNCaP细胞β-catenin转位到细胞核中。因此,本研究推测本课题组推测CD147可能够通过Wnt/β-catenin途径抑制PC-3细胞对多西紫杉醇的敏感性。本实验结果表明,在PC-3细胞中沉默CD147导致β-catenin在细胞核中的表达同样被降低,并且β-catenin的下游基因P-gp表达下降;DOC作用PC-3/shCD147细胞,导致β-catenin和P-gp表达进一步下降。结果提示CD147可能通过Wnt/β-catenin途径参与调解PC-3细胞对DOC的敏感性。为了进一步探讨CD147通过Wnt-β-catenin途径抑制PC-3细胞对DOC敏感性,使用Wnt信号通路激活剂LiCl作用细胞。与PC-3/shCD147组比较,LiCl减弱了沉默CD147导致DOC作用的PC-3细胞存活率下降,促进β-catenin和P-gp的表达。
综上所述,CD147能够导致前列腺癌细胞对DOC的敏感性降低,该作用可能通过Wnt/β-catenin信号转导通路实现。

