PCBP2在肠癌中的表达及功能意义
朱忠诚 ,余昌俊,陈昌裕,郑 强,3,康伟彪
自RNA被转录形成以后并不是以独立的形式存在于细胞内并发挥作用。细胞内大量的蛋白质与这些RNA相结合形成核糖核蛋白,在这一过程中,RNA结合蛋白(RNA binding protein,RBP)发挥了重要作用。Poly(rC)结合蛋白2 [Poly(rC) binding protein 2,PCBP2]是Poly(rC)结合家族的一种具有多功能适配蛋白,先前的研究主要集中于其参与病毒的转录后调控和翻译水平。近年来的研究[1]表明,PCBP2在肿瘤中既能促进肿瘤的生长,也可以在某些肿瘤中低表达,可能也扮演了抑癌基因的角色。但目前关于肠癌组织中PCBP2的表达水平及临床意义的研究尚未见报道,PCBP2调控肠癌的进展和转移的机制仍然未知。该研究检测了肠癌组织及邻近的肠黏膜中PCBP2中的表达,旨在探讨PCBP2对肠癌细胞增殖能力的影响。
1 材料与方法
1.1 病例资料收集2014年2~6月安徽医科大学第一附属医院胃肠外科三病区收治的肠癌患者50例,并随访4年。年龄:37~82(58.33±13.64)岁,男36例,女14例;直肠癌19例,结肠癌31例(右半结肠17例,乙状结肠12例,横结肠2例);高分化9例,中分化27例,低分化14例;所有患者术前均未接受抗肿瘤治疗,术后病理经安徽医科大学第一附属医院病理科医师明确诊断。肿瘤学分型和分期均根据WHO(2006版)标准,本实验经安徽医科大学第一附属医院伦理委员会审核通过。
1.2 细胞与试剂肠癌细胞HCT116细胞由中国科学技术大学提供,DMEM高糖培养液、胎牛血清、L-谷氨酰胺和无EDTA的胰蛋白酶均购自美国Life Technology公司;苏木精染色液购自福州迈新生物技术有限公司,三氯甲烷、EDTA、无水乙醇、二甲基亚砜和异丙醇购自上海国药集团化学试剂有限公司;6孔和96孔板购自上海圣纳堡生物科技开发有限公司;CCK-8试剂盒购自日本同仁公司;转染试剂Lipofectamine2000购自美国Invitrogen公司;HRP 标记的二抗和鼠来源的Actin一抗购自武汉三鹰生物技术有限公司;兔来源的PCBP2一抗购自美国lifespan公司。
1.3 实验方法
1.3.1免疫组化 肠癌组织及其邻近的正常黏膜组织固定包埋后连续切片,将连续切片(5 μm厚)置于涂有10%聚赖氨酸的载玻片上。这些切片在二甲苯中脱蜡,然后通过梯度酒精重新水化。高温和高压可增强免疫反应性,故将这些切片在高压灭菌器中的中煮沸20 min以回收抗原,过氧化氢(0.3%)封闭内源性过氧化物酶活性。甩干多余的血清,滴加抗PCBP2抗体(1 ∶200),4 ℃孵育过夜,使用过氧化物酶-抗过氧化物酶方法对所有载玻片进行处理。最后,将玻片用苏木精复染色,脱水,然后固定在树脂支架上。在奥林巴斯显微镜下观察染色的切片。每张切片选取5个不同视野,由两名主治以上的病理科医师相互、独立地根据染色强度和阳性细胞百分率来进行评分。半定量染色强度分析PCBP2的表达水平,0-4级分别为阴性、弱阳性(<30%),中等阳性(30%~60%),强阳性(>60%)。免疫组化结果评分定义为染色强度×染色阳性细胞百分率的评分所得;免疫组化评分≥3定义为表达, <3定义为不表达。
1.3.2细胞培养 肠癌细胞HCT116用DMEM培养基进行培养,加入10%胎牛血清、链霉素100 μg/ml 和青霉素100 U/ml,置于5% CO2的加湿细胞培养箱中进行孵育培养,温度控制在37 ℃。
1.3.3细胞转染 用Lipofectamine 2000进行细胞瞬时转染(根据试剂商提供的说明进行),PCBP2 siRNA由上海生工合成,siRNA起始序列:CATCACTATTGCTGGCATT,空白对照组为:TTCTCCGAATGTCACGT。
1.3.4Western blot 肠癌细胞HCT116转染72 h以后,用裂解液裂解细胞,提取细胞中的总蛋白并测出蛋白的浓度。取40 μg的蛋白样品在的SDS-PAGE中进行电泳后将蛋白转至PVDF膜,并置入的脱脂奶粉中常温封闭1 h,再根据说明书要求的比例稀释一抗,4 ℃的条件下孵育蛋白条带过夜。至第2 d用TBST洗去多余的一抗,并加入稀释过的HRP(1 ∶4 000)标记过的二抗在常温下进行孵育2 h,最后再用化学发光法(ECL)检测蛋白的表达量,验证PCBP2转染的有效性。本试验重复3次。
1.3.5克隆形成实验 HCT116细胞经过瞬时转染48 h以后用胰酶消化并计数,取6孔板细胞培养板一块,每个孔接种细胞约1 000个,加入培养液为2 ml,为了减少误差,每次设置3个平行孔,摇晃6孔板使细胞均匀分散,置于培养箱培养。每隔2天换1次培养基保证细胞生长所需营养并观察细胞,连续培养2周。PBS清洗两遍出去细胞残渣和培养液,多聚甲醛固定细胞并过夜。用结晶紫染色1 h,计数细胞克隆的数量并且拍照,每次设置3个重复孔,本试验重复3次。
1.3.6MTT实验 HCT116细胞经过瞬时转染48 h以后用胰酶消化并计数,取96孔细胞培养板5块,每个孔中加入转染并计数的HCT116细胞大约1 000个,加入MTT试 剂( MTT:含10%的胎牛血清为1 ∶9) 100 μl,为了减少误差设置6个平行孔,轻轻摇晃使细胞均匀铺于底部。周围加入PBS液减少水分蒸发对细胞生长造成的影响,置入培养箱进行培养。分别在培养后每隔24 h并且连续5 d检测每个孔中570 nm波长的吸光度(optical density,OD) 值,作细胞增殖曲线,本实验重复3次。
1.4 统计学处理采用SPSS 16.0软件进行统计学分析。定量资料以K-S法进行正态性检验,符合正态分布的数据采用均值±标准差描述集中趋势,比较采用t检验,不符合正态分布的数据采用中位数(四分位数间距)描述集中趋势,比较采用Wilcoxon秩和检验。定性资料采用卡方检验。P<0.05表示差异有统计学意义。
2 结果
2.1 肠癌中PCBP2的表达及其与临床病理特征的关系PCBP2在肠癌中的阳性率为72%,而在正常黏膜中的阳性率仅为40%(P=0.001),见表1;PCBP2的表达与肠癌的淋巴结转移情况(P=0.031)和病理分期相关(P=0.045),与患者的年龄、肿瘤的大小以及肿瘤细胞的分化程度无明显相关性(P>0.05),见表2。

表1 PCBP2在结直肠癌和正常癌旁组织中的表达[n=50,n(%)]
与癌旁组织比较 :*Z=10.390,P<0.05
表2 PCBP2表达水平与结直肠癌患者临床病理特征相关性分析

临床特征nPCBP2 阳性表达[n(%)]Z值P值年龄(岁) ≤ 55159 (60.0)1.5310.216 >553527 (77.1)肿瘤直径 (cm) ≤53325 (75.8)0.6800.410 >51711 (64.7)淋巴结转移 无3119 (61.3)4.6410.031 有1917 (89.5)肿瘤分化 高分化95 (55.6)1.6570.437 中分化2721 (77.8) 差分化1410 (71.4)肿瘤分期 Ⅰ+Ⅱ2817 (60.7)4.0200.045 Ⅲ+Ⅳ2219 (86.4)
2.2 PCBP2的表达与术后生存时间的关系术后4年随访发现,PCBP2表达阳性的患者,无论是无复发生存时间(P=0.039)还是总生存时间(P=0.037)均小于PCBP2表达阴性的患者,见图1。
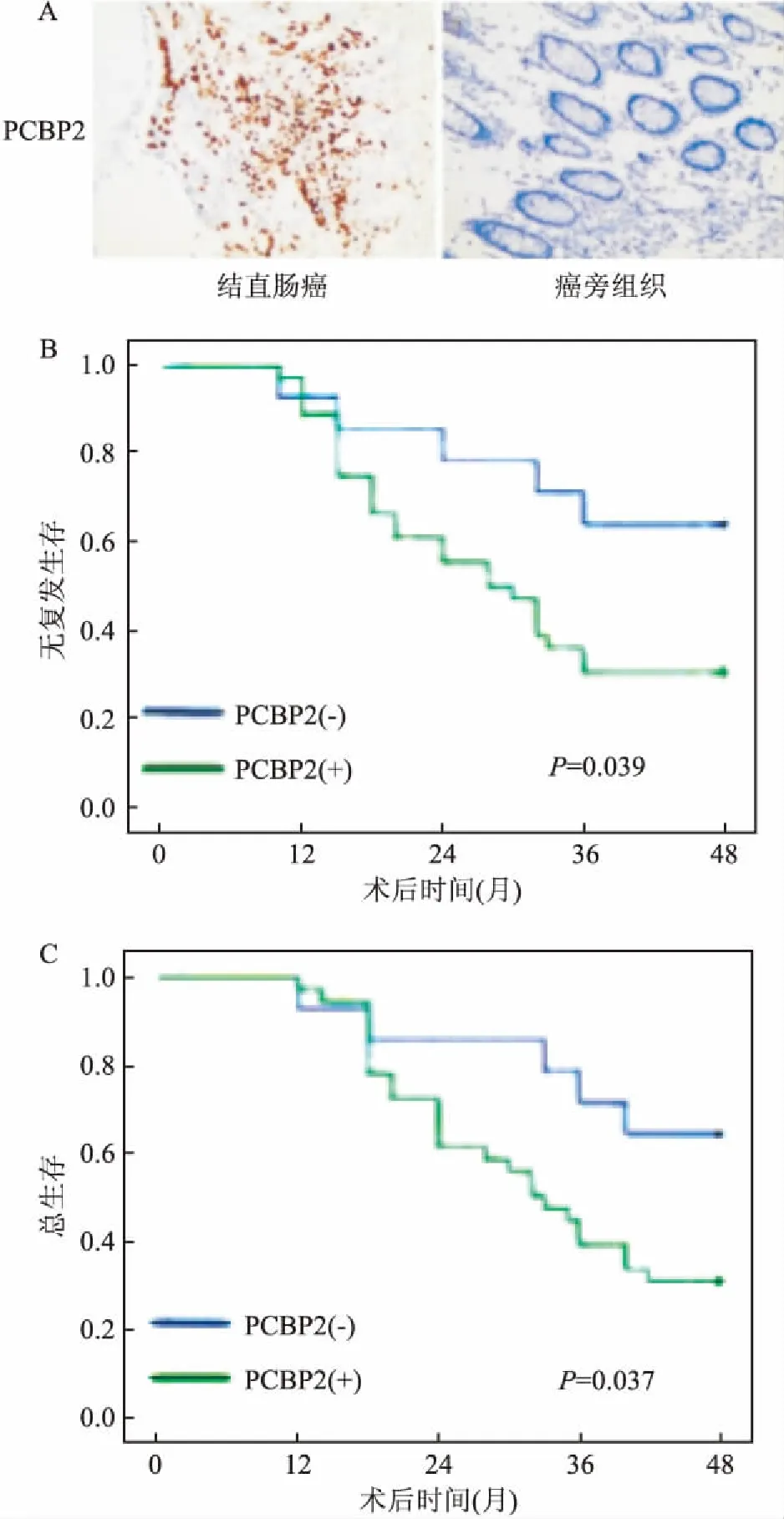
图1 PCBP2在肿瘤组织和对应癌旁正常黏膜中的表达及生存时间 ×200
A:PCBP2在肠癌中表达阳性;B:PCBP2表达阳性的患者术后无复发生存时间小于PCBP2表达阴性的患者;C:PCBP2表达阳性的患者术后总生存时间小于PCBP2表达阴性的患者
2.3 PCBP2-siRNA的转染效率转染了siPCBP2 的肠癌细胞HCT116中的PCBP2的表达量明显下降(P<0.05),见图2A。
2.4 转染siPCBP2对肠癌细胞增殖的影响肠癌细胞HCT116细胞中的PCBP2被抑制后第1至5天每天检测OD值,显示PCBP2的低表达抑制了HCT116细胞的增殖,对照组与实验组结果差异有统计学意义(P<0.05),见图2B。
2.5 转染siPCBP2对肠癌细胞克隆形成的影响HCT116细胞转染了siPCBP2后,细胞的克隆形成能力明显减低,细胞形成集落数明显少于阴性对照组(P<0.05),见图2C。

图2 PCBP2对肿瘤细胞增殖和克隆形成的影响
A:干扰了PCBP2后其蛋白量下降;B:干扰了PCBP2后细胞增殖能力受抑制;C:干扰了PCBP2后细胞克隆形成能力受抑制
3 讨论
PCBP2是RNA结合蛋白家族的一员,参与了mRNA的稳定、翻译的沉默和加强。以往对于PCBP2的研究主要集中在与病毒的相互作用上,近几年的研究发现,PCBP2在肿瘤的发生和发展中也扮演了重要的角色。本研究显示,PCBP2在肠癌中高表达,且高表达的患者无瘤生存和总生存时间均短于PCBP2不表达的患者,这表明PCBP2可以作为肠癌预后评估的因素。国内外的一些学者也发现,PCBP2在大部分的实体瘤中高表达,且其高表达预示着不良的预后。他们发现PCBP2在胃癌[2-3]、肝癌[4]、脑胶质瘤[5]、食道癌[6]、乳腺癌[7]等肿瘤中表达增加,可能扮演了癌基因的角色。但也有学者研究发现,PCBP2在口腔癌[8]中表达下调, 这与我们的研究结果及大部分的在肿瘤中的研究结果相反,这可能是由于基因的多功能性导致其在不同的肿瘤的功能不同。
在PCBP2的功能研究中,课题组发现,抑制PCBP2的表达可以有效地抑制肠癌细胞的增殖和克隆形成能力,提示内源性的PCBP2对肠癌细胞的生长具有促进作用。在对其他肿瘤的研究中,Han et al[5]研究发现,PCBP2通过FHL3来促进胶质瘤细胞的生长。Chen et al[2]通过对胃癌细胞的研究发现,PCBP2通过作用于CDK2来增强胃癌细胞的生存能力;同样地在胃癌中,Hu et al[3]发现,同样地促进胃癌细胞的生长,PCBP2是通过作用于miR-34a来发挥其癌基因的活性。

