茶树CssHSP18.1基因克隆及表达分析
蒋君梅,方远鹏,宁娜,陈美晴,杨再福,王勇,李向阳,谢鑫*
茶树基因克隆及表达分析
蒋君梅1,方远鹏1,宁娜1,陈美晴1,杨再福1,王勇1,李向阳2*,谢鑫1*
1. 贵州大学农学院,贵州 贵阳 550025;2. 贵州大学绿色农药与农业生物工程国家重点实验室培育基地 教育部重点实验室 精细化工研究开发中心,贵州 贵阳 550025
基因家族可编码一类小分子的热激蛋白,广泛分布于植物中,具有分子伴侣的功能,在植物抵抗逆境胁迫中起着重要作用。通过基因克隆的方法,获得1个茶树基因的开放阅读框(Open reading frame,ORF),其全长480 bp,编码159个氨基酸。生物信息学分析表明,CssHSP18.1蛋白含有1个典型HSP20结构域,相对分子质量约为18.25 kDa,等电点为5.68,偏酸性,与栎和苹果亲缘关系最近,无信号肽与跨膜结构。RT-qPCR分析表明,在甘露醇(-Mannitol)处理下表达量低于对照组;-氨基丁酸(GABA)能促进该基因的表达,在处理后1 h时表达量达到峰值;吲哚乙酸(IAA)和聚乙二醇(PEG 6000)处理后,在0.5 h时表达量最高,即GABA、IAA、PEG 6000均可诱导的表达。为获得CssHSP18.1可溶性蛋白,构建了pET-28a-CssHSP18.1重组质粒进行原核表达,并分别对表达菌株、诱导温度以及IPTG(异丙基---硫代吡喃半乳糖苷)诱导浓度进行优化。结果显示,CssHSP18.1蛋白最佳表达菌株为BL21(DE3),最佳诱导温度和IPTG浓度分别为30℃和1.2 mmol·L-1。最后,采用Western blot对表达的CssHSP18.1蛋白进行验证。本研究为进一步揭示基因的生物学功能提供依据。
茶树;;基因克隆;生物信息学分析;胁迫;表达分析
茶树()是一种重要的经济作物[1],在种植过程中易受高温、低温和干旱等胁迫,从而影响茶树生长、茶叶产量和品质[2]。因此,对茶树进行抗性机制及抗性基因的研究具有重要意义。
分子伴侣(Molecular chaperones)是一类在细胞质中能识别并结合不完整折叠或装配的蛋白质,能够帮助其他蛋白质正确折叠、转运,但其本身不参与最终产物的形成[3]。据报道,分子伴侣广泛分布于动植物及微生物中,在其生长发育中发挥着重要作用,包括维持发育稳定[4],调节植物抗病过程[5],应对逆境胁迫(高温[6]、高盐[7]、干旱[8]等),以及病原耐热性[9]等。热激蛋白(Heat shock proteins,HSPs)是分子伴侣的一种,当有机体暴露在高温下,机体为保护自身由热激发合成的一类蛋白质,现泛指因逆境诱导而产生的蛋白。一些HSPs蛋白具有分子伴侣功能,在植物受到胁迫时,可以维持细胞稳态,在保护植物免受胁迫损害中起重要作用[10]。在正常状态下HSPs含量仅占蛋白总量的5%,但当受到外界胁迫时,含量会迅速升高,可达到蛋白总量的15%[11-12]。根据蛋白质大小分为HSP100、HSP90、HSP70、HSP60和sHSPs 5种类型[13]。
小分子热激蛋白(Small heat shock proteins,sHSPs)是一类分子量为20 kDa左右的蛋白,故又被统称为sHSP20[14],sHSPs家族成员拥有1个约90个氨基酸组成的晶体蛋白结构域(ACD结构域,-crystallin domain,或称HSP20结构域)[15]。在细胞中,sHSPs蛋白起着对生物体在胁迫过程中产生的不稳定蛋白进行“抢修”的作用[16]。植物sHSPs参与多种生理过程,包括抵御逆境[17-18]、预防不成熟蛋白聚集等[19]。目前在番茄()[20]、甘蔗()[21]、马铃薯()[22]、核桃()[23]、拟南芥()[24]、西瓜()[25]、百合()[26]等植物中均有研究报道。在茶树中已克隆了、、和等小分子热激蛋白基因[27],但对的研究鲜见报道。
本试验克隆了1个茶树基因,采用RT-qPCR对其表达模式进行分析,并通过原核表达方法进行蛋白表达,最后对蛋白可溶性表达条件进行探索,研究结果为CssHSP18.1蛋白生物学功能研究及晶体结构解析提供基础。
1 材料与方法
1.1 供试材料
茶树品种为福鼎大白茶,为室内盆栽,置于人工气候箱中培养,培养条件:昼/夜温度28℃/21℃,光周期12 h/12 h,相对湿度70%~80%,光照强度260 μmol·m-2·s-1。
1.2 供试试剂
Pfu高保真酶购自天根生化科技(北京)有限公司、限制性核酸内切酶和T4 DNA连接酶购自宝日医生物技术(北京)有限公司;SDS-PAGE凝胶电泳相关试剂均购自北京酷来博科技有限公司;感受态细胞JM109(DE3)、BL21(DE3)、BL21(DE3)pLys、Tuner(DE3)购自上海唯地生物技术有限公司;一抗Anti His和二抗(羊抗小鼠)均购自北京聚合美生物公司;RNA提取试剂盒及反转录试剂盒均购自普洛麦格(北京)生物技术有限公司;原核表达载体pET-28a为贵州大学植物病理教研室保存。
1.3 供试仪器
PCR扩增采用Bio-rad T-100梯度PCR仪(美国Bio-rad公司);蛋白免疫印迹试验采用天能5200化学发光检测仪(上海天能科技有限公司);SDS-PAGE凝胶电泳采用聚丙烯酰胺凝胶电泳系统[伯乐生命医学产品(上海)有限公司];ZWYR-D2402型号摇床(上海智城分析仪器制造有限公司),细胞超声波破碎仪(美国Sonics公司)。
1.4 茶树CssHSP18.1基因克隆与重组载体构建
1.4.1 总RNA的提取与cDNA的反转录
取茶树叶片材料,利用RNA提取试剂盒提取总RNA,用反转录试剂盒逆转录RNA获得cDNA,试验步骤参照试剂盒说明书进行。
1.4.2基因ORF克隆
以cDNA为模板,使用引物CssHSP18.1-F/ CssHSP18.1-R(表1)对基因进行扩增。引物设计参考基因序列(KU963241.1),通过Primer Premier 5.0软件设计。引物合成及扩增产物测序均委托北京擎科生物科技有限公司完成。
PCR扩增体系如下:Pfu 1 μL、cDNA1 μL、2.5 mmol·L-1dNTPs 4 μL、上下游引物各1 μL、5×buffer 10 μL、ddH2O 32 μL。PCR扩增条件为:95℃2 min;95℃20 s,58℃20 s,72℃30 s,32个循环。
1.4.3 构建pET-28aCssHSP18.1重组载体
采用酶切连接法构建重组载体。酶切回收后的扩增产物与经对应酶切的pET-28a表达载体,16℃过夜进行连接,获得pET-28a-CssHSP18重组质粒,并采用双酶切以及测序进一步验证,该载体中含有His标签。
1.5 生物信息学分析
以CssHSP18.1蛋白序列搜索NCBI数据库获得其他同源蛋白序列,利用MEGA 7.0软件,以邻接法(Neighbor-joining,NJ;bootstrap=1 000)构建无根进化树;通过EXPASy(https://web.expasy.org)的Prot-Paramtool及ProtScale在线程序预测该蛋白的等电点、相对分子质量和氨基酸疏水性;采用HMMER-3.2.1及SMART(http://smart.embl- heidelberg.de)网站预测蛋白的保守结构域;采用TMHMM软件(http://www.cbs.dtu.dk/services/TMHMM-2.0)预测蛋白的跨膜结构[28];蛋白亚细胞定位通过ProtComp 9.0(http://linux1.softberry.com)预测;利用PFP(http://dragon.bio.purdue.edu/pfp)对基因编码产物功能进行分析。

表1 引物序列
注:下划线部分为酶切位点;CsPTB:多聚嘧啶序列结合蛋白
Note: The underlined part is the enzyme cutting site. CsPTB: Polypyrimidine tract-binding protein
1.6 CssHSP18.1基因表达分析
选取长势一致茶苗,分别喷施PEG 6000(20%)、甘露醇(-mannitol,300 mmol·L-1)、吲哚乙酸(IAA,10 μmol·L-1)和-氨基丁酸(GABA,1 mmol·L-1)进行胁迫处理,分别在处理0、0.5、1、3、6、9、12 h和24 h取样,设置3个生物学重复,样品用液氮速冻后置于–80℃冰箱保存备用。
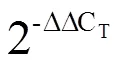
1.7 CssHSP18.1蛋白可溶性表达
将测序成功的pET-28a-CssHSP18.1重组表达载体,利用热激法分别转入感受态细胞JM109(DE3)、BL21(DE3)、BL21(DE3)pLys、Tuner(DE3),37℃过夜培养活化菌株;分别加入0.2、0.4、0.6、0.8、1.0 mmol·L-1和1.2 mmol·L-1IPTG;并分别在16℃、20℃、25℃、30℃和37℃下诱导表达5~16 h,诱导获得CssHSP18.1重组蛋白,诱导完成后,以转速12 000 r·min-1离心2 min,收集菌液,用磷酸缓冲盐溶液(Phosphate buffer saline,PBS)悬浮后,经超声破碎仪破碎2 min,离心5 min,在沉淀和上清液中分别加入上样缓冲液(Loading buffer),沸水变性5 min,取上清液进行蛋白电泳,测试最佳表达菌株、最佳诱导温度及最佳IPTG浓度。
1.8 蛋白免疫印迹分析
取表达的重组表达蛋白和对照组蛋白各10 µL,进行SDS-PAGE电泳,采用300 mA,65 min进行转膜。转膜完成后置PVDF膜于脱脂牛奶中封闭2 h,依次孵育一抗(Anti His抗体)和二抗(羊抗小鼠),最后向PVDF膜加入HRP化学发光底物液,于发光检测仪检测蛋白表达。
2 结果与分析
2.1 CssHSP18.1基因的克隆
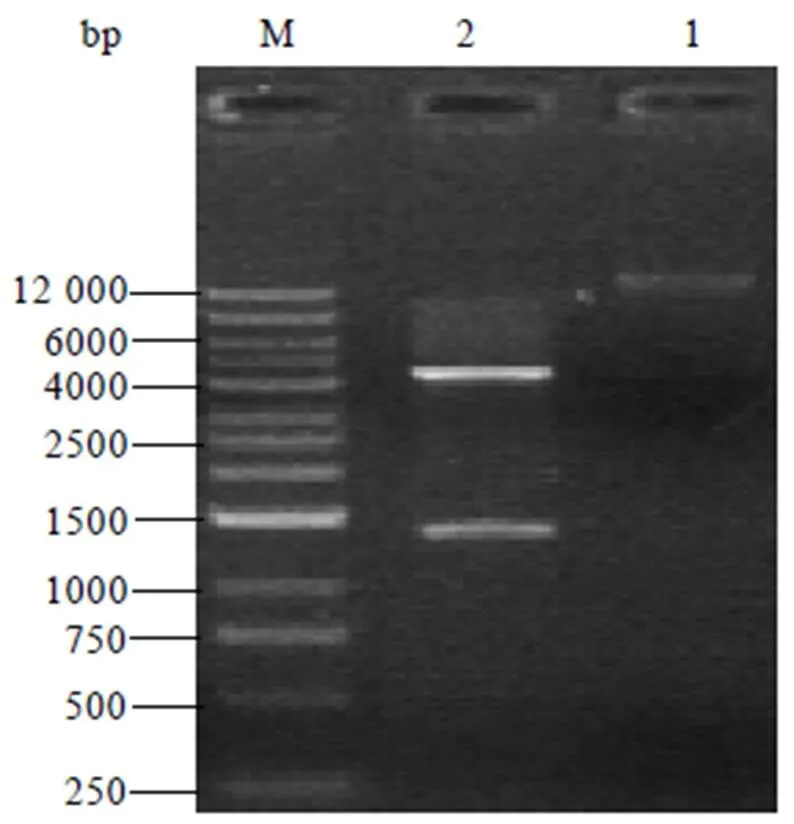
以茶树cDNA为模板,用CssHSP18.1-F/CssHSP18.1-R引物进行扩增,得到480 bp大小的目的基因(图1)。
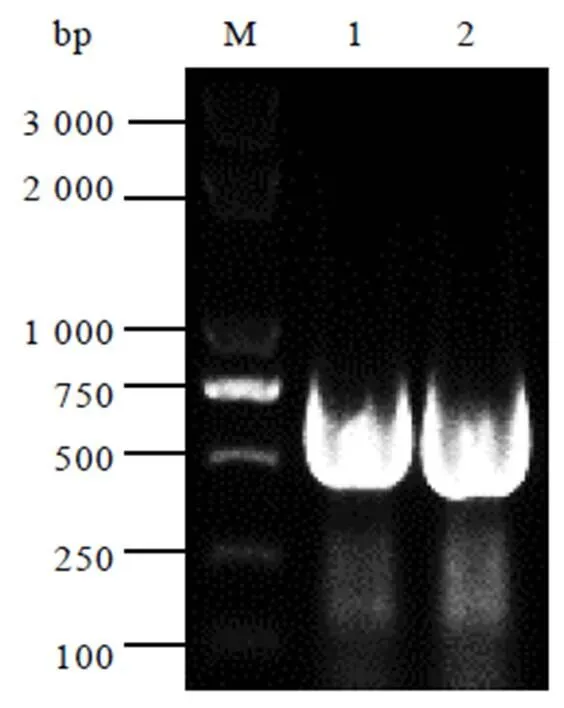
注:M:marker,1和2:CssHSP18.1
2.2 生物信息学分析
2.2.1 CssHSP18.1蛋白的理化性质与序列分析
由Prot-param对CssHSP18.1蛋白的理化性质进行分析,结果显示,CssHSP18.1蛋白相对分子质量为18.2 kDa,等电点为5.68,氨基酸总数159个,其中谷氨酸(Glu)含量最多,达到13.8%,不含半胱氨酸(Cys)和酪氨酸(Tyr)。负电荷残基29个,正电荷残基25个,脂溶指数为71.70,不稳定指数为62.21,具较强亲水性(表2)。
利用DNAMAN对已注释的茶树HSP20蛋白进行序列比对,结果显示,CssHSP18.1与CssHSP17.7相似度高达75.53%,其次为CssHSP17.5、CssHSP15和CssHSP21.8,相似度均低于60%(图2-A)。对不同物种间HSP20进行序列比对以及同源性分析,结果表明,不同物种间的HSP20蛋白氨基酸序列都存在1个保守的HSP20结构域,与栎()QssHSP18.1和苹果()MdsHSP18.1相似度最高,达81.25%;与西瓜()ClsHSP18.1、猕猴桃()AcsHSP18.1等相似度达到70%以上(图2-B,图3),说明HSP18.1在植物中保守性较高。
2.2.2 CssHSP18.1蛋白功能及亲水性分析
采用PFP预测CssHSP18.1蛋白功能(表3,仅列出评分高于1 300的预测结果),结果表明其可能参与植物应对胁迫反应。基于ProtScale对CssHSP18.1蛋白亲水性进行预测,结果显示其亲水性上下限分别为1.622和–3.667,亲水范围较大,与Prot-param预测的结果一致,该蛋白表现出较强亲水性。

表2 CssHSP18.1蛋白的基本理化性质

注:A:CsHSP18.1蛋白与茶树其他HSP20蛋白比对分析;B:CsHSP18.1蛋白与其他植物同源蛋白比对分析。紫框内为HSP20结构域;Cs:茶树;Qs:栎;Md:苹果;Py:日本樱花;Pa:甜樱桃;Cl:西瓜;Ac:猕猴桃
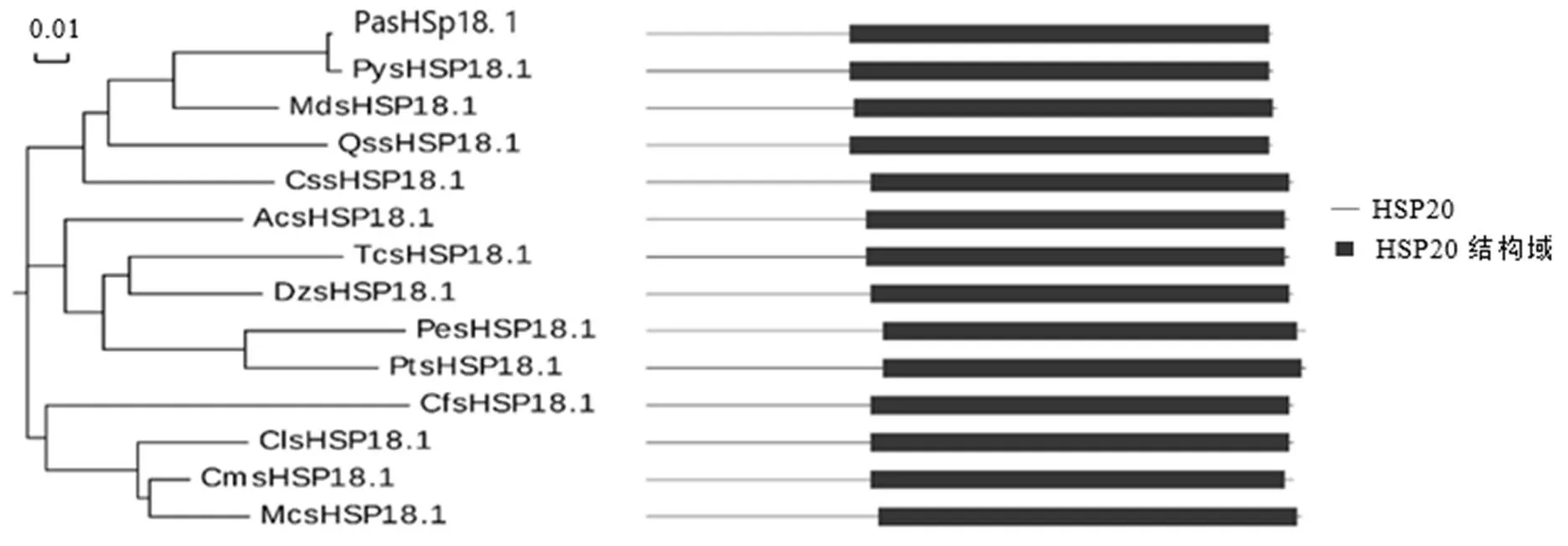
注:Pa:甜樱桃;Py:日本樱花;Md:苹果;Qs:栎;Cs:茶树;Ac:猕猴桃;Tc:可可豆;Dz:榴莲;Pe:胡杨;Pt:毛果杨;Cf:土瓶草;Cl:西瓜;Cm:甜瓜;Mc:苦瓜
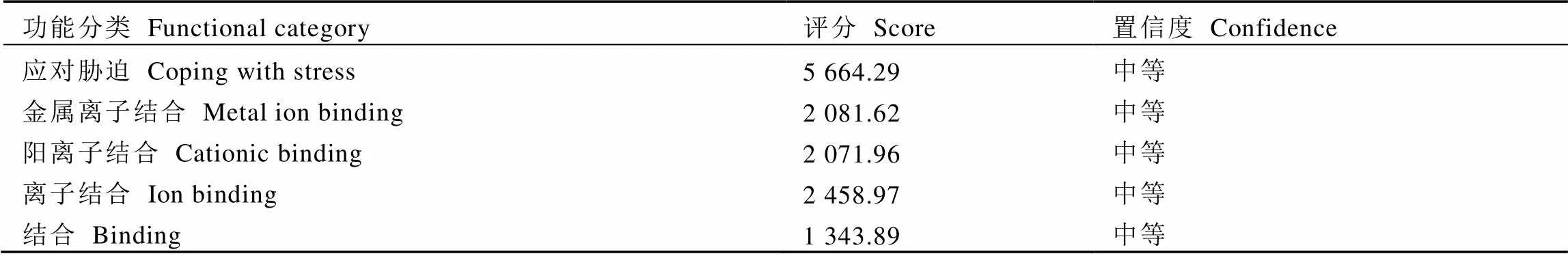
表3 CssHSP18.1基因编码蛋白功能预测
2.2.3 CssHSP18.1蛋白亚细胞定位与跨膜结构分析
用ProtComp 9.0软件对CssHSP18.1蛋白的亚细胞定位进行预测,结果表明,该蛋白主要定位于细胞质(表4),说明其编码的蛋白可能在植物细胞核外发挥作用。TMHMM分析表明,CssHSP18.1蛋白无跨膜区。
2.3 CssHSP18.1基因表达分析
为研究基因对胁迫的响应,利用实时荧光定量PCR(RT-qPCR)分析茶树经-甘露醇(-Mannitol)、-氨基丁酸(GABA)、吲哚乙酸(IAA)以及聚乙二醇(PEG 6000)处理后的表达模式,发现基因的相对表达量随处理时间不同而发生变化(图4)。结果显示,在-Mannitol处理后,的表达受到抑制,在0.5 h时表达量较低,随后逐渐上调,9 h时表达量再次下调(图4-A);经GABA处理在1 h时,表达量达到峰值,是对照组的3.1倍,随后逐渐下调,但均高于对照,说明GABA对该基因具有诱导作用(图4-B);经IAA处理,基因表达呈先升后降趋势,在0.5 h时表达量最高,6 h时表达量较低(图4-C);PEG 6000处理,基因表达量在0.5 h即达到峰值,之后下降,在3 h时再次上调,之后维持在相同水平(图4-D)。

表4 CssHSP18.1蛋白亚细胞定位预测
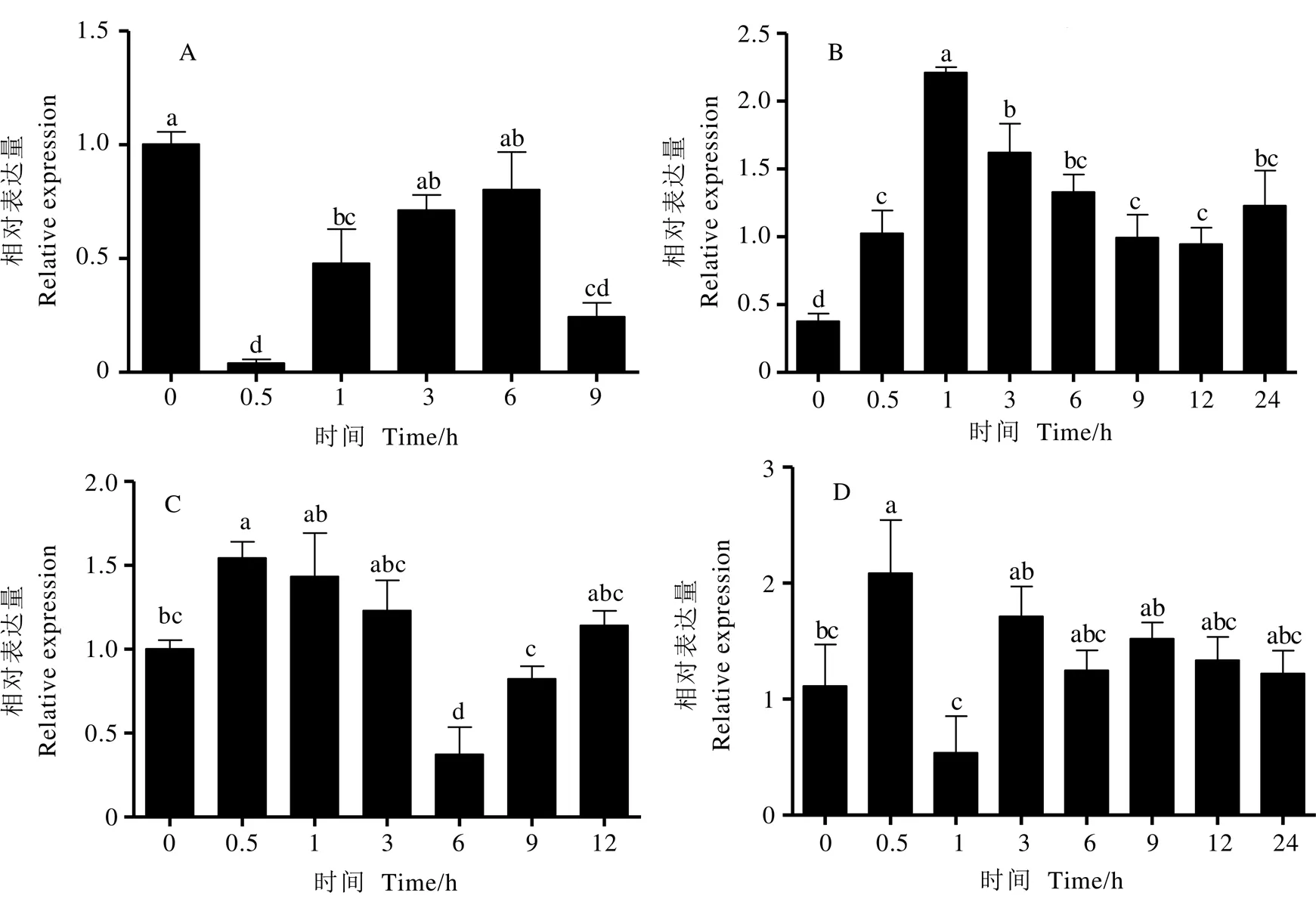
注:A:D-甘露醇处理;B:γ-氨基丁酸处理;C:吲哚乙酸处理;D:PEG 6000处理;内参基因:CsPTB;a,b,c表示各个处理之间方差分析差异显著性(P<0.05)
2.4 CssHSP18.1蛋白原核表达分析
2.4.1 构建pET-28a-CssHSP18.1原核表达载体
PCR扩增的片段与载体pET-28a分别经和双酶切,DNA连接酶连接构建重组载体。构建好的重组载体经过/双酶切处理后,可得到1条约1.4 kb的条带,表明基因与pET-28a载体连接成功(图5)。
2.4.2 CssHSP18.1蛋白表达最佳菌株的筛选
将2.4.1章节所获的重组载体分别转化到JM109(DE3)、BL21(DE3)、BL21(DE3)pLys、Tuner(DE3)等菌株,获得对应重组表达菌株。用15% SDS-PAGE检测CssHSP18.1蛋白可溶性表达。结果显示,CssHSP18.1蛋白在JM109(DE3)和Tuner(DE3)菌株中不表达(图6,泳道1,2),而在BL21(DE3)和BL21(DE3)PLys重组菌株的上清液中均有1条大约20 kDa的条带(图6,泳道3,4),且在BL21(DE3)菌株中的条带亮度比BL21(DE3)PLys高,表明CssHSP18.1蛋白的最佳原核可溶性表达菌株为BL21(DE3)。
2.4.3 CssHSP18.1最佳诱导温度的筛选
取2.4.2章节中筛选所得最佳表达菌株BL21(DE3),分别在16℃、20℃、25℃、30℃和37℃温度下进行CssHSP18.1蛋白诱导表达试验,用1 mmol·L-1IPTG进行诱导,表达结果用15% SDS-PAGE检测。结果显示,CssHSP18.1蛋白在这些温度诱导下均能表达,且出现明显单一的目的蛋白条带(图7)。随着温度的逐渐升高,CssHSP18.1蛋白表达逐渐增加,在30℃时,蛋白条带最亮,表达最佳。因此,选择30℃用于后续试验(图7,泳道2)。
注:泳道1:质粒DNA;泳道2:经Mlu I和Xho I消化后的重组表达质粒;泳道M:DNA marker
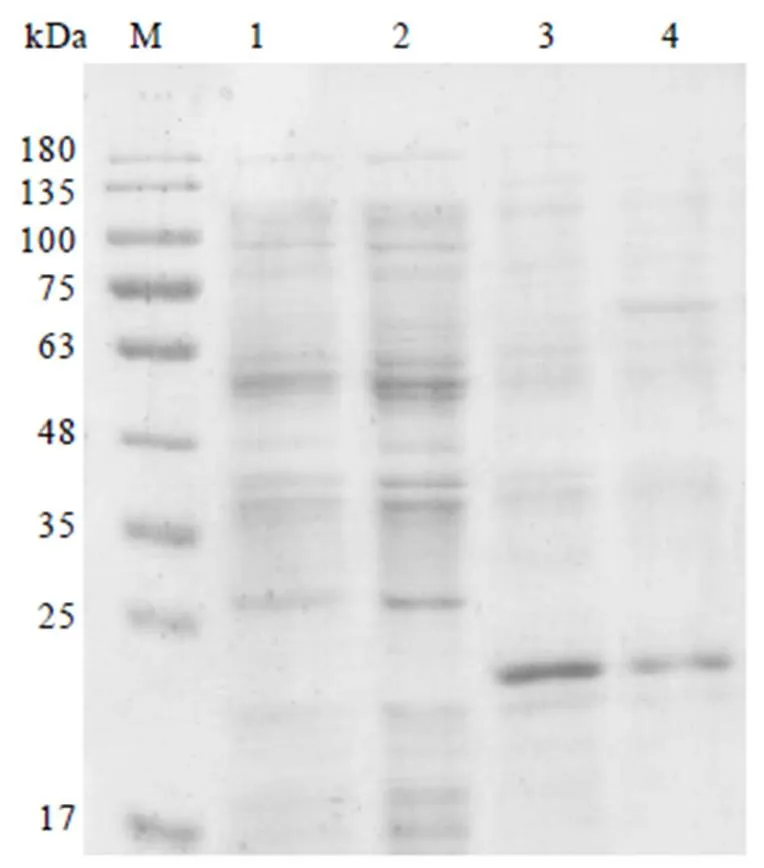
注:M:蛋白marker;1—4分别为JM109(DE3)、Tuner(DE3)、BL21(DE3)、BL21(DE3)PLys菌株裂解上清液
2.4.4 CssHSP18.1最佳诱导IPTG浓度的筛选
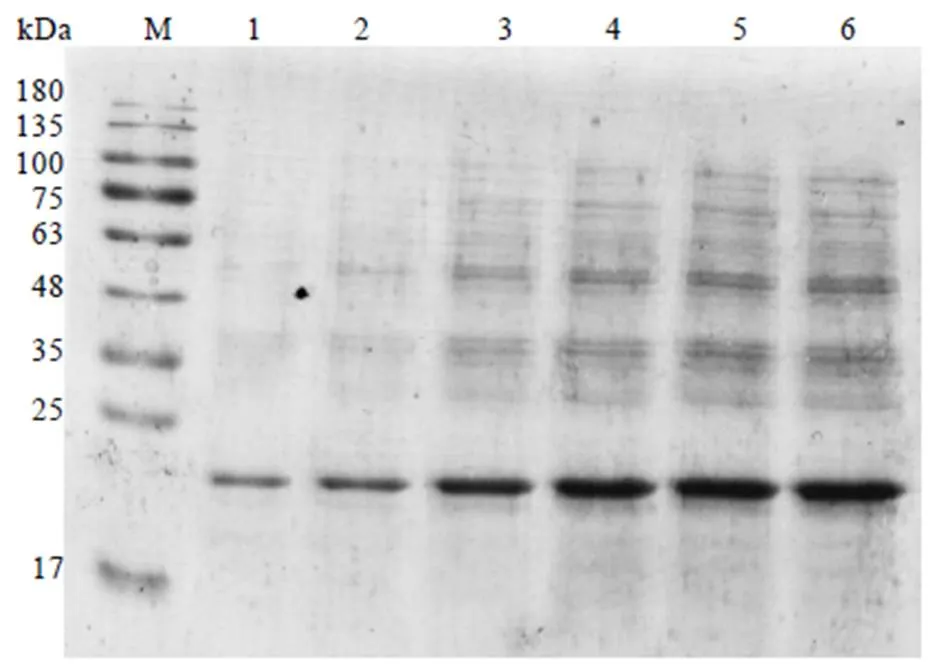
取BL21(DE3)重组菌株,更改诱导IPTG浓度为0.2、0.4、0.6、0.8、1.0、1.2 mmol·L-1,经30℃诱导表达8 h后,用15% SDS-PAGE检测表达结果。从图8可知,随着IPTG浓度的升高,CssHSP18.1蛋白表达量逐渐增加,其中在IPTG浓度为1.2 mmol·L-1时表达量最高(图8,泳道6),说明此浓度为最佳诱导浓度。
2.4.5 CssHSP18.1蛋白Western blot检测
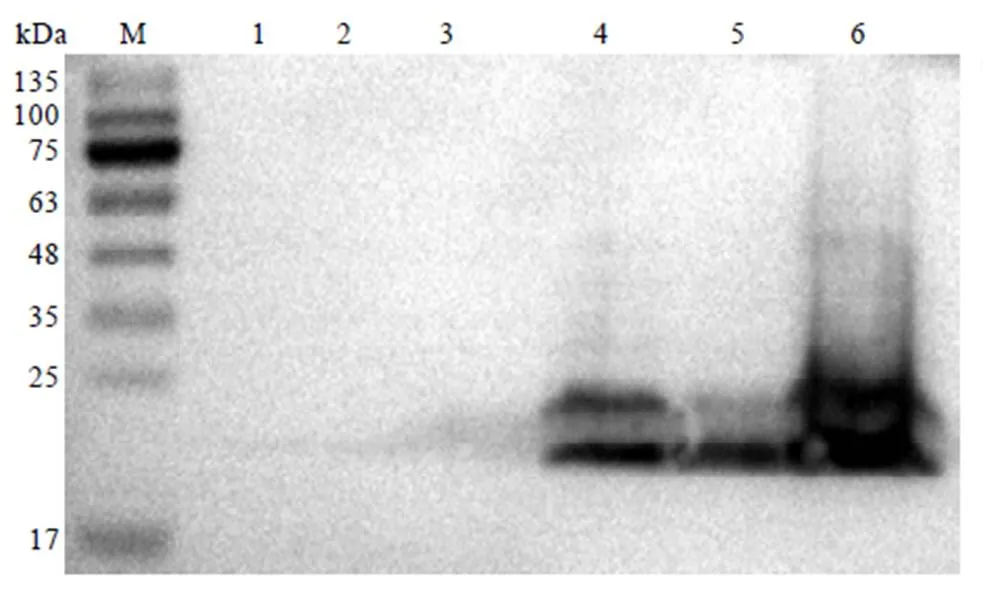
为进一步验证表达的重组蛋白是否为CssHSP18.1,使用Anti His抗体对表达的蛋白进行免疫印迹(Western blot)检测。结果显示,BL21(DE3)重组菌株在30℃、1.2 mmol∙L-1IPTG诱导下,在细胞裂解液的上清液和沉淀中均能检测到CssHSP18.1蛋白(图9,泳道5—6)。当不加IPTG诱导剂时,只在细胞裂解液的沉淀中检测到CssHSP18.1(图9,泳道4),在其上清液中未检测到CssHSP18.1(图9,泳道3)。阴性对照pET-28a中未发现表达条带(图9,泳道1—2)。
3 讨论
研究报道,HSP蛋白在植物中起着响应逆境胁迫的作用,并作为分子伴侣辅助其他蛋白正确合成与加工,同时对生物体正常机能的维护有重大意义[30]。HSP家族庞大且功能多样,几乎分布于所有生物体,近年来对HSP70家族的研究已成为热点[31]。
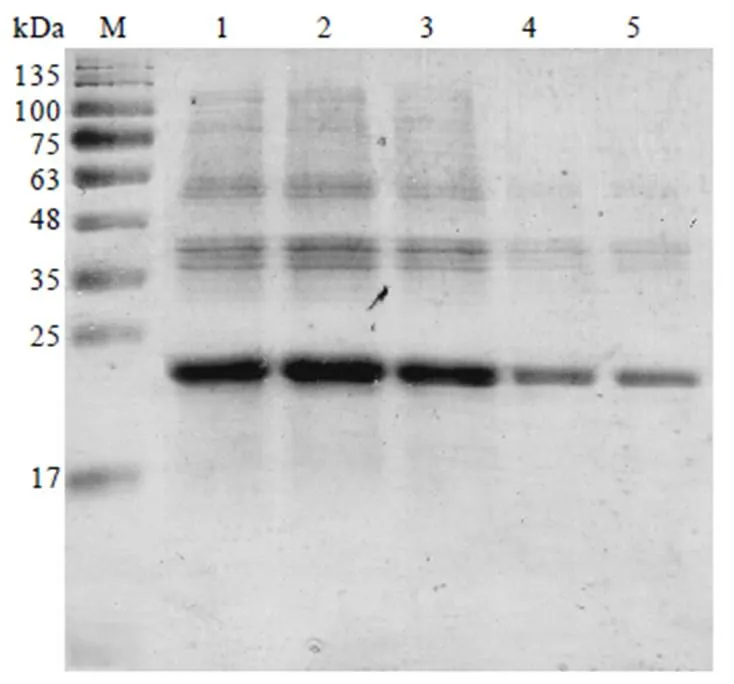
注:M:蛋白marker;1—5分别为CssHSP18.1在37℃、30℃、25℃、20℃、16℃诱导表达的细胞上清液
注:M:蛋白marker;1—6分别为CssHSP18.1在0.2、0.4、0.6、0.8、1.0 mmol·L-1和1.2 mol·L-1 IPTG诱导表达的细胞上清液
注:M:蛋白mark;1:空载体诱导表达的细胞上清液;2:空载体诱导表达的细胞沉淀;3:0 mol·L-1 IPTG诱导表达的细胞上清液;4:0 mol·L-1 IPTG诱导表达的细胞沉淀;5:1.2 mol·L-1 IPTG诱导表达的细胞上清液;6:1.2 mol·L-1 IPTG诱导表达的细胞沉淀
基因作为一类小家族成员,在植物处于非生物胁迫时,小分子热激蛋白表达会上调,以增强植物的抗逆性。例如,基因的表达提高了拟南芥种子萌发活力[32];月季基因可减轻高盐或旱害条件对烟草的影响[33];Pla等[34]报道基因能够增强栎的抗氧化作用;小麦处于高盐或干旱危害下sHSPs蛋白表达量会上调10倍以上[35];小麦能够调控种子成熟与萌发,并有助于提高其耐热性[36]。在生物胁迫方面,基因参与白叶枯病病原与水稻的互作[37],对植物病原侵染过程有识别和辅助的作用[38];小麦sHSP23.6蛋白可与小麦黄化花叶病毒CP蛋白互作[39]。
目前对茶树的研究主要集中在对非生物胁迫的抗性作用方面。王明乐等[40]发现基因与茶树抗热、高盐及外源脱落酸有关;陈江飞等[27]发现茶树小分子热激蛋白CsHSP17.5在热胁迫下明显增加;在拟南芥异源表达茶树3个基因可明显提高其耐热性[27]。据报道,茶树基因经过PEG 6000干旱处理后,在0.5 h时表达量最高,与本研究的基因表达结果相似[41];在干旱处理下,茶树、、和基因与本研究的基因的表达量均呈先升后降的趋势[27];侧柏和基因参与其对干旱胁迫的响应和修复[42]。因此,推测基因也可能参与了茶树对干旱胁迫的响应和修复。
蛋白表达研究通常采用原核和真核表达系统,而大肠杆菌原核表达系统作为外源蛋白表达的主要工具,具有表达量大、背景低、繁殖快等特点[43-44],但是在蛋白诱导表达过程中,细菌表达菌株、诱导温度和诱导剂IPTG浓度均能对表达结果产生影响[45]。为获得CssHSP18.1蛋白的最佳表达条件,本研究对CssHSP18.1蛋白的可溶性表达条件进行研究,最终获得相对分子质量约为20 kDa的可溶性蛋白,这与理论值18.25 kDa非常接近。前人对麻疯树、蜡梅及巴西橡胶树等进行sHSPs蛋白的原核表达探索[46-48],重组表达菌株均为BL21(DE3),这与本研究茶树基因的最佳表达菌株相同。
本研究从福鼎大白茶中克隆1个基因的ORF,并对其进行基本理化性质、亲缘关系、保守结构域、亚细胞定位等生物信息学分析。RT-qPCR分析表明,基因表达受到GABA、IAA以及PEG 6000诱导,而D-Mannitol则抑制基因表达。CssHSP18.1蛋白在BL21(DE3)菌株、30℃和1.2 mmol·L-1IPTG诱导浓度下蛋白可溶性表达最佳。本研究结果将对基因生物学功能及结构解析提供参考。但基因在真核的表达及蛋白互作等方面仍需进一步研究。
[1] 蒋会兵, 夏丽飞, 田易萍, 等. 基于转录组测序的紫芽茶树花青素合成相关基因分析[J]. 植物遗传资源学报, 2018, 19(5): 967-978.Jiang H B, Xia L F, Tian Y P, et al. Transcriptome analysis of anthocyanin synthesis related genes in purple bud tea plant [J]. Journal of Plant Genetic Resources, 2018, 19(5): 967-978.
[2] Yue C, Cao H L, Lin H Z, et al. Expression patterns of alpha-amylase and beta-amylase genes provide insights into the molecular mechanisms underlying the responses of tea plants () to stress and postharvest processing treatments [J]. Planta, 2019, 250(1): 281-298.
[3] 贾焱, 孙英杰, 何聪芬, 等. 分子内分子伴侣机制的研究进展[J]. 生物化学与生物物理进展, 2016, 43(5): 443-448.Jia Y, Sun Y J, He C F, et al. Research progress on the mechanism of intramolecular chaperone [J]. Progress in Biochemistry and Biophysics, 2016, 43(5): 443-448.
[4] 陈建南. 分子伴侣参与调控动、植物的发育和进化进程[J]. 遗传, 2010, 32(5): 443-447.Chen J N. Progress in molecular chaperones participating in regulations of plant and animal development and evolution [J]. Hereditas, 2010, 32(5): 443-447.
[5] 王佳丽. 辅助分子伴侣SlBAG蛋白在番茄抗病反应中的功能研究[D]. 杭州: 浙江大学, 2019. Wang J L. Functional analysis of the auxiliary molecular chaperone BAG proteins in disease resistance in tomato [D]. Hangzhou: Zhejiang University, 2019.
[6] 谷丰. 高温噬菌体TSP4分子伴侣CPN47对酶热稳定性的影响研究[D]. 昆明: 昆明理工大学, 2014. Gu F. Effect of chaperone CPN47 fromphage TSP4 on the thermal stability of enzyme [D]. Kunming: Kunming University of Science and Technology, 2014.
[7] 陈成, 董爱武, 苏伟. 拟南芥组蛋白分子伴侣AtHIRA参与体细胞同源重组及盐胁迫响应[J]. 植物学报, 2018, 53(1): 42-50. Chen C, Dong A W, Su W. Histone chaperone AtHIRA is involved in somatic homologous recombination and salinity response in[J]. Chinese Bulletin of Botany, 2018, 53(1): 42-50.
[8] 万丽丽, 王转茸, 辛强, 等.分子伴侣结合蛋白超表达能够提高甘蓝型油菜耐旱性[J]. 作物学报, 2018, 44(4): 483-492. Wan L L, Wang Z R, Xin Q, et al. Enhanced accumulation ofmolecular chaperone binding protein improves tolerance to drought stress in transgenic[J]. Acta Agronomica Sinica, 2018, 44(4): 483-492.
[9] 张美惠. 高温胁迫下小麦白粉病菌基因表达研究及HIGS体系的建立[D]. 北京: 中国农业科学院, 2019. Zhang M H.genes experssion level off. sp.under heat stress and host-induced gene silencing (HIGS) system establishment [D]. Beijing: Chinese Academy of Agricultural Sciences, 2019.
[10] 李广隆, 刘思言, 鲁中爽, 等. 植物热激蛋白响应非生物胁迫研究进展[J]. 广东农业科学, 2019, 46(3): 24-30. Li G L, Liu S Y, Lu Z S, et al. Research progress of plant heat shock protein response to abiotic stress [J]. Guangdong Agricultural Sciences, 2019, 46(3): 24-30.
[11] Zhang K M, Ezemaduka A N. Wang Z, et al. A novel mechanism for small heat shock proteins to function as molecular chaperones [J]. Scientific Reports, 2015, 5: 8811. doi: 10.1038/srep08811.
[12] Khan A, Ali M, Khattak A M, et al. Heat shock proteins: Dynamic biomolecules to counter plant biotic and abiotic stresses [J]. International Journal of Molecular Sciences, 2019, 20(21): 5321. doi: 10.3390/ijms20215321.
[13] 栗振义, 龙瑞才, 张铁军, 等. 植物热激蛋白研究进展[J]. 生物技术通报, 2016, 32(2): 7-13. Li Z Y, Long R C, Zhang T J, et al. Research progress on plant heat shock protein [J]. Biotechnology Bulletin, 2016, 32(2): 7-13.
[14] 张宁, 姜晶. 植物中小分子热激蛋白基因家族()研究进展[J]. 植物生理学报, 2017, 53(6): 943-948. Zhang N, Jiang J. Research advances of small heat shock protein gene family () in plants [J]. Plant Physiology Journal, 2017, 53(6): 943-948.
[15] Lin Q, Xie Y J, Guan W Q, et al. Combined transcriptomic and proteomic analysis of cold stress induced sugar accumulation and heat shock proteins expression during postharvest potato tuber storage [J]. Food Chemistry, 2019, 297: 124991. doi: 10.1016/j.foodchem.2019.124991.
[16] Peffer S, Gonçalves D, Morano K. Regulation of the Hsf1-dependent transcriptome via conserved bipartite contacts with Hsp70 promotes survival in yeast [J]. Journal of Biological Chemistry, 2019, 294(32): 12191-12202.
[17] 张莉. 小热休克蛋白26(sHSP26)在高温胁迫下保护玉米叶绿体的作用机制[D]. 郑州: 河南农业大学, 2012. Zhang L. The mechanism of small heat shock 26 (sHSP26) protecting maize chloroplast from heat stress [D]. Zhengzhou: Henan Agricultural University, 2012.
[18] 陈新海. 高温胁迫下水稻热激蛋白的作用机理研究[D]. 福州: 福建农林大学, 2011. Chen X H. Studies on heat shock proteins (HSPs) of rice (L.) in response to heat stress [D]. Fuzhou: Fujian Agriculture and Forestry University, 2011.
[19] Wu D, Vonk J J, Salles F, et al. The N terminus of the small heat shock protein HSPB7 drives its polyQ aggregation-suppressing activity [J]. Journal of Biological Chemistry, 2019, 294(25): 9985-9994.
[20] 俞佳虹. 番茄小热激蛋白基因家族的全基因组鉴定及表达分析[D]. 金华: 浙江师范大学, 2017. Yu J H. Genome-wide identification and expression profiling of thegene family in tomato [D]. Jinhua: Zhejiang Normal University, 2017.
[21] 梁潘霞, 黄杏, 李杨瑞. 甘蔗小分子量热激蛋白(sHSP)基因克隆及水分胁迫下的表达分析[J]. 生物技术通报, 2016, 32(10): 163-169. Liang P X, Huang X, Li Y R. Cloning of small heat-shock protein (HSP) gene from sugarcane and analysis of its expression under drought stress [J]. Biotechnology Bulletin, 2016, 32(10): 163-169.
[22] 张帅扬. 马铃薯小分子热激蛋白基因表达载体构建及胁迫诱导表达特性分析[D]. 长沙: 湖南农业大学, 2017. Zhang S Y. Construction of a plant experessing vector of small heat shock protein gene fromand stress-induced experssion analysis [D]. Changsha: Hunan Agricultural University, 2017.
[23] 孙宇栋. 核桃家族基因筛选、响应模式及基因的抗逆功能分析[D]. 杨凌: 西北农林科技大学, 2016. Sun Y D. Walnutfamily genetic screening, response pattern and resilience function analysis of gene[D]. Yangling: Northwest A&F University, 2016.
[24] 李静婷, 赵旭耀, 刘超凡, 等. 热胁迫对转拟南芥幼苗生长生理特性的影响[J]. 江苏农业科学, 2016, 44(10): 113-116. Li J T, Zhao X Y, Liu C F, et al. Effects of heat stress on growth physiology of transgenosisArabidopsis seedlings [J]. Jiangsu Agricultural Sciences, 2016, 44(10): 113-116.
[25] 刘珊珊. 西瓜中与CGMMV结构蛋白互作因子的筛选及sHSP功能分析[D]. 北京: 中国农业科学院, 2019. Liu S S. Identifying factors interacted with CGMMV sturctual proteins and functional analysis of sHSP in wastermelon [D]. Beijing: Chinese Academy of Agricultural Sciences, 2019.
[26] 潘佳佳. 百合小热激蛋白的克隆及初步分析[D]. 兰州: 兰州大学, 2010.Pan J J. The identification of lily small heat shock protein gene and its preliminary research [D]. Lanzhou: Lanzhou University, 2010.
[27] 陈江飞, 高童, 万思卿, 等. 茶树小分子热激蛋白基因、、和的克隆与表达分析[J]. 园艺学报, 2018, 45(6): 1160-1172.Chen J F, Gao T, Wan S Q, et al. Cloning and expression analysis of small heat shock protein genes,,andin[J]. Acta Horticulturae Sinica, 2018, 45(6): 1160-1172.
[28] Chen Y J, Yu P, Luo J C, et al. Secreted protein prediction system combining CJ-SPHMM, TMHMM, and PSORT [J]. Mammalian genome, 2003, 14(12): 859-865.
[29] Hao X Y, Horvath D P, Chao W S, et al. Identification and evaluation of reliable reference genes for quantitative Real-Time PCR analysis in tea plant ((L.) O. Kuntze) [J]. International Journal of Molecular Sciences, 2014, 15(12): 22155-22172.
[30] Chen X H, Lin S K, Liu Q L, et al. Expression and interaction of small heat shock proteins (sHsps) in rice in response to heat stress [J].Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2014, 1844(4): 818-828.
[31] Adão R, Zanphorlin L M, Lima T B, et al. Revealing the interaction mode of the highly flexibleHsp70/Hsp90 organizing protein (Hop): A conserved carboxylate clamp confers high affinity binding to Hsp90 [J]. Journal of Proteomics, 2019, 191: 191-201.
[32] Zhou Y L, Chen H H, Chu P, et al., a cytosolic class Ⅱ small heat shock protein gene from, contributes to seed germination vigor and seedling thermotolerance in transgenic[J]. Plant Cell Reports, 2012, 31(2): 379-389.
[33] 李敏, 蒋昌华, 胡永红, 等. 月季基因转化烟草的非生物胁迫耐性研究[J]. 园艺学报, 2009, 36(8): 1191-1196.Li M, Jiang C H, Hu Y H, et al. Transformation of tobacco withfrom Chinese rose enhances tolerance to different abiotic stresses [J]. Acta Horticulturae Sinica, 2009, 36(8): 1191-1196.
[34] Pla M, Huguet G, Verdaguer D, et al. Stress proteins co-expressed in suberized and lignified cells and in apical meristems [J]. Plant Science, 1998, 139(1): 49-57.
[35] Kumar R R, Goswami S, Shamim M, et al. Exploring the heat-responsive chaperones and microsatellite markers associated with terminal heat stress tolerance in developing wheat [J]. Functional & Integrative Genomics, 2017, 17(6): 621-640.
[36] Chauhan H, Khurana N, Nijhavan A, et al. The wheat chloroplastic small heat shock protein (sHSP26) is involved in seed maturation and germination and imparts tolerance to heat stress [J]. Plant, Cell & Environment, 2012, 35(11): 1912-1931.
[37] 左丽萍, 张瑞华, 金桂秀, 等.调控水稻对白叶枯病的抗性[J]. 植物病理学报, 2019, 49(1): 90-100. Zuo L P, Zhang R H, Jin G X, et al.regulates disease resistance to bacterial blight in rice [J]. Acta Phytopathologica Sinica, 2019, 49(1): 90-100.
[38] Mota T M, Oshiquiri L H, Lopes É C V, et al. Hsp genes are differentially expressed duringself-recognition, mycoparasitism and thermal stress [J]. Microbiological Research, 2019(227): 126296. doi: 10.1016/j.micres.2019.126296.
[39] Jiang S S, Wu B, Jiang L L, et al.heat shock protein 23.6 interacts with the coat protein of wheat yellow mosaic virus [J]. Virus Genes, 2019, 55(2): 209-217.
[40] 王明乐, 朱旭君, 王伟东, 等. 茶树小分子量热激蛋白基因的克隆与表达分析[J]. 南京农业大学学报, 2015, 38(3): 389-394. Wang M L, Zhu X J, Wang W D, et al. Molecular cloning and expression analysis of low molecular weight heat shock protein genefrom[J]. Journal of Nanjing Agricultural University, 2015, 38(3): 389-394.
[41] Wang M L, Zou Z W, Li Q H, et al. Heterologous expression of threesmall heat shock protein genes confers temperature stress tolerance in yeast and[J]. Plant Cell Reports, 2017, 36(7): 1125-1135.
[42] 张胜. 侧柏对干旱与自然低温胁迫响应的分子机制研究[D]. 杨凌: 西北农林科技大学, 2017. Zhang S. Studies on mechanisms of molecular response to drought and natural low temperature stress in(L.) [D]. Yangling: Northwest A&F University, 2017.
[43] Ding G B, Wu G F, Li B C, et al. High-yield expression in, biophysical characterization, and biological evaluation of plant toxin gelonin [J]. 3 Biotech, 2019, 9: 19. doi: 10.1007/s13205-018-1559-6.
[44] Sørensen H P, Mortensen K K. Advanced genetic strategies for recombinant protein expression in[J]. Journal of Biotechnology, 2005, 115(2): 113-128.
[45] Rosano G L, Ceccarelli E A. Recombinant protein expression in: advances and challenges [J]. Frontiers in Microbiology, 2014, 5: 172. doi: 10.3389/fmicb.2014.00172.
[46] 樊佳, 王毅, 徐莺, 等. 麻疯树小热激蛋白基因的原核表达及耐热胁迫[J]. 应用与环境生物学报, 2013, 19(1): 74-78. Fan J, Wang Y, Xu Y, et al. Expression, purification and heat stress tolerance ofL.gene in prokaryotic cells [J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(1): 74-78.
[47] 胡雨晴. 蜡梅热激蛋白基因的分子特征、原核表达及其转录的实时荧光定量分析[D]. 重庆: 西南大学, 2011. Hu Y Q. Molecular characteristics, prokaryotic expression and transcriptional expression analysis of a heat shock protein genefrom[D]. Chongqing: Southwest University, 2011.
[48] 郭会娜. 巴西橡胶树小热激蛋白基因克隆、表达及功能研究[D]. 海口: 海南大学, 2014. Guo H N. Cloning, expression and functional characterizations of small heat shock protein genes from[D]. Haikou: Hainan University, 2014.
Cloning and Expression Analysis ofGene in
JIANG Junmei1, FANG Yuanpeng1, NING Na1, CHEN Meiqing1, YANG Zaifu1, WANG Yong1, LI Xiangyang2*, XIE Xin1*
1. Agricultural College of Guizhou University, Guiyang 550025, China; 2. State Key Laboratory Breeding Base of Green Pesticide and Agricultural Bioengineering, Key Laboratory of Green Pesticide and Agricultural Bioengineering, Ministry of Education, Research and Development Center for Fine Chemicals, Guizhou University, Guiyang 550025, China
Thegene family encodes a class of small molecular heat shock proteins, which are widely distributed in plants, functioned as molecular chaperones, and play an important role in plant resistance to stresses. In this study, the open reading frame (ORF) ofgene cDNA was obtained by gene cloning, which is 480 bp in length and encodes 159 amino acids. Bioinformatics analysis showed that CssHSP18.1 protein contained a typical HSP20 domain. Its molecular weight and isoelectric point are about 18.25 kDa and 5.68 respectively. Phylogenetic tree analysis showed that CssHSP18.1 has the closest relationship with quercus and apple. It was predicted that CssHSP18.1 protein was does not have signal peptide and transmembrane structure. RT-qPCR analysis showed that the expression ofunder D-Mannitol treatment was lower than that in the control group. GABA could enhance the expression ofwith its peak at 1 h after GABA treatment. The expression ofwas upregulated upon IAA and PEG 6000 treatments, and reached the peaks at 0.5 h. Thus, GABA、IAA、PEG 6000 could induce the expression of. To obtain CssHSP18.1 soluble protein, a recombinant plasmid pET-28a-CssHSP18.1 was constructed and expressed in prokaryotic system. The expression strains, induction temperatures and induction concentrations of IPTG (isopropyl---thiopyranogalactoside) were optimized. The results showed that the best expression strain of CssHSP18.1 protein was BL21 (DE3), and the best induction temperature and IPTG concentration were 30℃and 1.2 mmol·L-1respectively. Finally, western blot was used to verify the expression of CssHSP18.1 protein. This study provided a basis for further study on the biological function ofgene.
,, gene cloning, bioinformatics analysis, stress, expression analysis
S571.1;Q52
A
1000-369X(2020)03-328-13
2019-08-30
2020-01-07
贵州省高层次留学人才创新创业择优资助项目([2018]02号)、贵州省科技计划项目(黔科合支撑[2019]2408号)、贵州省科技计划项目(黔科合平台人才[2018]5781号)
蒋君梅,女,主要从事茶树抗病基因功能方面的研究,jjmguangan@163.com。*通信作者:xyli1@gzu.edu.cn;xiexin2097757@163.com
投稿平台:http://cykk.cbpt.cnki.net

