白茶萎凋过程萜烯类合成相关基因的鉴定和表达分析
陈雪津,王鹏杰,林馨颖,谷梦雅,郑玉成,郑知临,叶乃兴
白茶萎凋过程萜烯类合成相关基因的鉴定和表达分析
陈雪津,王鹏杰,林馨颖,谷梦雅,郑玉成,郑知临,叶乃兴*
福建农林大学园艺学院/茶学福建省高校重点实验室,福建 福州 350002
萜烯类化合物是植物中重要的次生代谢产物之一,对茶树挥发性香气的组成起着重要作用。从茶树基因组数据库中鉴定获得了141个茶树萜烯类合成相关基因,并对其不同组织表达特异性进行分析,筛选出16个在茶树顶芽和嫩叶中高表达的萜烯类合成代表基因。生物信息学分析结果表明,系统进化关系将茶树与拟南芥和葡萄的萜烯类合成相关基因分成了4个亚家族;茶树萜烯类合成相关基因含有5~14个外显子,在上游启动子区域分析发现了大量与光响应、植物生长发育、激素和胁迫响应密切相关的顺式作用元件。荧光定量检测发现,、和在白茶萎凋过程中的表达显著上调;在萎凋4 h和24 h的表达达到峰值。本研究结果为进一步挖掘茶叶萎凋过程中萜烯类合成相关基因对茶叶香气组分积累提供了理论依据。
白茶;香气;萜烯类;表达分析
茶叶是世界三大无酒精饮料之一,随着健康生活理念的传播,近年来具有诸多保健功能的茶叶产品在国内外市场广受欢迎。白茶是一类微发酵茶,经过的加工工序在各大茶类中最少。白茶的加工工序包括了长时间的萎凋和干燥过程[1]。萎凋是采后茶叶自然缓慢脱水的过程。茶叶的风味化合物(如儿茶素、脂肪酸、挥发性香气成分和游离氨基酸等)在萎凋过程中发生生理生化改变,维持生理代谢平衡,以抵御脱水胁迫[2-3]。尽管茶叶的挥发性香气成分含量非常有限(总干重的0.01%),但它们对茶叶风味有极大影响[4]。在挥发性香气中,萜烯类化合物香味活性高、阈值低,赋予白茶高品质的花香。
萜烯类生物合成从一个异戊二烯(Isoprene,C5)结构单位开始[5],根据其结构单位数量的不同,可分为单萜(Monoterpene,C10)、倍半萜(Sesquiterpene,C15)和二萜(Diterpene,C20)等。萜烯类生物合成途径有两条,分别是在细胞质进行的甲羟戊酸(Mevalonate,MVA)途径和在质体进行的2--甲基--赤藓糖醇-4-磷酸(2--methyl-- erythritol-4-phosphat,MEP)途径。MVA途径由两分子乙酰CoA(Acetoacetyl-CoA)在硫解酶的催化下合成乙酰乙酰CoA,经过一系列酶促反应后,最终产生异戊烯基焦磷酸(Isopentyl diphosphate,IPP)及其异构体二甲烯丙基焦磷酸(Dimethylallyl diphosphate,DMAPP)。异戊二烯结构单位在IPP和DMAPP相应基因作用下合成香叶基焦磷酸(Geranyl diphosphate,GPP)、法尼基焦磷酸(Farnesyl pyrophosphate,FPP)和焦磷酸双叶酯(Geranylgeranyl pyrophosphate,GGPP)[6]。
挥发性萜烯类物质以糖苷态储存于茶树芽叶中,作为其香气前体物质[7]。在糖苷水解酶作用下,水解糖苷态香气成分,释放香气化合物,控制萜烯类化合物转化形成挥发性萜烯类物质[8]。鉴于挥发性萜烯类物质合成相关基因在茶叶加工过程的重要作用,目前调控挥发性萜烯类物质合成途径的相关基因已被鉴定并开展研究。本课题组前期通过克隆和表达分析发现,二磷酸甲羟戊酸脱羧酶()[9]、牻牛儿基牻牛儿基焦磷酸合成酶()[10]和萜类合成酶()[11]随着萎凋时间的延长,表达量显著提升。在茶叶萎凋过程中可产生特征性香气物质。Hu等[12]通过转录组分析发现,在乌龙茶萎凋过程中,萜烯类合成相关基因诱导单萜与倍半萜等挥发性香气物质积累。Chen等[2]的研究显示,白茶萎凋中萜烯类合成酶相关基因表达量上调,催化底物生成单萜化合物,可能作用于白茶的“毫香”特征。Zheng等[13]研究表明,、和基因对茶树挥发性杂种优势具有重要的作用。从上述研究结果可以看出,萜烯类合成相关基因在挥发性香气形成中具有重要的功能。
本研究以福鼎大白茶为供试材料,从茶树基因组中鉴定获得的141个萜烯类合成相关基因,根据其不同组织表达特异性分析,进一步筛选出16个在茶树顶芽和嫩叶中高表达的萜烯类合成代表基因。通过生物信息学和实时荧光定量PCR技术分析这些代表基因的生物信息学特征和在白茶萎凋过程中的动态表达谱,为研究萜烯类合成相关基因在茶叶萎凋过程香气形成的作用提供理论参考。
1 材料与方法
1.1 试验材料与处理
以福鼎大白茶(var.)春梢一芽二叶为原料,于2019年4月从福建农林大学南区教学茶园采集。白茶萎凋试验处理参照陈静等[14]的方法:室内自然萎凋温度22~25℃,空气相对湿度70%~75%。分别收集0.100 g的鲜叶(萎凋处理0 h)和萎凋处理4、8、16、24、32、40、48 h的叶片,共有8个样品,设置3次生物学重复,经液氮速冻后置–80℃超低温冰箱保存备用。
1.2 茶树萜烯类合成相关基因的鉴定
为了获得茶树萜烯类合成相关基因的序列信息,在茶树基因组数据库(http: //tpia.teaplant.org/index.html)中下载[15]。从TAIR数据库(www.arabidopsis.org)获取拟南芥参与萜烯类生物合成途径的基因序列,并进行BLAST-P搜索,阈值为E-value<10-5。
1.3 茶树萜烯类合成相关基因组织特异性表达分析与筛选
为明确茶树萜烯类合成酶在不同组织特异性表达谱,采用王鹏杰等[16]方法从NCBI SRA(www.ncbi.nlm.nih.gov/sra)下载茶树不同组织的转录组数据,包括根、茎、顶芽、嫩叶、成熟叶、老叶、花和果(SRP056466)。使用TopHat2软件将转录组可读数映射到茶树基因组[17],再通过HTseq软件计算FPKM值(Fragments per kb per million reads)以量化基因表达水平[18]。利用TBtools软件对已注释的萜烯类合成相关基因FPKM值归一化,并进行层次聚类分析。
1.4 茶树萜烯类合成相关基因的生物信息学分析
以|log2 Ratio|≥1为标准筛选出茶树顶芽和嫩叶的萜烯类合成相关代表基因。筛选获得的茶树萜烯类合成相关的差异表达基因利用在线网站ExPASy工具(https://web.expasy.org/protparam)进行蛋白的氨基酸组成、等电点、疏水性等理化性质分析;利用在线网站WoLF PAORT(https://wolfpsort.hgc.jp)进行亚细胞定位预测。
1.5 茶树萜烯类合成相关基因的系统进化和基因结构分析
将筛选出的茶树萜烯类合成相关基因通过在NCBI网站进行BLAST-P搜索获得拟南芥和葡萄萜烯类合成相关基因蛋白质序列。利用ClustalW默认设置对氨基酸进行多序列比对,采用软件MEGA 7.0的邻接法(Neighbor-joining)构建系统进化树,Boostrap值设置为1 000;利用在线软件GSDS2.0(http://gsds.cbi.pku.edu.cn/index.php)分析茶树萜烯类合成相关基因的结构信息。
1.6 茶树萜烯类合成相关基因启动子顺式作用元件预测分析
在茶树基因组网站(http://tpia.teaplant.org/ index.html)下载各成员基因转录起始位点上有2 000 bp的序列,使用在线网站Plant CARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html)进行顺式作用元件预测分析。
1.7 总RNA提取和实时荧光定量PCR
使用TIANGEN(天根)多糖多酚试剂盒提取茶树叶片中RNA,NanoDrop 2000超微量分光光度计检测提取出的RNA浓度和纯度并用1%凝胶电泳对RNA的质量进行检测,使用全式金Easyscript One-step gDNA Removal and cDNA synthesis superMix试剂盒合成cDNA用于qRT-PCR。
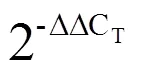
2 结果与分析
2.1 茶树萜烯类合成相关基因鉴定与组织特异性表达分析
通过使用拟南芥基因序列作为查询序列,在NCBI中通过BLASTn搜索,在茶树基因组中鉴定获得141个萜烯类生物合成相关基因,并按顺序重新命名。其中有39个基因属于萜烯类生物合成的MVA途径,102个基因属于萜烯类生物合成的MEP途径。这些基因分别来自17种不同基因家族的成员。
为了解茶树萜类合成相关基因在茶树的不同组织表达模式,利用茶树不同组织的基因组原始数据,将141个萜烯类合成相关基因进行不同组织的特异性表达模式分析(图1)。
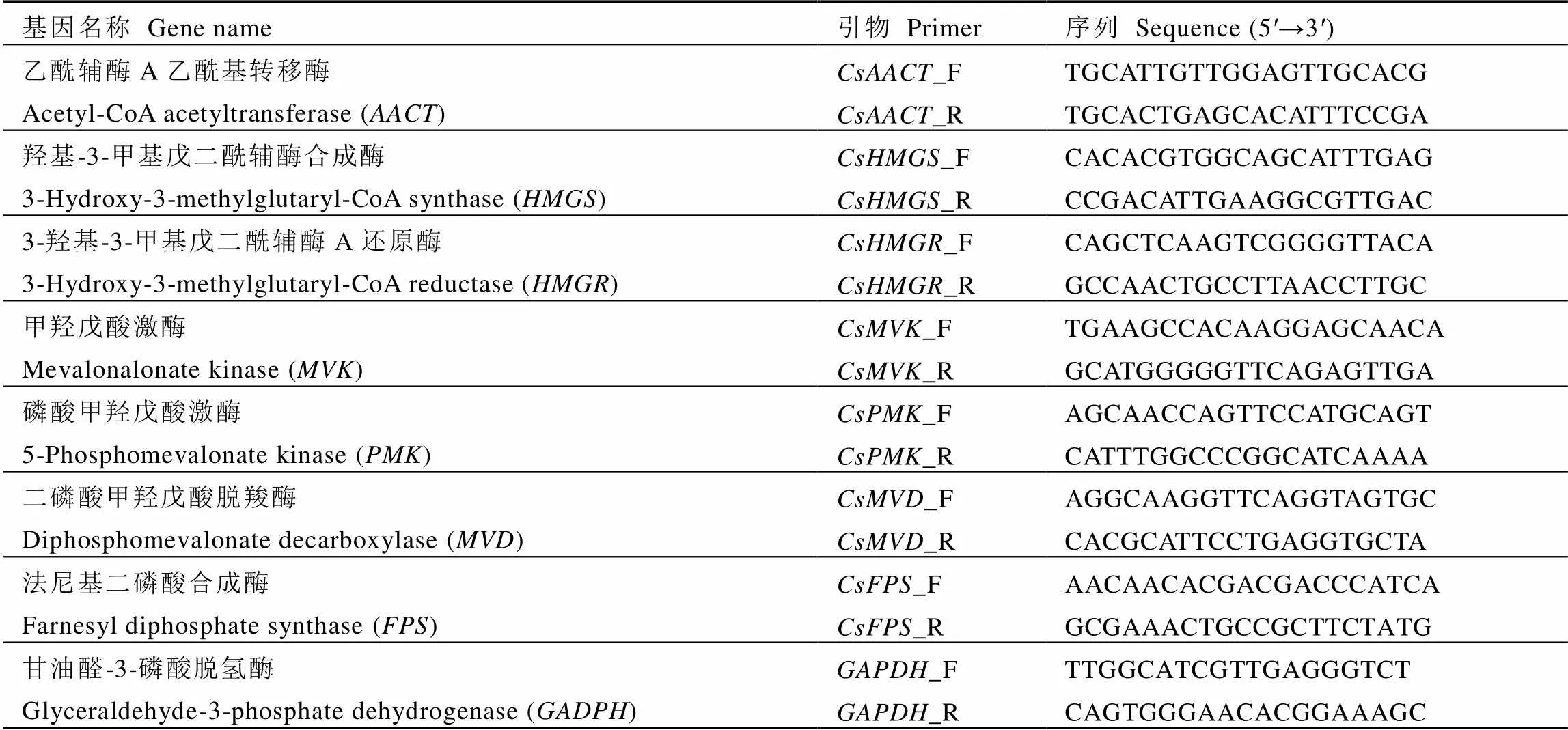
表1 MVA途径相关基因荧光定量引物序列
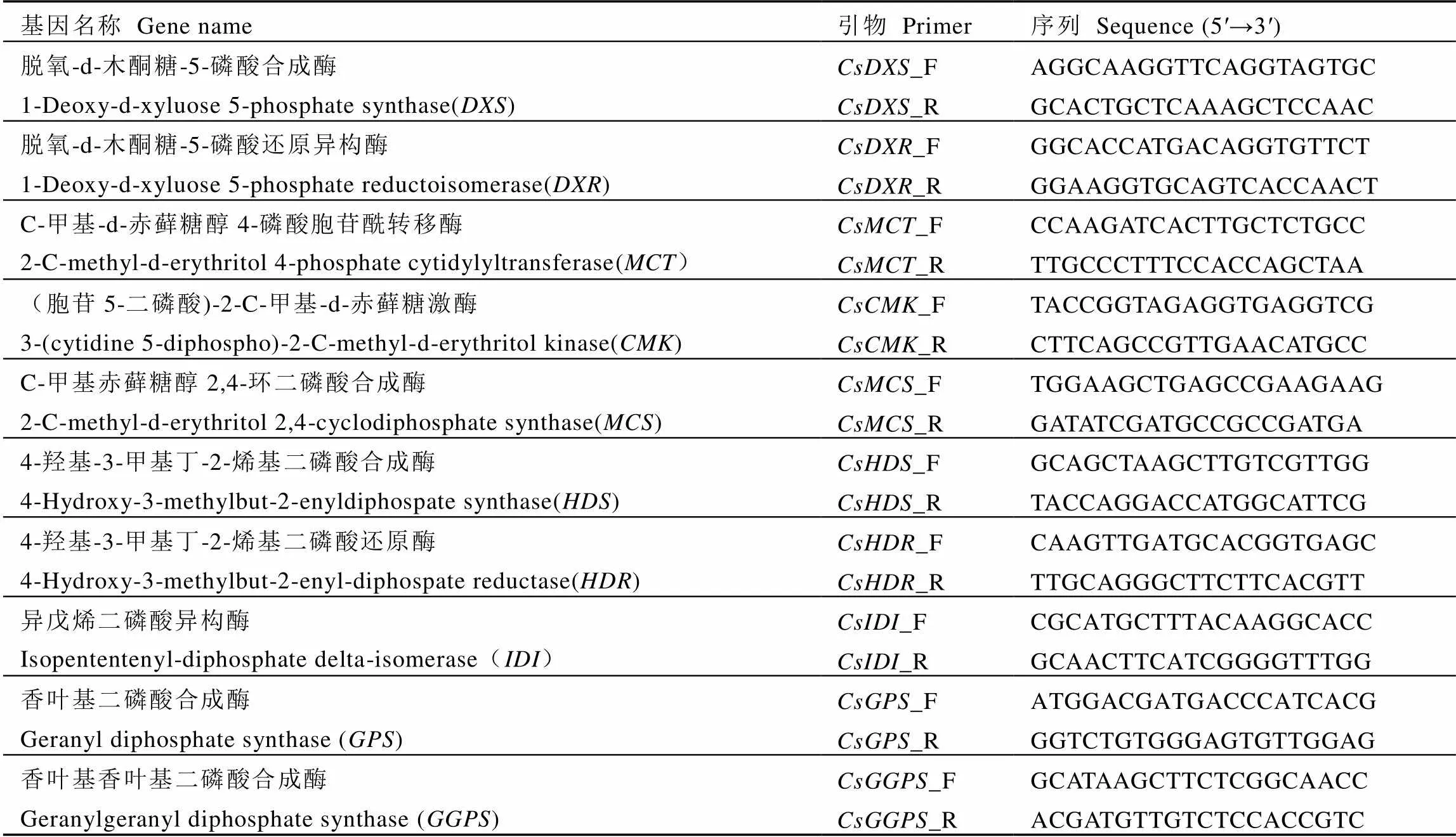
表2 MEP途径萜类相关基因荧光定量引物序列
研究发现在茶树萜类合成相关基因家族中,特异性组织表达较高的代表性基因包括(TEA031429)(TEA008511)(TEA014739)(TEA001661)(TEA005868)(TEA028769)(TEA022423)(TEA022400)(TEA026311)(TEA019181)(TEA006109)(TEA000926)(TEA005817)(TEA026482)(TEA027323)(TEA010494)(TEA013763)(TEA012305)(TEA018159)(TEA019181)(TEA006109)(TEA011772)(TEA016514)。
2.2 茶树萜烯类合成相关基因编码蛋白的理化性质
经过鉴定和分析,最终获得16个茶树萜烯类合成相关基因。结果显示(表3)其基因编码序列(CDS)长度为711~2 223 bp,编码氨基酸开放阅读框(ORF)为236~740 aa。利用在线网站ExPASy软件包对茶树萜烯类合成相关基因进行理化性质分析。茶树萜烯类合成相关基因分子量在59.72~181.79 kDa,等电点为4.91~5.10。筛选出的萜烯类合成基因编码蛋白均为亲水性蛋白,但亲水程度不同。对茶树萜烯类合成相关基因进行亚细胞定位预测,结果显示均存在于细胞核中,其中大部分基因定位于叶绿体,少部分定位到质膜、细胞核和细胞质。
2.3 茶树萜烯类合成相关基因进化树构建
将茶树萜烯类合成相关基因与拟南芥和葡萄萜烯类合成相关基因的蛋白序列使用ClustalW进行多重序列比对,并使用MEGA构建系统进化树(图2)。结果显示,茶树、拟南芥和葡萄的萜烯类合成相关基因聚类后可分成4组,其中,亚家族Ⅰ包含茶树、、和,亚家族Ⅱ包含、、和,亚家族Ⅲ包含、、和,亚家族Ⅳ包含、、和。除了和与其他两个物种不在同一个亚家族上,其他基因与拟南芥和葡萄都分布在一个亚家族上。
2.4 茶树萜烯类合成相关基因结构分析
通过对外显子-内显子结构分析,进一步了解茶叶中在萜烯类生物合成的相关基因。茶叶萜烯类合成相关基因外显子-内显子结构图显示(图3),每个基因的外显子-内显子数量差异很大,表明萜烯类合成相关基因在进化过程中出现了外显子增加或者缺失现象。大多数萜烯类生物合成相关基因的编码DNA序列中含有5~14个外显子。然而本研究发现包含外显子在编码DNA序列中有19个外显子。是最长的萜烯类生物合成相关基因,基因序列长度超过17.5 kbp。此外发现基因的外显子-内显子结构没有内含子。茶叶在萜烯类生物合成相关基因结构的显著差异表明,茶树基因组在进化过程中发生了显著的变化。
2.5 茶树萜烯类合成相关基因启动子顺式元件分析
为研究茶树萜烯类合成相关基因顺式元件的功能,从茶树基因组数据库下载基因转录起始位置上游2 000 bp的序列,搜索每个基因顺式作用元件。在茶叶萜烯类合成相关基因启动子中共鉴定出26种顺式元件(图4),其中包含14种光敏信号元件、3种植物生长相关元件、4种胁迫响应元件和5种激素响应元件。光敏顺式元件占有最大部分,包含有MRE、BOX4、ACE、GATA-motif、GT1-motif、AE-box、G-box、LAMP-element、TCT-motif、chs-CMA1a、I-box、GA-motif、AT1-motif和Sp1结合位点;响应茉莉酸酯的CGTCA-motif 结合位点和响应脱落酸的ABRE是萜烯类合成相关基因启动子中最丰富的响应元件。此外,还发现少数激素响应元件,例如TCA-element(水杨酸)、TGA-element1(生长素)、P-box(赤霉素),以及胁迫响应顺式元件,例如MBS(干旱)、ARE(厌氧诱导)和TC-rich repeats(防御和应激)。
2.6 参与MVP和MVA途径的茶树萜烯类合成相关基因表达量分析
将筛选出的16个茶树萜烯类合成相关基因,进行白茶萎凋过程中不同时间段(0、4、8、16、24、32、40、48 h)基因表达量分析,结合MVA和MEP途径绘制图谱(图5)。在MVA途径中发现6个基因,催化IPP和DMAPP的形成。随着萎凋时间的延长,和的表达量呈持续上升趋势,和的表达量呈下降趋势。进入萜烯类生物合成的IPP和DMAPP主要通过质体的MEP途径,本研究发现了10个基因与该途径有关。其中,上调表达基因有和。大部分基因在0~4 h和16~24 h表达量上调,包括、、、、、和,在萎凋过程中4 h和8 h的最高表达量比0 h的高了接近2倍。推测、、、、、和与茶叶单萜类芳香物质形成有关。
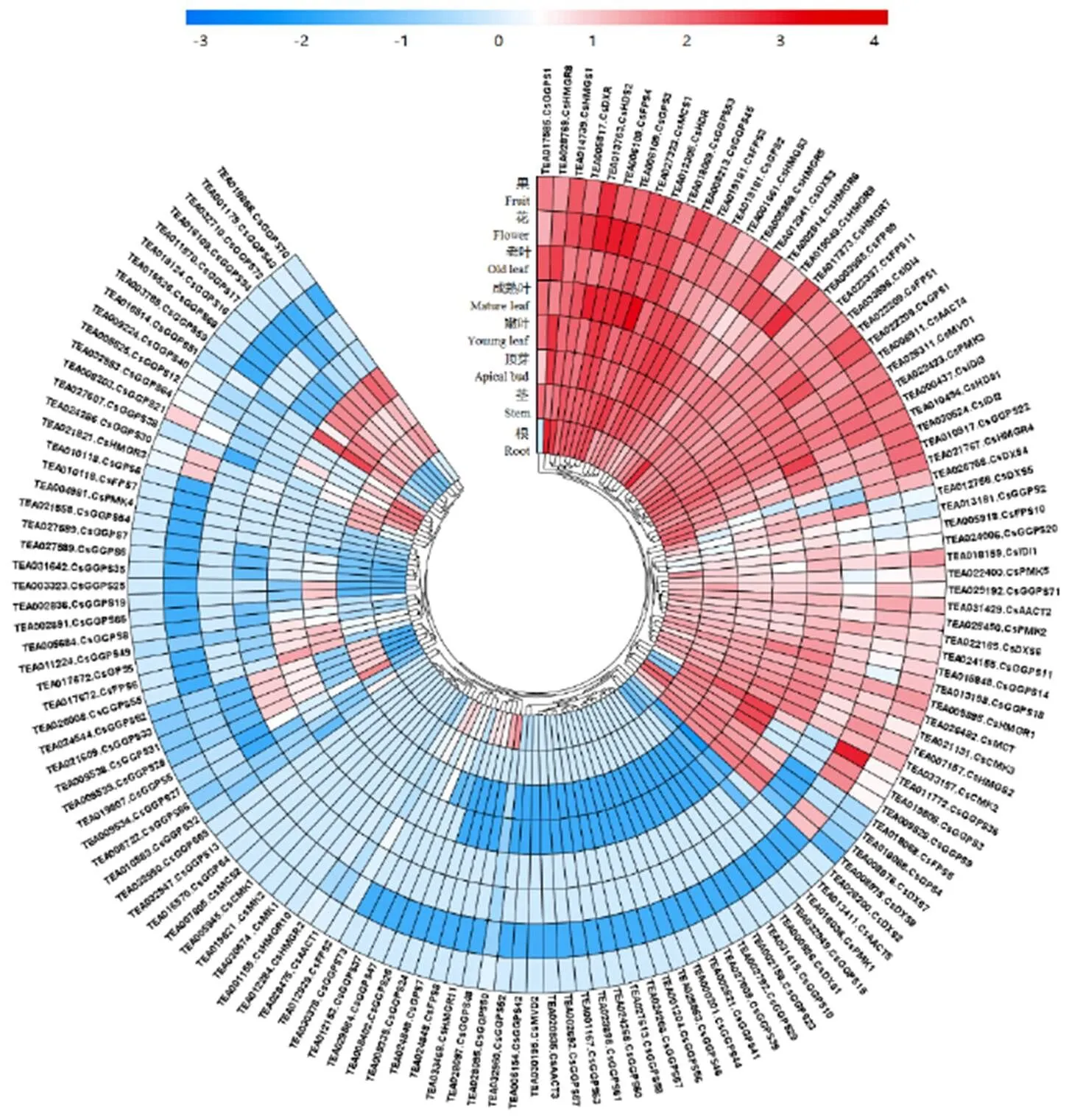
注:颜色刻度表示log2转换后的值,红色代表高表达,蓝色代表低表达
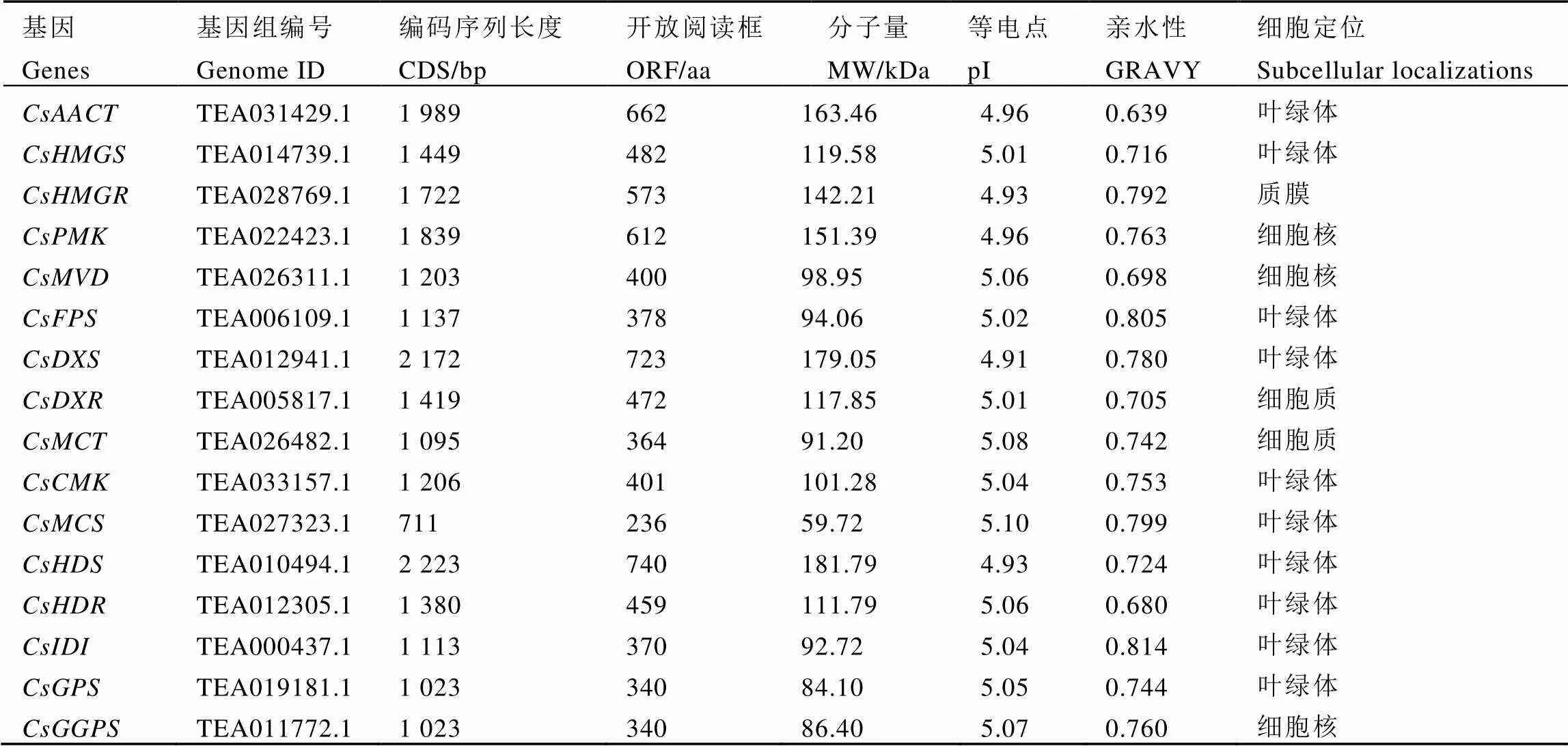
表3 茶树萜烯类合成相关基因编码蛋白的理化性质
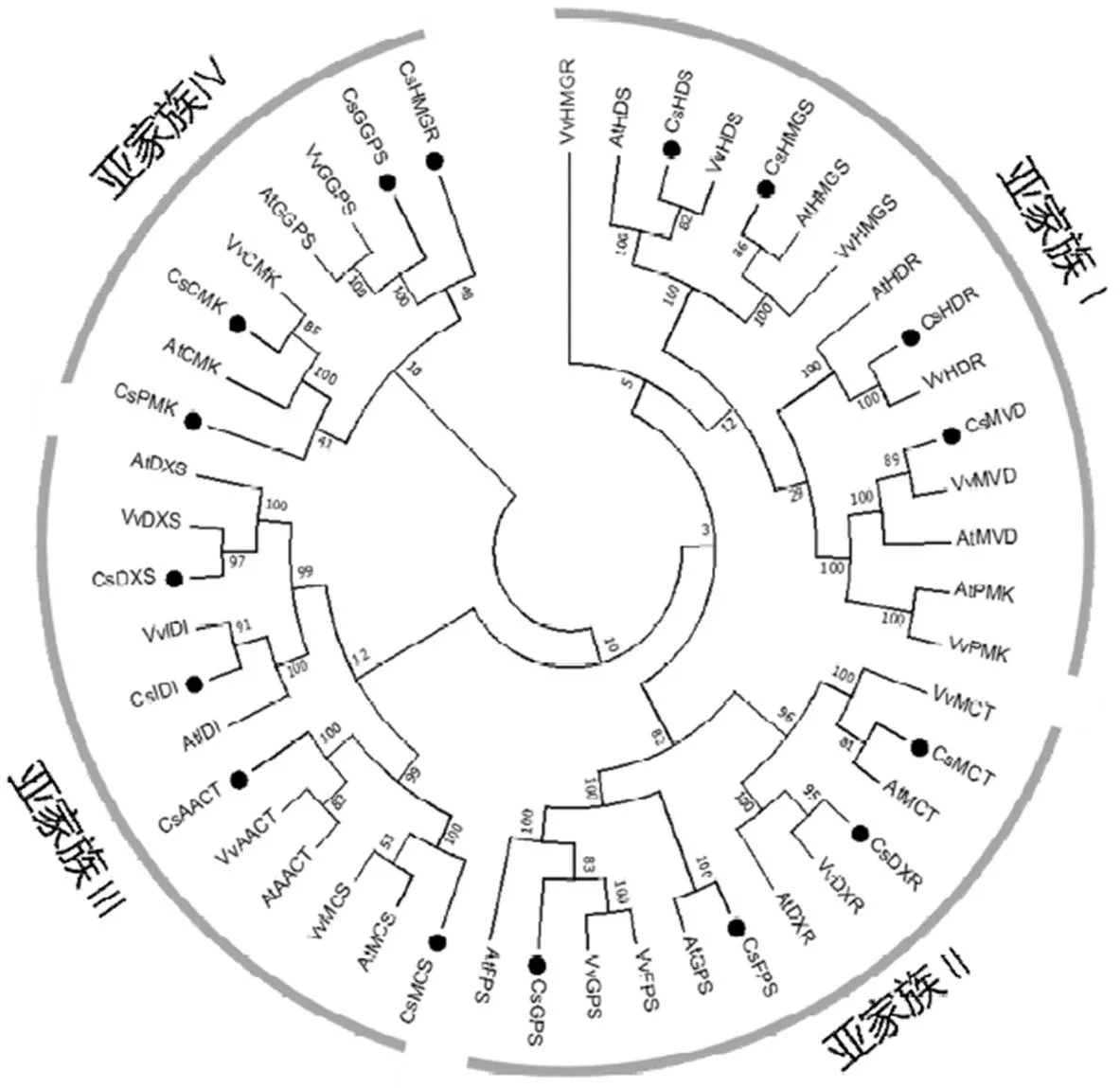
图2 茶树、拟南芥和葡萄萜烯类合成相关基因的进化树

注:(A)萜烯类合成基因蛋白的系统进化树;(B)萜烯类合成基因的外显子-内含子结构。黄色表示外显子,黑色表示内含子
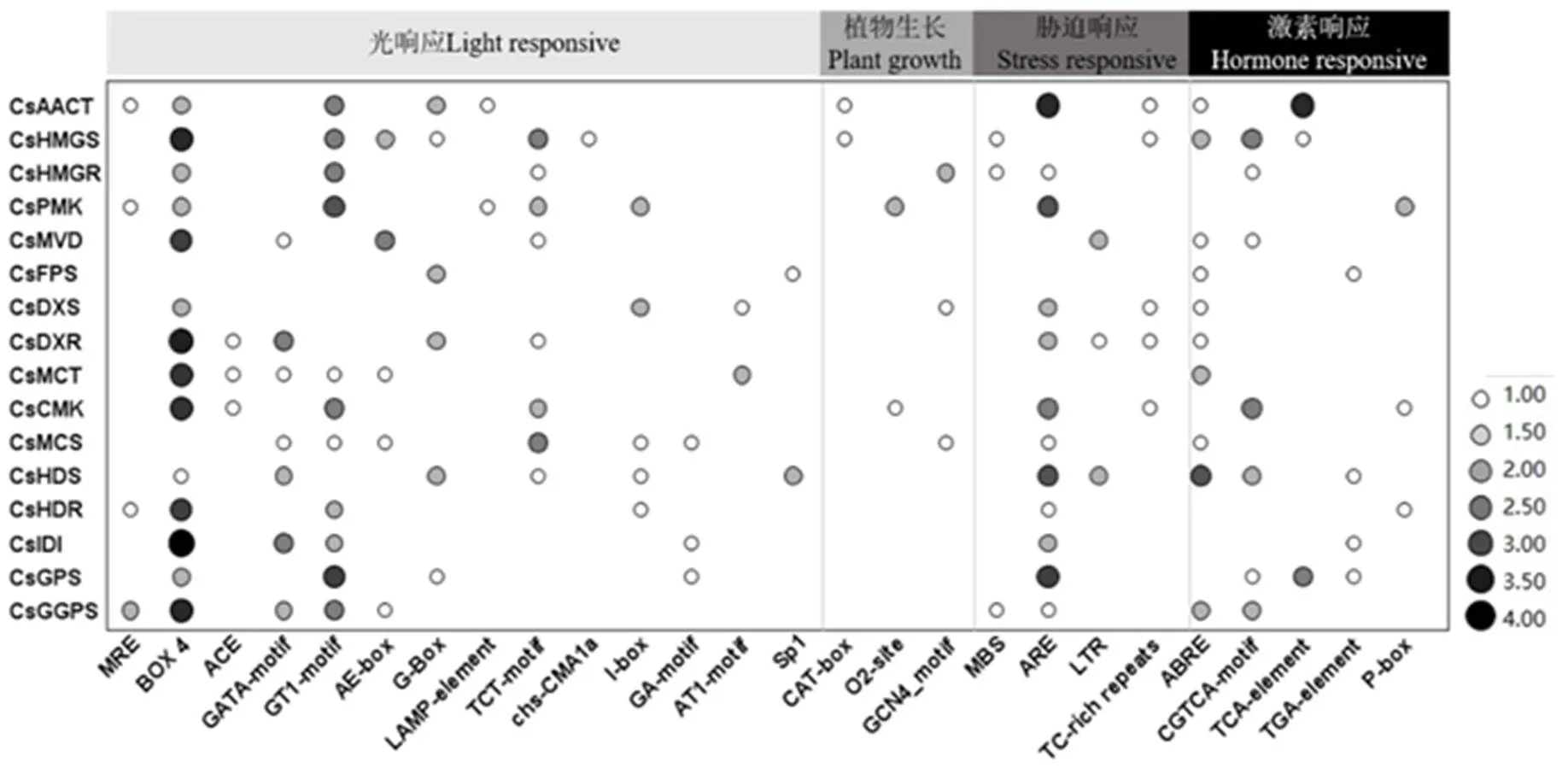
注:MRE、BOX4、ACE、GATA-motif、GT1-motif、AE-box、G-box、LAMP-element、TCT-motif、chs-CMAIa、I-box、GA-motif、AT1-motif和Sp1是光敏响应元件;CAT-box、O2-site和GCN4-motif分别是分生表达组织、玉米醇溶蛋白代谢和胚乳表达;MBS,ARE和 TC-rich repeats分别是干旱响应,厌氧诱导和防御与应激响;ABRE、CGTCA-motif、TCA-element、TGA-element1和P-box分别为脱落酸响应、茉莉酸酯响应、水杨酸响应、生长素响应和赤霉素响应

注:AACT,乙酰辅酶A乙酰基转移酶;HMGS,羟基-3-甲基戊二酰辅酶合成酶; HMGR,3-羟基-3-甲基戊二酰辅酶A还原酶;MVK,甲羟戊酸激酶;PMK,磷酸甲羟戊酸激酶;MVD,二磷酸甲羟戊酸脱羧酶;FPS,法尼基二磷酸合成酶;DXS,脱氧-D-木酮糖-5-磷酸合成酶;DXR,脱氧-D-木酮糖-5-磷酸还原异构酶;MCT,C-甲基-D-赤藓糖醇4-磷酸胞苷酰转移酶;CMK,(胞苷5-二磷酸)-2-C-甲基-D-赤藓糖激酶;MCS,C-甲基赤藓糖醇2,4-环二磷酸合成酶;HDS,4-羟基-3-甲基丁-2-烯基二磷酸合成酶;HDR,4-羟基-3-甲基丁-2-烯基二磷酸还原酶;IDI,异戊烯二磷酸异构酶;GPS,香叶基二磷酸合成酶;GGPS,香叶基香叶基二磷酸合成酶
3 讨论
萜烯类化合物是种类、数量最丰富的一类植物次生代谢产物[20]。萜烯类合成相关基因迄今已在佛手[21]、花椒[22]和桂花[23]等物种中进行鉴定和表达分析。本研究从茶树基因组数据库中鉴定出141个萜烯类合成相关基因,对其的组织表达特异性进行分析,并通过茶树顶芽和嫩叶的表达丰度进行了二次筛选,获得16个差异表达显著的代表基因。为了将茶树中的萜烯类合成相关基因进行功能分类,利用聚类分析构建茶树、拟南芥和葡萄的萜烯类合成相关基因系统进化树。根据每个基因的保守性,将具有相似功能的基因分类到同一组,这也为萜烯类合成相关基因的功能研究提供了可靠依据。例如在拟南芥中鉴定出3个萜烯类合成相关基因在花中特异性表达,并催化其挥发性香气物质的积累[24]。根据进化关系中基因的同源性,可以推测位于同一亚家族基因可能参与相似的调控途径。
MVA途径和MEP途径是萜烯类化合物主要的合成途径。MVA途径主要参与茶叶倍半萜、三萜类化合物的合成;MEP途径主要参与茶叶单萜和二萜类物质的合成[7]。萜烯类化合物大多具有独特的香气,特别是具有花香的芳樟醇和香叶醇。前人研究发现芳樟醇、香叶醇及其氧化物等萜烯类化合物是白茶显“毫香”的特征成分,萎凋过程中脱水胁迫诱导的萜烯类化合物显著增加[2]。在茶叶萎凋过程从0 h到48 h,萜烯类化合物从44种增加到65种[25]。芳樟醇及其氧化物、香叶醇、柠檬醛等萜烯类挥发物含量随着萎凋进程持续显著增加。Han等[26]研究表明,是控制MVA和MEP途径中代谢通路的关键限速酶,在茶叶萎凋过程中促进了萜类化合物及其前体物质的积累。因此,萎凋过程可能会显著影响茶叶萜烯类挥发物的含量与合成相关基因的表达,这与之前的研究结果一致。本研究结果显示,和随着萎凋时间延长逐渐上调,在48 h内显示出表达峰值,这可能有助于下游萜烯类挥发物达到最大程度。
单萜化合物是具有花香的主要物质,对茶叶的品质风味有重要影响。对茉莉花不同花发育阶段分析结果表明,MEP途径关键基因对茉莉花主要挥发性香气化合物-法尼烯、芳樟醇和乙酸苄酯的含量起作用[27]。Xu等[28]研究表明,MEP途径的相关基因被激活以响应茶叶在萎凋过程中受到的胁迫。基因是MEP途径控制速率的重要因子[29],在葡萄中也发现是挥发性萜烯类代谢前体异戊二烯基焦磷酸(IPP)及二甲基烯丙基焦磷酸(DMAPP)的限速酶之一[30],预测与该基因与在葡萄萜烯类合成途径的调节功能是相似的。姚雪倩等[10]研究发现,橙花叔醇、香叶醇、芳樟醇和法尼烯在做青后期不断积累,可能与的表达量在做青过程静置过程中持续增高有关。与该研究对比发现,本研究中在白茶萎凋过程中表达量持续增高,在萎凋48 h其表达量最高可达到鲜叶的2倍以上。在本研究中,和在萎凋过程0~4 h和16~24 h表达量呈上升趋势,预测在这两个时间段单萜类化合物得到快速积累。
本研究在茶树基因组中鉴定出141个萜烯类合成相关基因,结合基因组织表达特异性筛选出16个高表达的成员,并进行系统的发育进化、基因结构和启动子顺式作用元件分析。此外采用荧光定量PCR分析萎凋过程中萜烯类合成相关基因的表达谱信息,推测其在茶叶萎凋过程中发挥作用。对茶叶萎凋过程中萜烯类合成相关基因的研究,既为茶叶挥发性香气化合物合成机制提供信息,也为白茶萎凋生产提供了理论依据。
[1] 叶乃兴. 白茶: 科学·技术与市场[M]. 北京: 中国农业出版社, 2010: 136-137. Ye N X. The science technology and market of white tea[M]. Beijing: China agriculture press, 2010: 136-137.
[2] Chen Q C, Zhu Y, Dai W D, et al. Aroma formation and dynamic changes during white tea processing [J]. Food Chemistry, 2019, 274: 915-924.
[3] Wang Y, Zheng P C, Liu P P, et al. Novel insight into the role of withering process in characteristic flavor formation of teas using transcriptome analysis and metabolite profiling [J]. Food Chemistry, 2018, 272: 313-322.
[4] Deng W W, Wang R, Yang T, et al. Functional characterization of salicylic acid carboxyl methyltransferase from, providing the aroma compound of methyl salicylate during withering process of white tea [J]. Journal of Agricultural and Food Chemistry, 2017, 65(50): 11036-11045.
[5] 徐燕. 茶树萜类合成途径关键基因克隆及表达研究[D]. 杭州: 浙江大学, 2013. Xu Y. Studies in cloning and expression of the key genes involved in the terpenoids metabolic pathway of tea plant [D]. Hangzhou: Zhejiang University, 2013.
[6] Yahyaa M, Tholl D, Cormier G, et al. Identification and characterization of terpene synthases potentially involved in the formation of volatile terpenes in carrot (L.) roots [J]. Journal of Agricultural and Food Chemistry, 2015, 63(19): 4870-4878.
[7] 贺志荣, 项威, 徐燕, 等. 茶树挥发性萜类物质及其糖苷化合物生物合成的研究进展[J]. 茶叶科学, 2012, 32(1): 1-8. He Z R, Xiang W, Xu Y, et al. Progress in the research biosynthesis of volatile terpenoids and their glycosides in the tea plant [J]. Journal of Tea Science, 2012, 32(1): 1-8.
[8] 张冬桃, 孙君, 叶乃兴, 等. 茶树萜烯类香气物质合成相关酶研究进展[J]. 茶叶学报, 2016, 56(2): 68-79. Zhang D T, Sun J, Ye N X, et al. Research progress of enzymes associated with terpene synthesis in[J]. Journal of Tea, 2016, 56(2): 68-79.
[9] 王鹏杰, 陈丹, 曹红利, 等. 茶树甲羟戊酸焦磷酸脱羧酶基因的克隆与表达分析[J]. 西北植物学报, 2017, 37(12):2342-2349.Wang P J, Chen D, Cao H L, et al. Cloning and expression of mevalonate diphosphate decarboxylase genein tea plant () [J]. Journal of Northwest Botany, 2017, 37(12): 2342-2349.
[10] 姚雪倩, 岳川, 杨国一, 等. 茶树牻牛儿基牻牛儿基焦磷酸合成酶基因的克隆及表达分析[J]. 茶叶科学, 2017, 37(1): 86-96.Yao X Q, Yue C, Yang G Y, et al. Cloning and expression analysis of geranygeranyl diphosphate synthase gene CsGGDPS in tea plant () [J]. Journal of Tea Science, 2017, 37 (1): 86-96.
[11] 王鹏杰, 陈丹, 俞滢, 等. 茶树单萜合成酶基因的克隆及表达分析[J]. 西北植物学报, 2017, 37(8): 1465-1473.Wang P J, Chen D, Yu Y, et al. Cloning and expression analysis of Monoterpene Synthase Gin tea plant () [J]. Northwest Journal of Botany, 2017, 37(8): 1465-1473.
[12] Hu C J, Li D, Ma Y X, et al. Formation mechanism of the oolong tea characteristic aroma during bruising and withering treatment [J]. Food Chemistry, 2018, 269: 202-211.
[13] Zheng Y C, Wang P J, Chen X J, et al. Transcriptome and metabolite profiling reveal novel insights into volatile heterosis in the tea plant () [J]. Molecules, 2019, 24(18): 3380. doi: org/10.3390/molecules24183380
[14] 陈静, 俞滢, 张丹丹, 等. 白茶萎凋过程中儿茶素合成关键酶基因表达分析[J]. 南方农业学报, 2016, 47(8): 1364-1369. Chen J, Yu Y, Zhang D D, et al. Expression of genes encoding of key enzymes in biosynthesis pathways of catechins in the withering process of white tea [J]. Southern Journal of Agriculture, 2016, 47 (8): 1364-1369.
[15] Wei C L, Yang H, Wang S B, et al. Draft genome sequence ofvar.provides insights into the evolution of the tea genome and tea quality [J]. Proceedings of the National Academy of Sciences, 2018, 115(18): E4151-E4158.
[16] 王鹏杰, 郑玉成, 林浥, 等. 茶树基因家族的全基因组鉴定及表达分析[J]. 西北植物学报, 2019, 39(3): 38-46. Wang P J, Zheng Y C, Lin Y, et al. Genome-wide identification and expression analysis ofgene Family in[J]. Journal of Northwest Botany, 2019, 39(3): 38-46.
[17] Trapnell C, Roberts A, Goff L, et al. Differential gene and transcript expression analysis of RNA-seq experiments with tophat and cufflinks [J]. Nature Protocols, 2012, 7(3): 562-578.
[18] Anders S, Pyl P T, Huber W, et al. Htseq-a python framework to work with high-throughput sequencing data [J]. Bioinformatics, 2015, 31(2): 166-169.
[19] Livak K, Schmittgen T. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta c(t))method [J]. Methods, 2000, 25(4): 402-408.
[20] 岳跃冲, 范燕萍. 植物萜类合成酶及其代谢调控的研究进展[J]. 园艺学报, 2011, 38(2): 379-388.Yue Y C, Fan Y P. The terpenoid synthase and Regulation of terpene metabolism in plants [J]. Horticultural Journal, 2011, 38(2): 379-388.
[21] Xu Y Y, Zhu C Q, Xu W P, et al. Integration of metabolite profiling and transcriptome analysis reveals genes related to volatile terpenoid metabolism in finger citron (var.). Molecules, 2019, 24(14), 2564. doi: 10.3390/molecules24142564.
[22] Shi J W, Fei X T, Hu Y, et al. Identification of key genes in the synthesis pathway of volatile terpenoids in fruit of zanthoxylum bungeanum maxim [J]. Forests, 2019, 10(4): 328.doi: org/10.3390/f10040328.
[23] Zeng X L, Cai L, Riru Z, et al. Emission and accumulation of monoterpene and the key terpene synthase (TPS) associated with monoterpene biosynthesis in osmanthus fragrans lour [J]. Frontiers in Plant Science, 2016, 6: 1232.doi: org/10.3389/fpls.2015.01232.
[24] Tholl D, Lee S. Terpene specialized metabolism in[J]. The Arabidopsis Book, 2011, 9: e0143. Doi: 10.1199/tab.0143.
[25] Wang Y, Zheng P C, Liu P P, et al. Novel insight into the role of withering process in characteristic flavor formation of teas using transcriptome analysis and metabolite profiling [J]. Food Chemistry, 2019, 272: 313-322.
[26] Han Z X, Rana M M, Liu G F, et al. Green tea flavour determinants and their changes over manufacturing processes [J]. Food Chemistry, 2016, 212: 739-748.
[27] Ying Y, Shi H L, Dan C, et al. Volatiles emitted at different flowering stages of jasminum sambac and expression of genes related to-farnesene biosynthesis [J]. Molecules, 2017, 22(4): 546. doi: org/10.3390/molecules22040546.
[28] Xu Q S, He Y X, Yan X M, et al. Unraveling a crosstalk regulatory network of temporal aroma accumulation in tea plant () leaves by integration of metabolomics and transcriptomics [J]. Environmental and Experimental Botany, 2018, 149: 81-94.
[29] Lorenzo C, Albert C, Patricia B, et al. Enhanced flux through the methylerythritol 4-phosphate pathway in Arabidopsis plants overexpressing deoxyxylulose 5-phosphate reductoisomerase [J]. Plant Molecular Biology, 2006, 62 (4): 683-695.
[30] Phillips M A, Walter M H, Ralph S G, et al. Functional identification and differential expression of 1-deoxy-d-xylulose 5-phosphate synthase in induced terpenoid resin formation of Norway spruce () [J]. Plant Molecular Biology, 2007, 65(3): 243-257.
Identification and Expression Analysis of Terpene Synthesis Related Genes during the Withering of White Tea
CHEN Xuejin, WANG Pengjie, LIN Xinying,GU Mengya, ZHENG Yucheng,ZHENG Zhilin,YE Naixing*
College of Horticulture, Fujian Agriculture and Forestry University/Key Laboratory of Tea Science at Universities in Fujian, Fuzhou 350002, China
Terpenes are the important secondary metabolites in plants and play an important role in the composition of the volatile aroma of tea plants. In this study, 141 tea plant terpenoid synthesis-related genes were identified from the tea plant genome database. Their expression specificities in different tissues were analyzed. Sixteen terpene synthetic genes which were highly expressed in the apical buds and young leaves of tea plants were screened. The results of bioinformatics methods show that the phylogenetic relationship divides the genes related to terpene synthesis of tea plant, Arabidopsis and grape into four subfamilies. The terpenoid synthesis related genes contain 5 to 14 exons and a large number of cis-related elements closely related to light response, plant growth and development, hormone and stress response according to the upstream promoter region analysis. Fluorescence quantitative detection showed that the expressions of,andwere significantly up-regulated during the withering process of white tea. The expressions of,,,,,andshowed the highest expressions at 4 h and 24 h after withering. The results of this study provided a theoretical basis for further exploring the functions of terpenoid synthesis related genes in tea.
white tea, aroma, terpenes, expression analysis
《茶叶科学》参考文献格式示范
《茶叶科学》参考文献格式参照GB/T 7714—2015 信息与文献参考文献著录规则的格式。以下为部分实例。
期刊类
[1] 朱旗, 施兆鹏, 任春梅. 绿茶香气不同提取方法的研究[J]. 茶叶科学, 2001, 21(1): 38-43. Zhu Q, Shi Z P, Ren C M. Studies on the different aroma making methods of green tea aroma [J]. Journal of Tea Science, 2001, 21(1): 38-43.
硕博士论文
[2] 王俊翔. 零售商商店形象、广告投入与自有品牌溢价支付意愿的关系研究[D]. 南京: 南京大学, 2017. Wang J X. Exploring the relationship between retailers' store image, advertising spending and customers' willingness to pay a price premium for private brand [D]. Nanjing: Nanjing University, 2017.
电子公告联机网络类
[3] 中国茶叶流通协会[EB/OL]. http://www.ctma.com.cn/ctma_xxb/cy/2019/0227/60411.html.China Tea Marketing Association [EB/OL]. http://www. ctma.com.cn/ctma_xxb /cy /2019/0227/60411.html.
书籍、专著类
[4] 吴明隆. 结构方程模型——AMOS的操作与应用[M]. 重庆: 重庆大学出版社, 2018. Wu M L. Structural equation model - operation and application of AMOS [M]. Chongqing: Chongqing University Press, 2018.
标准文献
[5] 中华人民共和国国家卫生健康委员会. 食品安全国家标准食品中农药最大残留限量: GB 2763—2019[S]. 北京: 中国农业出版社, 2019. National Health Commission of the People's Republic of China. National food safety standard—Maximum residue limits for pesticides in food: GB 2763—2019 [S]. Beijing: China Agriculture Press, 2019.
S571.1;Q946.8
A
1000-369X(2020)03-363-12
2019-11-07
2019-12-13
国家自然科学基金项目(31270735)、福建农林大学科技创新专项基金项目(CXZX2017181、CXZX2016117)
陈雪津,女,硕士研究生,主要从事茶树栽培育种和生物技术。*通信作者:ynxtea@126.com
投稿平台:http://cykk.cbpt.cnki.net

