响应面法优化粗糙脉孢菌番茄红素的皂化提取工艺及其抗氧化活性
王瑞琪,陈 钢,阙发秀,朱宏林,郭月山,简素平
(南昌大学,食品科学与技术国家重点实验室,江西南昌 330047)
粗糙脉孢菌(Neurosporacrassa)是一种典型的模式真菌,被广泛应用于遗传学、生物化学及分子生物学等领域的研究[1]。经过两百多年的研究发现,粗糙脉孢菌可在多种类型的培养基上快速生长,且没有检测到霉菌毒素的生成[2]。在不同条件下对粗糙脉孢菌进行培养可生成多种代谢产物,番茄红素是其中之一。据报道,番茄红素具有抗氧化、抗菌和消炎等生理活性[3],其中较强的抗氧化能力有利于降低癌症[4]、心血管疾病[5]等的风险,因此在工业上常作为重要的营养补充剂、食品着色剂及饲料添加剂等[6]。
目前,番茄红素的提取方法主要包括有机溶剂提取法[7]、超声辅助萃取法[8]及微波辅助萃取法[9]等。尽管操作简便,但由于番茄红素是一种亲脂性物质,易被菌体细胞内的脂肪酸甘油酯及游离脂肪酸等脂溶性物质束缚[10],通过传统的提取方法难以使萃取介质完全进入生物质内部,得到的番茄红素亦含有脂溶性物质等杂质,从而造成得率及纯度均不高[11]。为解决这些问题,廉博[12]提出先用皂化反应进行前处理,再用有机溶剂浸提的方法,结果表明通过该法得到的黏红酵母番茄红素得率比不皂化时提高了20.3%。皂化反应不仅可以破坏脂肪酸甘油酯的酯键,形成水溶性的脂肪酸盐和甘油,让番茄红素充分释放出来[13];而且,碱性皂化剂对细胞壁具有破坏作用,可提高有机溶剂的萃取率[14];还有研究表明,在碱性环境下进行皂化反应不会造成由于结构发生变化而引起的有效成分破坏[15]。因此,通过皂化反应对番茄红素提取具有多方面重要的积极作用,但是关于皂化反应对粗糙脉孢菌番茄红素提取的研究还较少。
本研究通过皂化反应结合有机溶剂对粗糙脉孢菌番茄红素进行提取,研究了皂化温度、皂化时间及NaOH浓度对得率的影响,通过响应面设计优化得到最佳皂化提取条件,并对粗糙脉孢菌番茄红素进行了体外抗氧化活性测定,为粗糙脉孢菌番茄红素的提取及其开发利用提供了新的思路及理论支持。
1 材料与方法
1.1 材料与仪器
粗糙脉孢菌(Neurosporacrassa)3.1607 本实验室保藏;种子培养基:PDA培养基;发酵培养基(%):葡萄糖54.54,蛋白胨36.36,NaNO35.45,MgSO40.91,KCl 0.91,FeSO40.02,K2HPO41.82,121 ℃灭菌20 min;乙酸乙酯 分析纯,天津市大茂化学试剂厂;丙酮 分析纯,上海试剂化学有限公司;乙腈、二氯甲烷 色谱纯,德国Merck公司;番茄红素标准品 纯度≥98%,北京Solarbio公司;抗坏血酸、维生素E 分析纯,北京Solarbio公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、β-胡萝卜素、邻苯三酚、三羟基氨基甲烷(Tris)、水杨酸等 均为国产分析纯。
VD-650型净化工作台 苏州净化设备有限公司;ZHP-160智能恒温振荡培养箱 上海三发科学仪器有限公司;WZF-UV-2000紫外可见分光光度计 上海尤尼柯仪器有限公司;RE-52A旋转蒸发器 上海亚荣生化仪器厂;Agilent 1100型高效液相色谱仪 美国Agilent公司。
1.2 实验方法
1.2.1 菌种培养 将4 ℃保藏的粗糙脉孢菌接种于PDA培养基上于30 ℃活化培养48 h,挑取2环至30 mL液体发酵培养基中混匀制得孢子悬浮液(105个/mL),以5%的接种量接种到装有50 mL液体发酵培养基的250 mL锥形瓶中,于30 ℃振荡(110 r/min)培养19 h后静止培养87 h,全程光照。发酵结束后离心(8000 r/min,5 min)去除发酵液,蒸馏水洗涤三次后收集菌体,于45 ℃鼓风干燥箱中烘干至恒重,密封避光于4 ℃冰箱保存备用。
1.2.2 皂化提取番茄红素工艺 称取0.1 g烘干后的菌体,加入适量石英砂混合后充分研磨至粉末状,加入2 mL NaOH溶液(0.10 mol/L)后置于50 ℃水浴锅中避光反应30 min。皂化反应结束后通过盐酸(1 mol/L)调节pH至中性,离心(4500 r/min,10 min)去除上清液后用无水乙醇洗涤脱水。再加入10 mL乙酸乙酯-丙酮溶液(2∶3,V:V),先超声萃取20 min(200 W,40 kHz,25 ℃),再于30 ℃水浴锅中暗室提取2.5 h,离心(6000 r/min,10 min)得到上清的色素浸提液,适当稀释后经0.22 μm微孔滤膜过滤,于HPLC检测番茄红素含量。
1.2.3 番茄红素含量的测定方法 Agilent Ecllpse Plus C18柱(150 mm×4.6 mm,3.5 μm);流动相为乙腈-二氯甲烷溶液(60∶40,V∶V);流速1 mL/min;柱温28 ℃;进样量10 μL;检测波长472 nm;运行时间10 min。
1.2.4 番茄红素标准曲线的绘制 精确称取番茄红素标准品1.00 mg,用乙酸乙酯-丙酮溶液(2∶3,V∶V)定容至10 mL容量瓶中,摇匀,即得质量浓度为100 μg/mL的标准品母液。将母液逐步稀释配制成80、60、40、20、0 μg/mL的标准溶液。在“1.2.3”检测条件下进行测定,以番茄红素质量浓度为横坐标,峰面积为纵坐标进行线性回归分析,得到番茄红素质量浓度标准曲线:y=24.246x+51.938,R2=0.9988。
1.2.5 番茄红素得率的计算 根据式(1)计算番茄红素得率(Y)。
Y(mg/g)=((y-51.938)/24.246)×(V/m)×10-3
式(1)
式中:y表示番茄红素峰面积,mAU·s;V表示样品浸提稀释液总体积,mL;m表示干菌体质量,g。
1.2.6 单因素实验 依据“1.2.2”提取方法,研究皂化温度、皂化时间及NaOH浓度三个因素对番茄红素得率的影响。
1.2.6.1 皂化温度对番茄红素得率的影响 在皂化时间为30 min,NaOH浓度为0.10 mol/L的条件下,考察皂化温度为20、30、40、50、60、70 ℃对番茄红素得率的影响。
1.2.6.2 皂化时间对番茄红素得率的影响 在皂化温度为60 ℃,NaOH浓度为0.10 mol/L的条件下,考察皂化时间为10、20、30、40、50 min对番茄红素得率的影响。
1.2.6.3 NaOH浓度对番茄红素得率的影响 在皂化温度为60 ℃,皂化时间为20 min的条件下,考察NaOH浓度为0.02、0.04、0.06、0.08、0.10、0.12、0.14、0.16 mol/L对番茄红素得率的影响。
1.2.7 响应面优化试验 在“1.2.6”单因素实验的基础上,以番茄红素得率为响应值,依据Box-Behnken Design(BBD)设计原理,通过Design-Expert 8.0.6软件优化确定皂化温度、皂化时间及NaOH浓度三个因素对番茄红素提取的最佳工艺条件。试验因素及水平见表1。

表1 响应面试验因素和水平Table 1 Factors and levels of response surface methodology

1.2.8.1 番茄红素待测样品液的制备 称取1.0 g烘干的粗糙脉孢菌菌体,依据最优皂化条件进行前处理后,加入20 mL乙酸乙酯-丙酮溶液(2∶3,V∶V),先超声萃取20 min,后于30 ℃水浴锅中暗室提取2.5 h,离心(6000 r/min,10 min)得到上清液色素浸提液,于30 ℃进行减压旋转蒸发浓缩,得到番茄红素提取物,密封避光于4 ℃冰箱保存备用。使用时称取一定质量的番茄红素,通过二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解制备得到待测样品溶液。
1.2.8.2 DPPH·清除能力测定 参考Herchi等[16]的方法并稍作修改。分别取0.5 mL浓度为10、30、50、100、150、200、250 μg/mL的样品溶液,与2.5 mL浓度为2.5×10-5mol/L的DPPH-乙醇溶液充分混匀,于室温下避光反应30 min,在517 nm波长处测定反应液的吸光度值。
根据式(2)测定各样品溶液对DPPH·的清除率。
清除率(%)=[1-(A-A1)/A0]×100
式(2)
式中,A为各试验组吸光度值;A0为试剂空白吸光度值,即以去离子水代替样品溶液;A1为试液空白吸光度值,即以去离子水代替自由基溶液。
以相同浓度梯度的VC、VE及β-胡萝卜素样品溶液按上述方法测定对DPPH·的清除率。其中,VC用去离子水溶解,VE及β-胡萝卜素用DMSO溶解。
1.2.8.4 ·OH清除能力测定 根据Fenton法测定样品对·OH的清除能力,参考Liu等[18]的文献内容并稍作修改。分别取1.5 mL浓度为50、100、200、400、600、800、1000、1200 μg/mL的样品溶液,再加入1.5 mL FeSO4溶液(9.0 mmol/L)及1.5 mL水杨酸-乙醇溶液(9.0 mmol/L),振荡混匀后立即加入1.5 mL H2O2溶液(8.8 mmol/L),再次混匀后于37 ℃下反应30 min,在510 nm波长处测定反应体系的吸光度值。
按式(2)计算各样品溶液对·OH的清除率。测定相同浓度梯度的VC、VE及β-胡萝卜素样品溶液对·OH的清除率。
1.2.8.5 FRAP法测定抗氧化能力 参考Xiong等[19]的试验方法并稍作修改。制备300 mmol/L醋酸钠缓冲液(pH=3.6)、10 mmol/L TPTZ溶液及20 mmol/L FeCI3溶液,按10∶1∶1配制FRAP工作液。分别取40 μL浓度为20、40、60、80、100、120、140 μg/mL的样品溶液及3 mL FRAP工作液,充分混匀后于暗处反应20 min,在593 nm波长处测定反应液的吸光度值。
按照上述方法,以0.1~1.8 mmol/L的FeSO4标准溶液代替样品溶液绘制标准曲线,得到回归方程:y=0.2598x+0.0271,R2=0.9995。试验结果通过各样品溶液所测得的吸光度值,根据标准曲线回归方程计算出其相对应的FeSO4浓度(mmol/L),即定义为FRAP值,FRAP值越大,表明其抗氧化活性越强。
以相同浓度梯度的VC、VE及β-胡萝卜素样品溶液按上述方法测定FRAP值。
1.3 数据处理
所有试验均进行三次平行,测定结果以平均值±标准差表示,应用SPSS 24.0软件对数据进行ANOVA分析,采用Duncan法进行多重比较检验,P<0.05表示具有显著性差异。通过Excel 2013作图,并采用Design-Expert 8.0.6软件进行响应面试验设计分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 皂化温度对番茄红素得率的影响 由图1可知,粗糙脉孢菌番茄红素得率明显受皂化温度影响。随着温度升高,得率上升,当反应温度为60 ℃时,得率达到最大(1.183±0.006) mg/g,当温度继续升高至70 ℃时,其与60 ℃条件下的得率无统计学差异(P>0.05)。实际上,皂化反应是一个吸热过程,当温度较低时,其反应速度和传质速度均较低,并且其热效应不足以破坏生物质细胞壁以更好的渗透浸提溶液,导致皂化反应不充分,继而造成番茄红素得率不高[13,20]。因此,温度的升高可为分子反应提供足够的能量,提高脂质转化动力学,促进番茄红素从脂质中释放出来[20]。但是番茄红素是一种热敏性物质,在较高温度下会发生氧化分解;同时,番茄红素在高温下可能由反式结构转为顺式结构,影响其品质,降低其抗氧化活性[21]。综合考虑选择60 ℃用于响应面试验设计。

图1 皂化温度对番茄红素得率的影响Fig.1 Effect of saponification temperatureon the extraction yield of lycopene注:不同小写字母表示差异显著(P<0.05);图2、图3同。
2.1.2 皂化时间对番茄红素得率的影响 由图2可知,当时间小于20 min时,番茄红素得率随着时间的增加而增加;当反应时间为20 min时,其得率显著高于其它试验组(P<0.05);当延长反应时间,得率大幅下降,可能是由于番茄红素被氧化分解的可能性大大增加。研究表明,反应时间对皂化反应的影响是复杂的,受皂化试剂浓度及温度的影响,当碱溶液浓度或温度较高时,需选择较短的反应时间以减弱对易分解物质的破坏作用[13]。因此,选择反应时间20 min用于响应面试验设计。

图2 皂化时间对番茄红素得率的影响Fig.2 Effect of saponification timeon the extraction yield of lycopene
2.1.3 NaOH浓度对番茄红素得率的影响 据报道,碱性催化剂比酸性催化剂能更有效地诱导皂化反应,并且其比酸性催化剂在皂化时所需溶液体积更少[22],因此选用NaOH作为皂化反应的催化剂。由图3可知,在试验浓度范围内,番茄红素得率呈先升高后下降的变化趋势。当NaOH浓度为0.06 mol/L时,番茄红素得率达到最大(1.613±0.014) mg/g,比未皂化组(1.170±0.013) mg/g提高了37.86%,同时发现其得率显著高于其他试验组(P<0.05);同样地,孙协军等[23]通过皂化前处理提取β-胡萝卜素,其得率提高了21.43%。番茄红素通常储存于中性脂质中,NaOH可与甘油三酯及游离脂肪酸通过皂化反应形成钠盐而溶于水相,将番茄红素释放为游离态[24]。同时,NaOH浓度的增加有利于破坏细胞壁结构,促进有机溶剂进入生物质内部对番茄红素进行浸提[14]。但是,强碱环境对番茄红素具有破坏作用,可能致其得率降低[25]。因此,选择NaOH浓度0.06 mol/L用于响应面试验设计。

图3 NaOH浓度对番茄红素得率的影响Fig.3 Effect of NaOH concentrationon the extraction yield of lycopene
2.2 响应面优化试验分析
2.2.1 响应面设计方案及试验结果 依据“2.1”单因素实验结果,通过Design-Expert 8.0.6软件,以番茄红素得率(Y)为指标,对皂化温度(A)、皂化时间(B)及NaOH浓度(C)进行3因素3水平响应面优化试验,共17个试验点,包含12个析因子及5个中心点。设计方案及结果如表2所示。

表2 响应面试验结果Table 2 The results of response surface methodology
2.2.2 模型的建立及方差分析 通过Design Expert 8.0.6软件对表2中试验结果进行多元回归拟合,得到以番茄红素得率为响应值的回归方程:
Y=1.62-0.059A+0.047B+0.061C+0.022AB+0.00975AC-0.00175BC-0.14A2-0.15B2-0.16C2

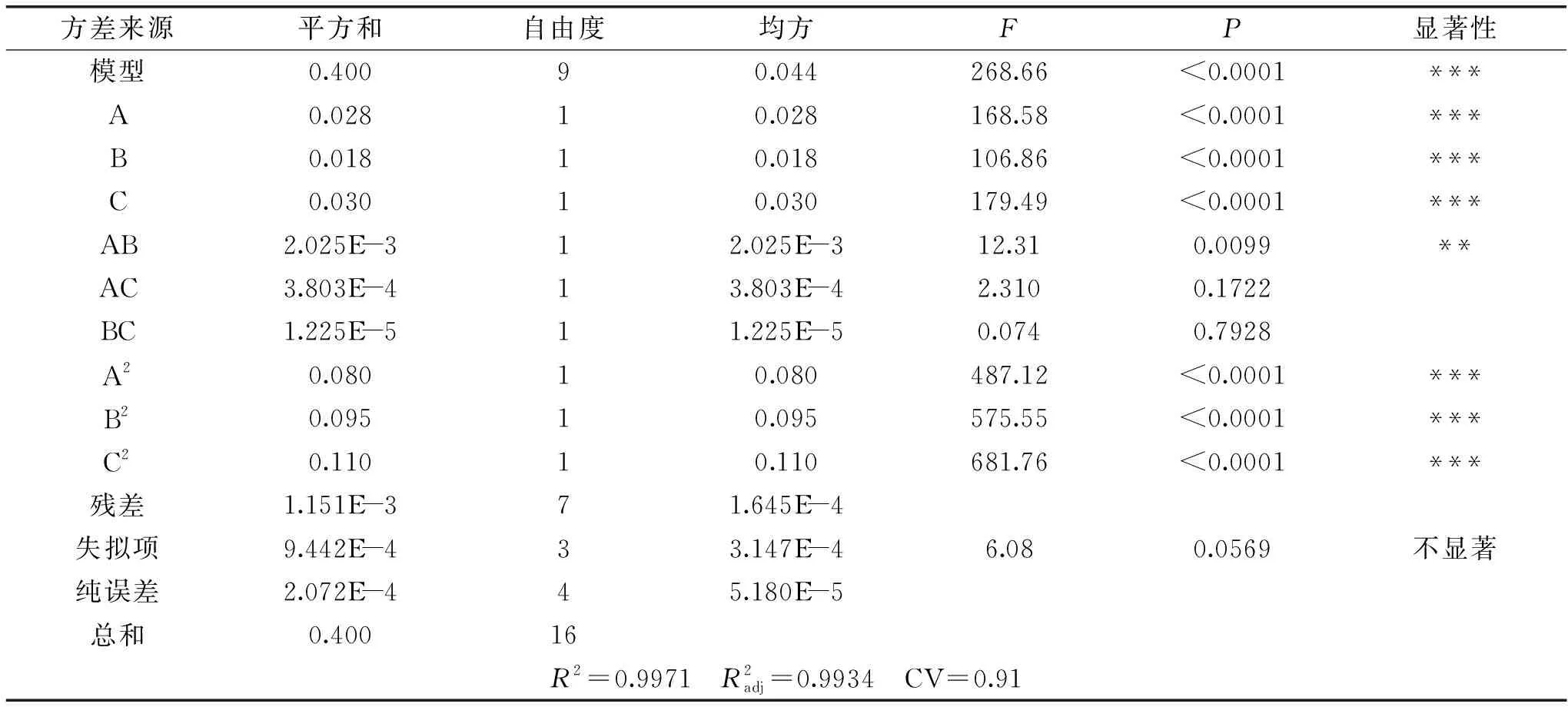
表3 响应面模型方差分析Table 3 Variance analysis of response surface model
2.2.3 各因素间交互作用分析 响应面图和等高线图可形象地反映各因素间的相互作用及最佳参数。等高线图呈椭圆形表示交互作用显著,呈圆形表示交互作用不显著。由图4a可知,在NaOH浓度为0.06 mol/L条件下,当皂化温度在54.0~62.5 ℃范围内,皂化时间在17~26 min范围内,番茄红素得率达到峰值,等高线图呈椭圆形,表明这两因素间交互作用显著;图4b为皂化时间恒定于20 min,NaOH浓度和皂化温度对得率的影响。当NaOH浓度在0.055~0.072 mol/L范围内,皂化温度在54~63 ℃范围内,番茄红素得率达到峰值,等高线图呈圆形,表示此两因素间交互作用不显著;当皂化温度恒定为60 ℃时,NaOH浓度和皂化时间对得率的影响如图4c所示,在NaOH浓度在0.055~0.072 mol/L及时间在17.5~26.0 min范围内,两者的共同作用下,番茄红素得率达到最大值,等高线图呈圆形,表明这两因素间交互作用不显著。

图4 番茄红素得率的响应面图Fig.4 Response surface stereogram of the extraction yield of lycopene
2.2.4 皂化提取番茄红素最佳工艺参数的确定 通过Design-Expert 8.0.6软件分析得到皂化提取番茄红素的最佳条件为:NaOH浓度0.06 mol/L,皂化温度58.05 ℃及皂化时间21.41 min,番茄红素得率的预测值为1.634 mg/g。对优化后的参数进行验证试验,考虑到操作的方便性,将试验条件修改为:NaOH浓度0.06 mol/L,皂化温度58 ℃及皂化时间21 min,通过三次平行试验得到番茄红素得率为(1.620±0.011) mg/g,与模型预测结果基本一致,比未皂化组(1.170±0.013) mg/g提高了38.46%。
2.3 体外抗氧化分析结果
2.3.1 番茄红素提取物对DPPH·清除能力 DPPH·是一种稳定的深紫色自由基,抗氧化剂可通过电子配对中和DPPH·从而发生显色变化,是最常用的抗氧化活性测定方法之一[26]。由图5可知,在试验浓度范围内,各物质对DPPH·的清除能力均随浓度的增大而增强,其清除能力顺序为β-胡萝卜素>番茄红素提取物>VC>VE。尽管粗糙脉孢菌番茄红素的清除能力低于β-胡萝卜素,但是β-胡萝卜素的抗氧化能力会随着外界条件的变化而变化,消失甚至转化为促氧化功能[27]。在此试验中,粗糙脉孢菌番茄红素最大清除率达86.43%,表明了对DPPH·具有较好的清除能力。

图5 四种物质对DPPH·清除效果Fig.5 Scavenging effects of the four substances on DPPH·

图6 四种物质对清除效果Fig.6 Scavenging effects of the four substances on
2.3.3 番茄红素提取物对·OH清除能力 ·OH是目前所知活性氧中活性最强的自由基,它能破坏细胞内大部分的生物大分子[31]。如图7所示,在试验浓度范围内,各物质对·OH的清除率与其浓度呈正相关性,其清除能力顺序为β-胡萝卜素>番茄红素提取物>VC>VE,此与DPPH·清除能力表现一致。有研究报道,类胡萝卜素更易通过自由基加成反应机制与自由基反应,即自由基通过直接加成至类胡萝卜素的共轭双键上形成一种新的化合物,从而达到清除自由基的目的[32]。尽管粗糙脉孢菌番茄红素对·OH清除能力比β-胡萝卜素弱,但最大清除率达85.83%,表明其对·OH具有较好的清除能力。

图7 四种物质对·OH清除效果Fig.7 Scavenging effects of the four substances on ·OH
2.3.4 FRAP法测定番茄红素提取物的抗氧化能力 FRAP法是一种非自由基氧化还原电位法来测定物质的抗氧化活性。由图8可知,各物质的抗氧化能力顺序为β-胡萝卜素>VC>番茄红素提取物>VE,粗糙脉孢菌番茄红素表现出较小的抗氧化能力,此与其它抗氧化试验结果差异较大。一方面可能是由于此种测定方法其本身与其它测定方法存在很弱的关联;另一方面在此反应体系中,为保持铁离子的溶解性及驱动电子转移,是在酸性条件下进行的(pH=3.6),而酸性环境对番茄红素稳定性有显著的破坏作用[33-34]。

图8 四种物质抗氧化能力的测定(FRAP法)Fig.8 Determination of antioxidant capacity offour substances(FRAP method)
3 结论
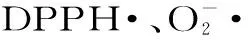
——基于正交试验优化的皂化反应法△

