农杆菌介导转化黑曲霉条件优化及脂肪酶表达
朱思远 , 徐 岩 , 喻晓蔚 *
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡214122;3.宿迁市江南大学产业技术研究院,江苏 宿迁223814)
黑曲霉被美国食品药品监督局(Food and Drug Administration,FDA) 定 义 为 基 本 安 全(Generally Recognized As Safe,GRAS)菌株[1],在食品工业中具有良好的应用前景。黑曲霉在工业酶制剂、有机酸发酵方面应用广泛,在工业、农业、医药以及基础生物学研究中具有重要作用[2]。
目前常见的转化丝状真菌的方法,包括农杆菌介导转化法、原生质体-PEG转化法、电转化法、限制酶介导转化法、脂质体转化法、醋酸锂转化法、基因枪转化法[3]等,各有优缺点。De Groot等[4]首先将农杆菌转化法应用于丝状真菌Aspergillus awarmori的转化,并证明了在原核生物和丝状真菌之间能够进行DNA转移,而且转化效率比泡盛曲霉常规的PEG转化方法提高了600倍。根癌农杆菌(Agrobacterium tumefaciens)是普遍存在于土壤中的一种革兰氏阴性细菌。在农杆菌转化中通常采用双元载体,一个是带有T-DNA的微型克隆质粒(mini-Ti载体),一个是带有Vir区的辅助质粒。根癌农杆菌将T-DNA转移进宿主细胞主要是依赖于辅助质粒上一系列vir基因的表达,而这些vir基因的表达受小分子的酚类和糖类物质的双重调节,诱导物乙酰丁香酮 (acetosyringone,AS)和羟基乙酰丁香酮(hydroxyacetosyringone,OH-AS) 在诱导 vir 基因活化过程中起主导作用[5]。一系列毒力蛋白的刺激活化使得在克隆载体上2个边界的底部链重复区(RBLB)断开,导致T-DNA的释放,并且继续在其它毒力蛋白的作用下将T-DNA进行运输转移,通过农杆菌细胞与宿主细胞之间的接触,将转移的TDNA靶向细胞整合到基因组中,从而实现基因的插入、靶向替换或者敲除的作用[6],见图1。
根癌农杆菌介导转化具有如下优点:1)转化操作简便,避免了原生质体制备过程中复杂的操作过程及其他方法中的设备要求[5];2)转化效率高,并且转化材料可用范围广,已有报道利用农杆菌介导转化可以成功转化分生孢子、菌丝体、原生质体及子实体[7];3)转化子大部分为单拷贝插入,便于进行遗传分析;4)重组子遗传稳定,同源整合效率高,可用于进行丝状真菌基因靶向敲除,重复性好,是一种有效的基因靶向工具[8-9]。不同种类的根癌农杆菌对于不同物种的侵染效率存在差异,并且不同的转化条件也会导致转化效率的不同[10-11]。与细菌及酵母等真菌不同的是,丝状真菌的转化中存在较为严重的假阳性问题,筛选板上生长的转化子并不一定为阳性,所以在优化条件获得较多转化子的同时也需要考虑阳性率。

图1 克隆质粒通过农杆菌介导转化丝状真菌原理Fig.1 Cloning plasmids were transformed to filamentous fungi by Agrobacterium mediation
作者利用2种根癌农杆菌介导转化黑曲霉,确定了转化黑曲霉的最适条件,并且分别构建了组成型启动子gpdA与诱导型启动子glaA表达同源黑曲霉脂肪酶的载体,通过农杆菌介导转化黑曲霉,利用罗丹明橄榄油平板初筛[12],快速确定产酶转化子。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 菌株:黑曲霉CICC2169、CICC2475、CICC2089,农杆菌 EHA105、AGL1,大肠杆菌JM109均由作者所在实验室保藏。
质 粒 :pCAMBIA1301-gpdA,pCAMPEP,pCAM RCL-glaA由作者所在实验室保藏。
1.1.2 培养基
1)LB培养基(1 L) 蛋白胨10 g,酵母提取物5 g,NaCl 10 g。
2)YEB培养基(1 L) 酵母提取物1 g,蛋白胨5 g,牛肉膏 5 g,蔗糖 5 g,MgSO4·7H2O 0.493 g;pH 7.0,固体培养基中加入琼脂2 g/dL。
3)PDA培养基 (1 L) 称取37 gPDA粉末,定容至1 L。
4)IM 诱导培养基 (1 L)[13]K2HPO42.05 g,KH2PO41.45 g,(NH4)2SO40.5 g,MgSO4·7H2O 0.5 g,NaCl 0.15 g,CaCl20.066 g,FeSO4·7H2O 0.002 48 g,葡萄糖1.8 g,甘油5 mL,蒸馏水定容至940 mL;在121℃条件下湿热灭菌20 min,待冷却至50℃时加入 40 mL、1 mol/L 2-(N-吗啡啉)乙磺酸(MES),1 mL、200 mmol/L乙酰丁香酮(AS)。在上述配方中补加琼脂粉15 g为诱导固体培养基(IMA),试管液体配方同上,用前加入MES及AS至所需量。
2-(N-吗啡啉)乙磺酸母液(MES)(1 mol/L):用天平称取 19.52 g 2-(N-吗啡啉)乙磺酸(MES),加入80 mL蒸馏水,用KOH溶液(5 mol/L)调节至 pH 5.3,100 mL容量瓶定容,用0.22 μm滤膜过滤除菌,-20℃保存。
乙酰丁香酮母液 (AS)(200 mmol/L): 称取0.196 2 g乙酰丁香酮,用5 mL二甲基亚砜(DMSO)溶解,0.22 μm有机滤膜过滤除菌,-20℃保存
5)罗丹明橄榄油平板(1 L) KCl 0.5 g,K2HPO41 g,NaNO33 g,MgSO40.5 g,葡萄糖 2.5 g,淀粉 2.5 g,麦芽糖2.5 g,橄榄油乳化剂 10 mL,罗丹明母液1 mL(母液 0.01 g/mL)。橄榄油乳化剂为V4%PVA∶V橄榄油=3∶1。
1.1.3 主要试剂 潮霉素hyg、利福平Rif、头孢噻肟cefo、乙酰丁香酮:购自上海生工公司;Primestar HS、限制性内切酶等:购自Takara公司。
1.2 方法
1.2.1 黑曲霉潮霉素敏感度测试 利用潮霉素为筛选标记,首先对作者所在实验室保藏的3株黑曲霉(CICC2169、CICC2475、CICC2089)进行潮霉素抗性敏感度测试。配制PDA平板,分别添加潮霉素hyg 抗性, 使终质量浓度为 100、200、300、400、500μg/mL。将黑曲霉分别点种到不同hyg抗性的平板上。
1.2.2 农杆菌转化条件的确立及优化 图2所示为农杆菌转化的基本流程,初始转化条件如下:
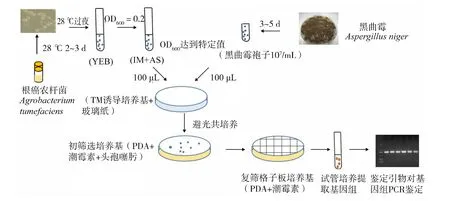
图2 农杆菌转化基本流程示意图Fig.2 Process of Agrobacterium-mediated transformation
1)黑曲霉孢子准备 将黑曲霉在平板上培养5 d,使其充分产孢。利用生理盐水洗下孢子利用4层擦镜纸过滤,利用血球计数板计数,使孢子浓度在107个/mL备用。
2)农杆菌准备与预培养 将质粒通过冻融法转化[14]农杆菌中,含有双元载体的农杆菌,在平板上划线活化后转接YEB试管中培养24 h,进行农杆菌的预培养,转接至IM+AS试管中使其OD600在0.2左右,培养至OD600为0.7备用。
3)黑曲霉与农杆菌共培养 将准备好的黑曲霉和农杆菌,各取100 μL进行充分混合,均匀涂布于含有玻璃纸的IM+AS平板上。置于22℃下避光共培养36 h,转膜至初筛培养基上培养,初筛培养基上添加潮霉素及头孢噻肟。初筛板生长的转化子转接至复筛格子板进行传代复筛。
对以下条件进行优化:共培养材料(萌发与非萌发孢子)、两种农杆菌(AGL1与EHA105)的转化效率进行比较、诱导剂乙酰丁香酮浓度 (0~400 μmol/L)、共培养温度(17~26 ℃)、农杆菌共培养时的 OD600值(0.5~1.0 以上)、共培养时间(12~72 h)。
1.2.3 脂肪酶表达载体构建 构建黑曲霉脂肪酶ANL表达载体,分别以组成型启动子甘油醛-3-磷酸脱氢酶(gpdA)和诱导型启动子糖化酶基因启动子(glaA)来启动脂肪酶基因的表达。首先基于NCBI对于黑曲霉脂肪酶基因进行查找,设计引物P1-P8,以黑曲霉基因组为模板,扩增出包含3段内含子的ANL脂肪酶基因序列,后通过重叠延伸PCR去除ANL中的内含子序列,将4段ANL拼接,可获得除去内含子的ANL基因。构建过程用到的引物见表1。
1)组成型启动子gpdA表达载体构建 以pCAMPEP质粒为载体构建组成型表达载体pCAMANL-gpdA,包括将表达基因替换为黑曲霉脂肪酶ANL基因,以及将原有潮霉素基因hyg启动子CaMV35S替换为gpdA,构建过程见图3。

表1 引物表Table 1 Primer table

图3 pCAMANL-gpdA表达载体构建示意图Fig.3 Construction of pCAMANL-gpdA expression vector
2)诱导型启动子glaA表达载体构建 以pCAMRCL-glaA质粒为模板构建诱导型表达载体pCAMANL-glaA。将proRCL基因通过ApaI和BglⅡ酶切连接替换为ANL基因,构建流程见图4。其中pCAMRCL-glaA的启动子PglaA序列是以黑曲霉2475基因组为模板,扩增PglaA+glaA信号肽序列,并在信号肽后加入kex2酶切位点。
1.2.4 转化子鉴定 转化子在初筛生长后转至复筛格子板复筛,通过复筛生长的转化子,转接土豆葡萄糖试管培养生长,提取基因组进行鉴定,黑曲霉基因组提取采用苯酚氯仿抽提法[15]。转化子基因组利用引物P12、P14和引物P12、P15进行鉴定,确定是否有目标条带。将转化子接种罗丹明橄榄油平板,初步确定产酶情况。
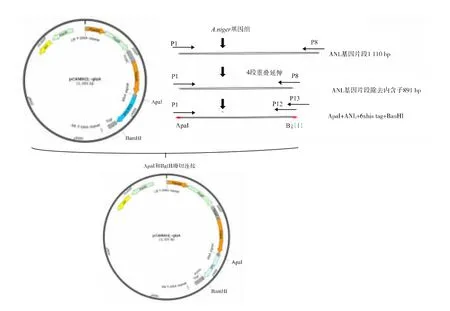
图4 pCAMANL-glaA表达载体构建示意图Fig.4 ConstructionofpCAMANL-glaA expression vector
2 结果与讨论
2.1 黑曲霉的潮霉素抗性敏感度测试
利用潮霉素为筛选标记,首先对实验室保藏的3株黑曲霉CICC2169、CICC2475和CICC2089进行了潮霉素抗性敏感度测试,结果见表2。CICC2475、CICC2089对于潮霉素有着较高的耐受性,对潮霉素不敏感,会导致筛选困难。CICC2169对于潮霉素有较高的敏感度,野生型菌株在200 μg/mL的条件下不生长,因此选择黑曲霉CICC2169作为转化的宿主菌。
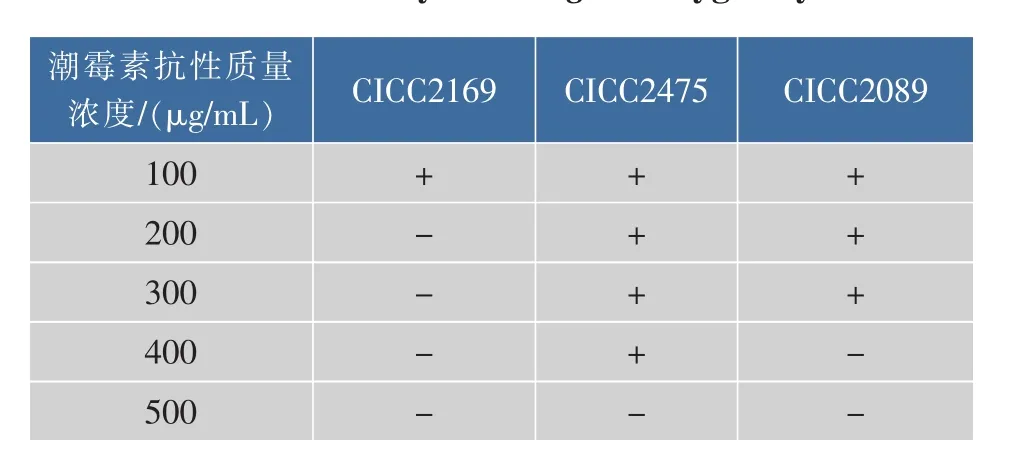
表2 3株黑曲霉潮霉素抗性敏感度测试Table 2 Sensitivity of A.niger to hygromycin B
2.2 农杆菌转化黑曲霉的条件优化
将质粒pCAMBIA1301-gpdA转化农杆菌,获得阳性克隆,然后考察阳性农杆菌转化黑曲霉的最适条件。分别对于共培养材料的选择、EHA105农杆菌和AGL1农杆菌转化效率、诱导剂乙酰丁香酮浓度、共培养温度、共培养过程中农杆菌初始OD值、共培养时间进行优化,并且从转化子个数和阳性率2个方面评估最佳条件。
选择共培养材料,分别以不萌发的黑曲霉新鲜孢子和刚萌发孢子进行比较,结果表明,萌发孢子进行共培养转化时,黑曲霉的生长速度明显快于农杆菌,导致后续筛选中假阳性较高,而以不萌发孢子为转化材料时,两者的生长可基本平衡,获得的转化子90%以上均为阳性转化子,因此后续实验以不萌发的新鲜孢子为共培养材料。许多已报道的文献是选择萌发的黑曲霉孢子进行实验[16],萌发的孢子已破壁生长,原理上更容易被农杆菌侵染,但在本研究中效果并不明显,而且会导致较高的假阳性。
考察两种农杆菌转化黑曲霉的效率。将农杆菌EHA105/pCAMBIA1301-gpdA和AGL1/pCAMBIA 1301-gpdA向黑曲霉CICC2169转化。如图5所示,利用农杆菌AGL1获得的转化子个数约是利用农杆菌EHA105获得的转化子个数的14倍。所以,选择农杆菌AGL1进行后续转化实验。
优化了诱导剂乙酰丁香酮(AS)的浓度,分别为0、100、200、300、400 μmol/L。以 AGL1/pCAMBIA1301-gpdA进行介导转化,在其他条件相同的情况下,进行培养,结果见图6。不添加AS时,没有获得转化子,在200 μmol/L和300 μmol/L的条件下转化率都相对较高,且差异不大,因此选择200 μmol/L为AS诱导浓度。
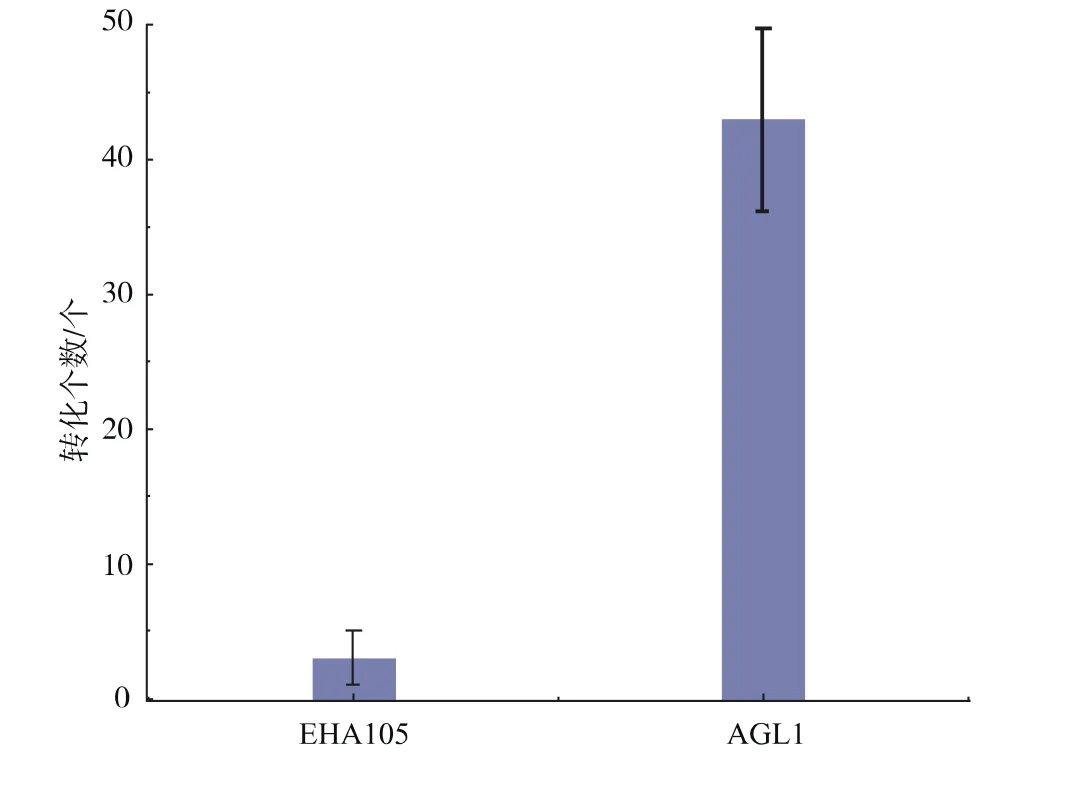
图5 农杆菌转化效率比较Fig.5 Effect of Agrobacterium species on transformation efficiency
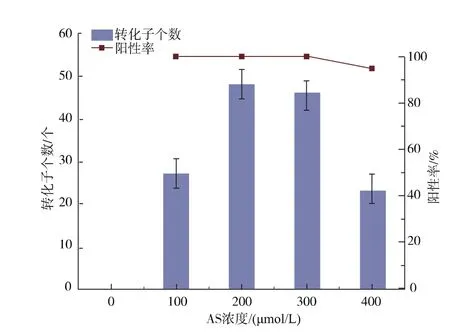
图6 不同浓度AS转化效率比较Fig.6 Effect of concentration of AS in inducing medium on transformation efficiency
对共培养温度进行优化,在AS浓度为200 μmol/L 的条件下,分别以 17、20、23、26 ℃为温度梯度进行共培养。以AGL1/pCAMBIA1301-gpdA进行介导转化,结果见图7。随着温度的升高,转化子个数逐渐增多,但是在利用26℃培养时,孢子萌发速度较快,黑曲霉生长较快,结束共培养时已经有大量菌丝生长,产生连片现象,后期生长出的转化子有较高的假阳性,因此我们选择23℃作为共培养温度。
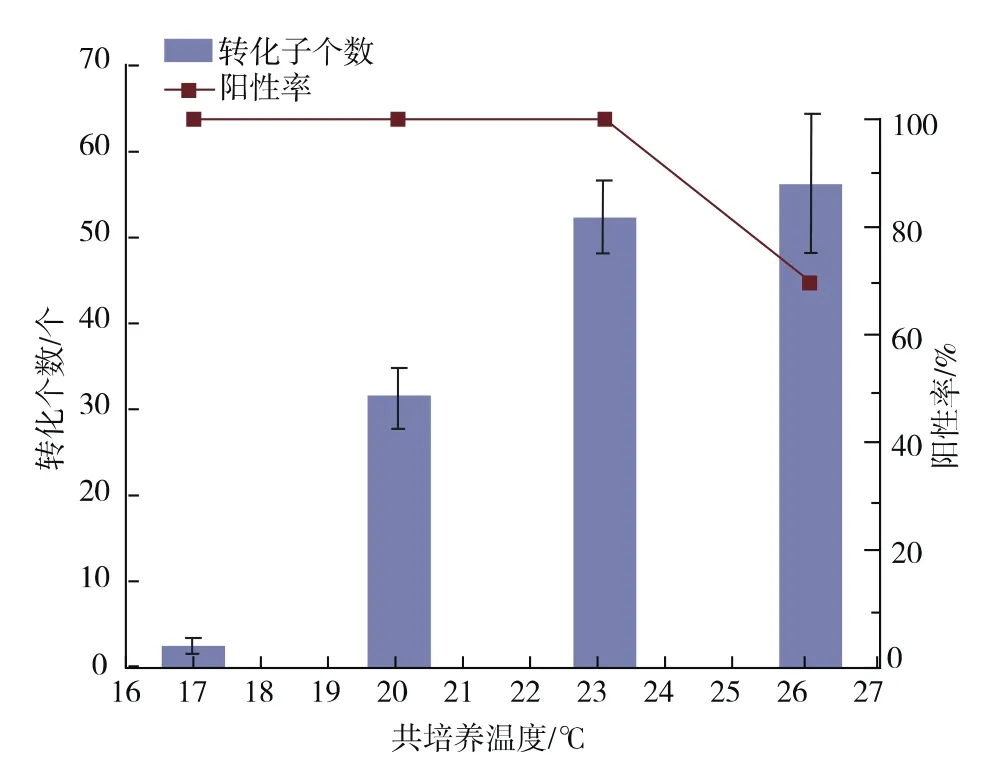
图7 共培养温度优化Fig.7 Effect of co-culture temperature on transformation efficiency
对于共培养过程中农杆菌初始OD600值进行优化,以AGL1/pCAMBIA1301-gpdA进行介导转化,结果见图8。在AS浓度为200 μmol/L、共培养温度23℃的条件下,农杆菌生长到OD600为0.9~1.0,此时进行共培养所获得转化子个数较多,并且保持较高的阳性率。

图8 共培养初始农杆菌OD600优化Fig.8 Effect of Agrobacterium OD600during co-culture on transformation efficiency
对共培养时间进行优化,在AS浓度为200 μmol/L,以23℃的共培养温度,初始农杆菌OD600为0.9~1.0 之间,共培养时间设有 12、24、36、48、60、72 h,结果见图9。12 h没有获得转化子,在24~48 h内,随着时间的增加转化子个数逐渐增加,培养60 h和72 h时,共培养结束时已经产生较多(60 h)以及满板(72 h)的菌丝,转化培养时转化子个数不可计,并且阳性率明显下降,因此选择48 h为共培养时间。

图9 共培养时间优化Fig.9 Effect of co-culture time on transformation efficiency
实验结果表明,适合CICC2169的转化条件为,不萌发的新鲜孢子与OD600培养至0.9~1.0的农杆菌以1∶1的比例混合后,在AS浓度在200 μmol/L的IM平板上,23℃避光培养48 h后进行转膜。最佳转化效率为(60±5)个转化子/106个孢子,并且阳性率保持在90%以上。
2.3 脂肪酶表达载体的构建
以黑曲霉CICC2475基因组为模板,扩增ANL基因1 110 bp,此时基因含有内3段含子序列,通过重叠延伸PCR将内含子去除,获得891 bp的片段,结果见图10。

图10ANL基因PCR电泳图Fig.10 ANL gene
按照以上方法进行转化子构建,构建完成的转化子利用引物P11,P13进行鉴定。挑选条带大小正确的转化子测序,结果正确,黑曲霉脂肪酶基因ANL组成型启动子pCAMANL-gpdA表达载体和诱导型启动子pCAMANL-glaA表达载体构建完成。
2.4 阳性转化子鉴定及转化子产酶初筛
将构建完成的2种表达载体分别通过冻融法转化至农杆菌AGL1中获得AGL1/pCAMANL-gpdA和AGL1/pCAMANL-glaA,并利用优化后的方法将AGL1/pCAMANL-gpdA和AGL1/pCAMANL-glaA分别转化黑曲霉CICC2169中,获得的阳性转化子分别命名glaA-ANL和gpdA-ANL,初筛平板为 PDA+200 μg/mL hyg+100 μg/mL cefo, 复筛平板为PDA+200 μg/mL hyg,转化子进行3次传代后,提取基因组进行转化子鉴定。glaA-ANL转化子利用引物P12、P15进行鉴定,条带大小为2 111 bp为阳性转化子,gpdA-ANL转化子利用引物P12、P14进行鉴定,条带大小为1 615 bp为阳性转化子,见图11。
将阳性转化子转接至罗丹明橄榄油平板进行产酶初筛。对于黑曲霉脂肪酶ANL转化子进行罗丹明橄榄油平板鉴定,转化子大多出现了明显的水解圈,而对照原始菌并没有红色水解圈出现,由于插入位置的不同,导致不同的转化子可能有不同的产酶水平。其中组成型启动子gpdA转化子的水解圈比诱导型启动子glaA转化子更加明显,见图12。

图11 转化子基因组鉴定Fig.11 Identification of transformants
3 结 语
在本研究中,对农杆菌介导转化黑曲霉的共培养条件进行了优化,最终确定条件为107个/mL不萌发的新鲜孢子与OD600培养至0.9~1.0的农杆菌以 100 μL∶100 μL 的比例混合后,在 AS 浓度在 200 μmol/L的IM平板上,23℃避光培养48 h后进行转膜至含有头孢噻肟的初筛平板,其中头孢噻肟的作用为杀死农杆菌,在共培养结束后及时杀死农杆菌,避免由于农杆菌过量生长抑制转化子生长。有报道[17]以硝化纤维膜作为膜材料进行培养效果最好,但是价格较为昂贵,本过程中以较廉价的转膜材料玻璃纸进行直接转膜培养,不采用倒置反贴的过程,不仅缩短农杆菌转化时间进程,还减少了转化子损失。但是宿主菌和农杆菌的种类不同,可能会存在不同的转化效率及阳性率[11]。
在进行脂肪酶的表达初试中,采用罗丹明橄榄油平板对于产酶转化子进行了初筛,表达的脂肪酶通过水解橄榄油产生脂肪酸,脂肪酸会与罗丹明相互作用而显色,颜色越深并且水解圈越大,表明脂肪酶表达量越高。转化黑曲霉脂肪酶ANL基因的阳性克隆在平板上有较明显的显色,由于农杆菌介导转化进行基因插入的位置是随机的,所以可能导致产酶水平存在差异,可以通过转化子显色圈的颜色和大小进行较为直观的活性筛选。对照菌株本身内源产少量脂肪酶,但是由于表达量过低,并不显色及产生水解圈。在黑曲霉中进行基因的表达,可能会受到密码子偏好性、转录水平或翻译等不同方面的影响,在接下来的工作中,我们将重点提高目标基因的表达量。

