食醋酿造过程中条件致腐微生物的分离鉴定及强产气菌群TYF-LIM-L09的生长特征
李 敏, 李 瑶, 赵 魁, 王 鹤, 何永吉, 范晓军*
(1.太原理工大学 化学化工学院,山西 太原 030024;2.太原市宁化府益源庆醋业有限公司,山西 太原 030000;3.山西省农业科学院 农产品加工研究所,山西 太原 030006)
食醋是使用含有淀粉、糖的物料或酒精,经微生物发酵酿造或用食用醋酸调制而成的酸味调味品或食品。在亚洲国家,人们偏好使用温和、有甜味的谷物醋来作为面条和寿司的主要调味料,而在欧洲和美洲人们喜爱食用以水果为原料生产的果醋[1-2]。食醋的主要成分除了醋酸外,还含有氨基酸、有机酸、糖类、维生素、矿物质、醇类、酯类等营养成分和风味成分[3-5]。食醋的营养成分和品质与发酵过程中的微生物代谢密切相关[6-7]。近年来,我国食醋生产企业在夏季高温气候条件下时常出现微生物污染情况,且通常伴随着成品醋返浑、发粘、胀气等腐败现象[8-11],严重地影响着食醋的营养成分和品质。
为了深入了解食醋酿造过程中发生的高温条件致腐机制,国内一些高校、科研院所和企业对腐败醋样中污染微生物及营养成分进行了初步研究。中国食品发酵工业研究院程池等通过使用PCRDGGE技术比较了正常醋样和污染醋样的微生物群落结构,并在此基础上对两种醋样的微生物进行了分离纯化和鉴定,得出了污染菌为耐酸乳杆菌的结论[12]。此外,武汉轻工大学周帼萍等通过显微形态观察与16S rRNA序列分析从变质醋样中鉴定出了头状葡萄球菌和少量解淀粉芽孢杆菌,该课题组通过电子舌测试得出变质醋中酸度和咸度略有下降,苦味和鲜回味大幅降低,苦回味和涩回味减少等结论[13]。2017年曹晋宜等科研工作者对比分析了发粘食醋和正常食醋的感官指标、理化指标、香气成分,结果显示发粘食醋中总酸、乳酸、乙醇含量明显上升,而还原糖、总酯、糠醛含量明显下降。该研究小组通过传统培养与16S rDNA序列同源性分析方法,并结合微生物宏基因组分类测序方法得出了引起食醋发粘的微生物主要是牛痘乳杆菌的结论[14]。以上各研究结论并不一致,也未深入分析分离菌株的耐热特性及原因,研究结论仍不能准确地解释食醋发酵生产中仅在高温时节出现腐败现象,食醋酿造行业内研究者亦难以从中获得一致性指导建议。究其原因,腐败变质醋样本数量、分离条件及可靠的分析测试平台的选择都会影响相关研究结果。
乳酸杆菌是一类能使糖类发酵产生乳酸的益生菌,在人体内起着调节免疫功能的作用。乳酸杆菌存在广泛,其最适生长pH为5.5~6.0,但在pH 3.0~4.5的强酸性环境中仍能生存[15-19],这与食醋酿造过程中醋酸发酵阶段的酸性环境pH 3.5~4.5相一致[20],但是乳酸杆菌对高温耐受能力相对较弱,能够耐受43℃以上高温条件的乳酸杆菌更鲜有报道[21-22]。夏季高温时节醋酸酿造过程中醋醅中心最高温度可达48~50℃[23],通常状况下乳酸杆菌并不能耐受这样的高温条件[24],因此对条件致腐分离株的耐高温特性研究十分必要。此外,食醋酿造腐败现象不仅发生在醋酸发酵阶段,高温条件下酒精发酵阶段也偶有发生,对筛选菌株的酒精耐受研究亦不容忽视。
在本研究中,课题组从5个不同批次的腐败醋样中分离获得了46株细菌及4个稳定菌群,其中编号为TYF-LIM-L09的菌群在多种培养条件下均表现出明显的产气现象,因此对其进行了微生物宏基因组分类测序,并分析了该菌群的生长特征、温度和乙醇耐受、产气能力及关键酶活性特征,以期对食醋酿造高温条件致腐微生物有更全面、深入的认识。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株 5个不同批次的腐败醋样中分离获得46株细菌及4个菌群;大肠杆菌BL21、地衣芽孢杆菌PWD-1为作者所在实验室保存菌株。
1.1.2 MRS培养基(g/L) 蛋白胨 10,牛肉粉 8,酵母粉4,葡萄糖20,磷酸二氢钾2,柠檬酸氢二铵2,无水乙酸钠5,硫酸镁 0.58,硫酸锰 0.19,琼脂 14;吐温-80 1 mL,115℃灭菌20 min。
1.1.3 试剂 蛋白胨、酵母粉:英国OXOID公司;牛肉粉、柠檬酸氢二铵、葡萄糖、吐温-80:北京博奥拓达科技有限公司;乙酸钠、硫酸镁、磷酸氢二钾、硫酸锰、无水乙醇、糠醛:均为分析纯,天津科密欧化学试剂有限公司;琼脂粉、氨苄青霉素、溴化乙锭、27F、1492R通用引物、烟酰胺腺嘌呤二核苷酸(Nicotinamide adenine dinucleotide,NADH)、β-烟酰胺腺嘌呤二核苷酸 (Diphosphopyridine nucleotide,NAD+):生工生物工程 (上海)股份有限公司;Taq DNA聚合酶、10×Taq缓冲液、dNTP、细菌基因组DNA提取试剂盒:北京天根生化科技有限公司;琼脂糖:美国invitrogen公司;DNA Marker:北京全式金公司;PCR产物纯化试剂盒:BIOBASIC公司;丙酮酸激酶(pyruvate kinase,PK)测定试剂盒:上海索莱宝生物科技有限公司;CO2气体检测管:北京北科绿洲安全环境科技有限公司。
1.2 仪器与设备
Alphalmager HP型凝胶成像分析仪:美国proteinsimple公司;Multiskan GO型全波长酶标仪:美国赛默飞世尔公司;Mastercycler pro S型PCR仪:艾本德中国有限公司;BT 124S型电子天平:德国赛多利斯股份公司;PB-10型pH计:德国赛多利斯股份公司;YXQ-LS-30S2型立式压力蒸汽灭菌锅:上海博讯实业有限公司;DYCZ-24DN型迷你水平电泳:北京市六一仪器厂;JY 92-IIN型超声波细胞粉碎机:宁波新芝生物科技股份有限公司;DHACA型大容量振荡器:太仓市实验设备厂;HC-3018型高速冷冻离心机:安徽中科中桂科学仪器有限公司;DYY-10C型电泳仪:北京市六一仪器厂。
1.3 方法
1.3.1 腐败微生物的分离与鉴定 取10 mL腐败成品醋离心浓缩至200 μL,涂布至MRS培养基上,37℃培养24~48 h至出现肉眼可见的菌落后,挑取单菌落扩大培养并使用基因组提取试剂盒分别提取各分离菌的基因组。用通用引物27F、533R和1492R对单菌落进行16S rDNA扩增,扩增产物进行Sanger测序,将测序结果在NCBI数据库中Blast同源比对检索,查找与被测菌种在16S rDNA序列相似性最高的物种。
1.3.2 菌群TYF-LIM-L09的宏基因分类测序分析取1 mL TYF-LIM-L09培养菌液,12 000 r/min离心1 min后,用细菌基因组抽提试剂盒提取沉淀中的细菌总DNA。用通用引物338F和806R扩增细菌基因组16S的V3+V4区,扩增引物序列参见表1。扩增产物建库质检合格后,在Miseq高通量测序仪进行PE 300 bp双端测序。对高通量测序数据进行过滤、拼接后,进行OUT聚类分析,挑选相似度大于90%的序列归为一类OTU,进而对被测样品中分属不同OTUs的序列数进行统计,分析样品中对应的菌群组成。
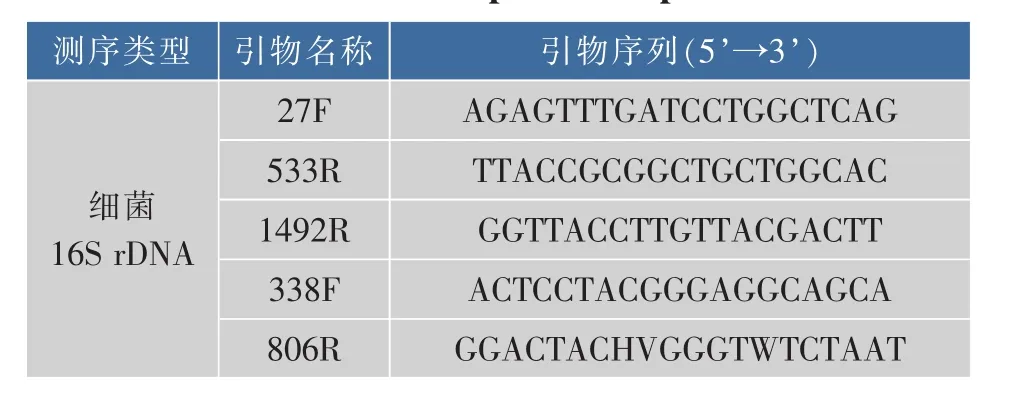
表1 细菌16S rDNA PCR扩增引物Table 1 16S rDNA PCR amplification primers of bacteria
1.3.3 菌群TYF-LIM-L09的温度、乙醇及pH耐受特征 将TYF-LIM-L09菌液以2%的接种体积分数接种到50 mL的MRS液体培养基中,分别放置于设定温度为 30、37、40、45、50 ℃,转速为 200 r/min的振荡培养箱中培养,监测各培养物的OD600数值与培养时间的关系。按照以上接种体积分数,温度为37℃,转速为200 r/min的条件下,分别在初始pH 值为6.2±0.2,乙醇体积分数为 0%、2%、4%、6%、8%、10%的MRS液体培养基以及在不含乙醇,初始pH 值为 5.0、5.5、6.5、7.0、7.5 的 MRS 液体培养基中培养TYF-LIM-L09,分别监测各培养物的OD600数值与培养时间的关系。
1.3.4 菌群TYF-LIM-L09的产气检测分析 将菌液以10%的接种体积分数接种到50 mL的MRS液体培养基中,封口放置于37℃、200 r/min的振荡培养箱中培养24 h,次日使用CO2气体检测管检测产气量,大肠杆菌和地衣芽孢杆菌为对照菌。
按同样的接种体积分数分别在乙醇体积分数为0%、2%、4%、6%、8%、10%的MRS液体培养基中培养TYF-LIM-L09;另外分8个梯度在pH 4.0~7.5的MRS液体培养基中培养强产气菌TYF-LIML09,封口放置于37℃、200 r/min的振荡培养箱中培养24 h,次日使用CO2气体检测管检测产气量,分析乙醇、pH值对TYF-LIM-L09产气量的影响。
1.3.5 TYF-LIM-L09的关键酶活性测定 粗酶液的处理:待OD600值达到1.2时收集TYF-LIM-L09培养菌液,加入pH 7.4的PBS缓冲液后破碎菌体,离心取上清液获得粗酶液。
1)丙酮酸激酶酶活测定 用试剂盒测定丙酮酸激酶活力,具体操作方法根据试剂盒的说明书进行。
2)丙酮酸脱羧酶酶活测定 在200 μL体系中加入pH 6.0、100 mmol/L磷酸缓冲液,1 mol/L丙酮酸钠溶液,6.4 mmol/L NADH,3.5 μL粗酶液, 在波长340 nm处检测反应液5 min内每分钟吸光度值的变化。
3)醇脱氢酶酶活测定 在200 μL体系中加入pH 9.0、0.05 mol/L甘氨酸-氢氧化钾缓冲液,0.1 mol/L 糠醛溶液,0.1 mol/L NADH,10 μL 粗酶液,在波长340 nm处检测反应液5 min内每分钟吸光度值的变化。
酶活单位定义:1酶活单位(1U)等于每分钟氧化 1 μmol NADH 生成 1 μmol NAD+的酶量。
2 结果与讨论
2.1 腐败微生物的分离与鉴定
课题组选取了5个不同批次的腐败醋样,编号为 TYF、TYH、TYJ、TYK 和 TYM,相关理化指标见图1。将从以上腐败醋样中分离获得的50株细菌的16S rDNA测序结果与NCBI数据库中GENBANK做同源比对检索,得出鉴定结果,具体见表2。分离获得的菌株中44株菌来自8个已知属,分别为鲁梅利杆菌属、肠球菌属、漫游球菌属、乳酸杆菌属、芽孢杆菌属、葡萄球菌属、短波单胞菌属和类芽孢杆菌属,另外2株分离菌株尚无已知定义属。此外,在对分离到的单菌落进行16S rDNA测序分析时发现,有4个的结果显示为套峰,说明这4个单菌落在组成上可能形成了固定群落,因此根据其主峰仅对其进行了属归类。
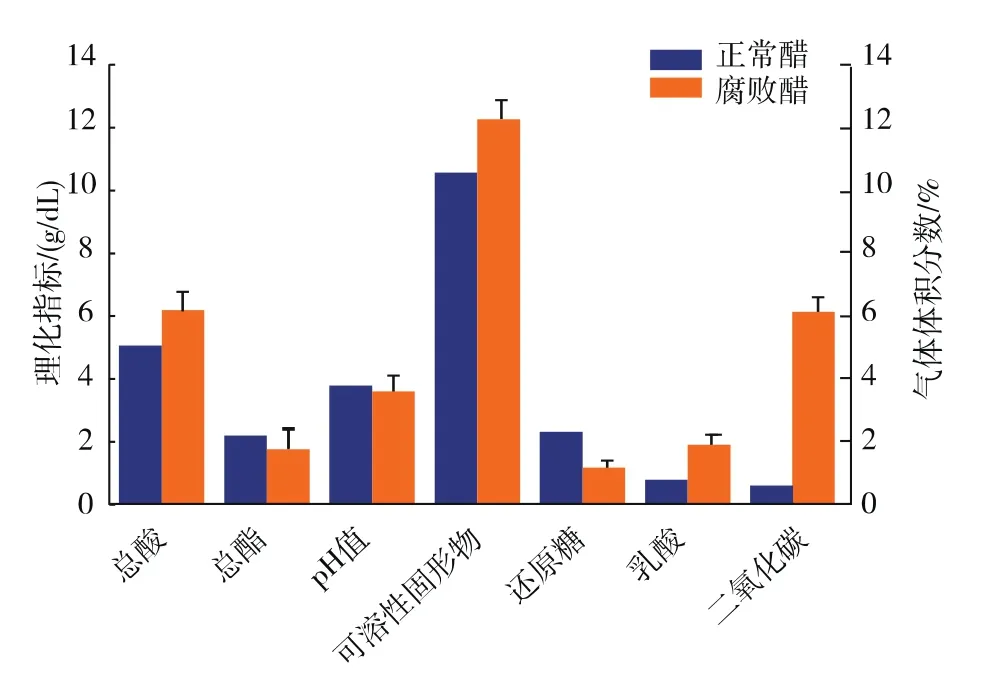
图1 正常醋样与腐败醋样的理化指标Fig.1 Physicochemical indicators of normal and spoiled vinegar samples
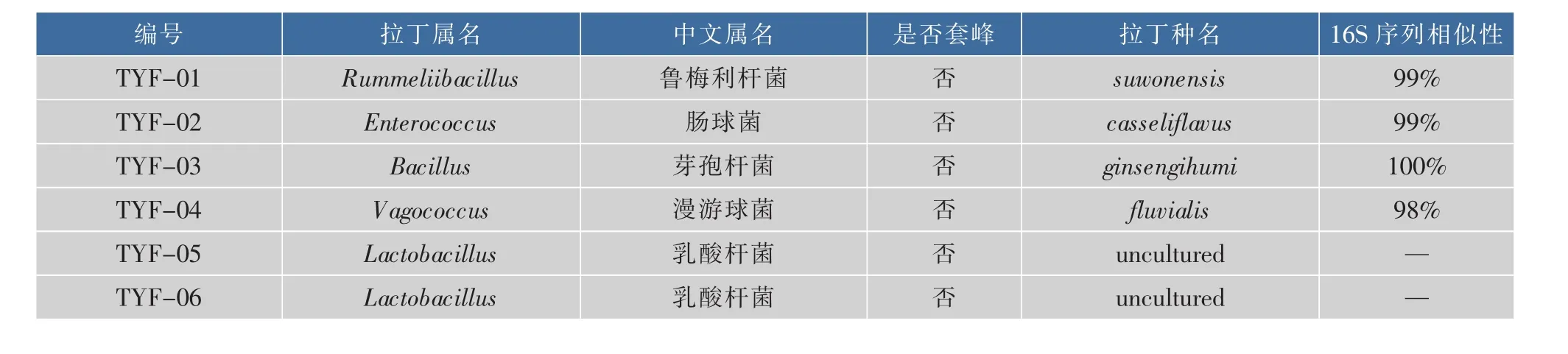
表2 腐败样醋中分离菌株的16S rDNA BLAST序列分析结果Table 2 BLAST results of 16S rDNA sequences of selected bacteria from spoiled vinegar
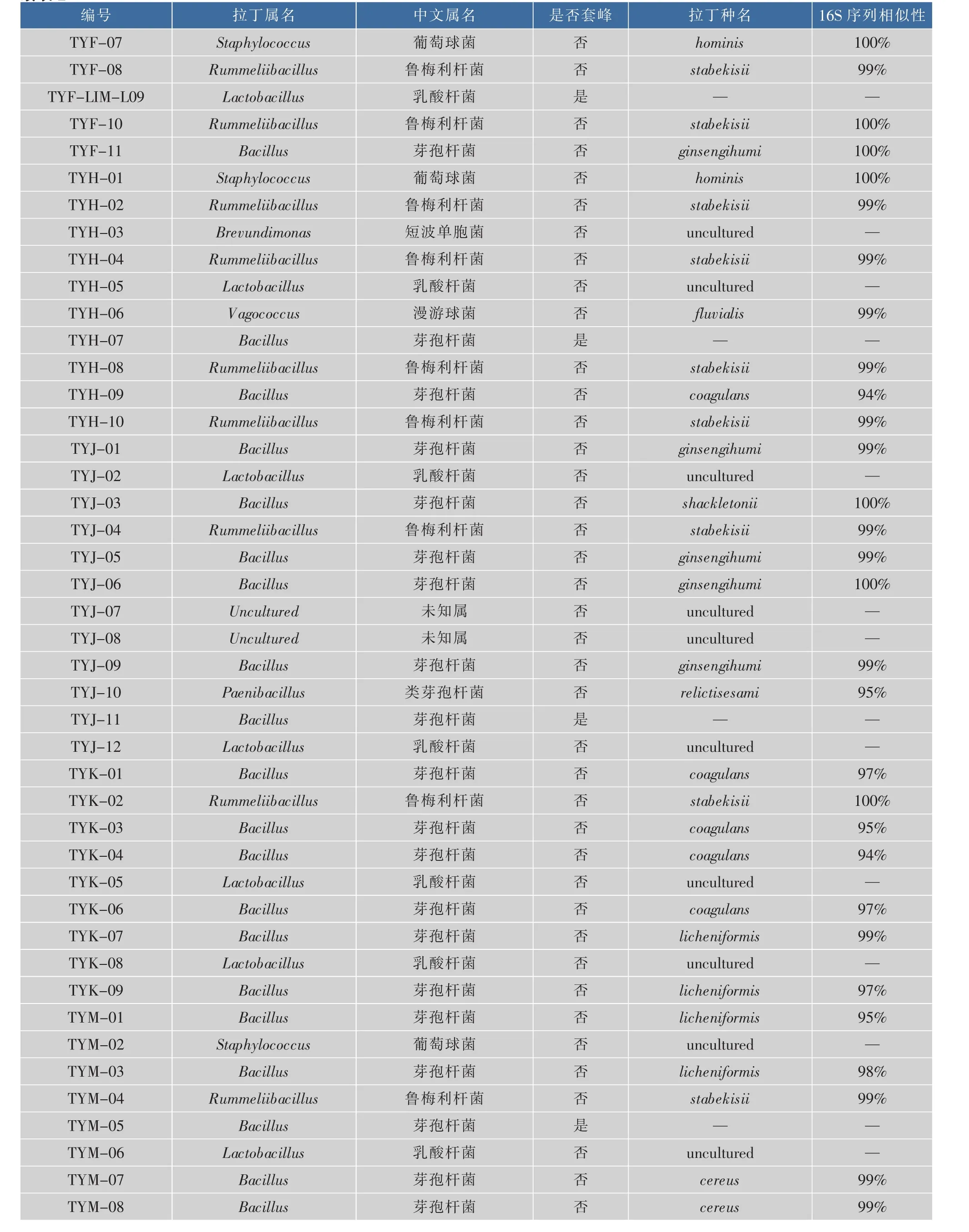
续表2
2.2 菌群TYF-LIM-L09的强产气现象与宏基因组分类测序分析结果
在培养TYF-LIM-L09的过程中观察到了明显的产气现象,见图2,据此推断该菌为夏季高温条件致腐关键微生物。但经数次划线分离培养后其16S rDNA PCR产物测序结果依旧显示为套峰,推测其为稳定的微生物群落,鉴于此,采用微生物宏基因组分类测序方法对其进行了分析。分析结果显示,TYF-LIM-L09确实为共生菌群,其中优势菌集中于厚壁菌门(50.4%)和变型菌门(17.57%),其中乳酸杆菌属微生物最高达45.77%,见表3。

图2 TYF-LIM-L09培养过程中的产气现象Fig.2 Gas production of TYF-LIM-L09 during the cultivation process

表3 菌群TYF-LIM-L09宏基因组分类测序分析Table 3 Metagenomic analysis of bacterial consortium TYF-LIM-L09
2.3 菌群TYF-LIM-L09的温度、乙醇及pH耐受实验结果
在研究温度与TYF-LIM-L09生长特征关系时发现,对数生长期50℃时菌体生长最快,而30℃时培养10 h后菌体才开始快速生长;培养20 h后45℃生长的菌体OD值最大,说明该温度条件下生物量积累最高,见图3。TYF-LIM-L09对乙醇的耐受实验结果显示,随着培养基中乙醇体积分数的增高,菌体的生长受到更大程度的抑制。当乙醇体积分数为2%时,菌体生长与对照组相比无明显变化;4%和6%时菌体生长速率明显降低,体积分数达8%时菌体的最大OD值为0.868,是对照组的46.1%,乙醇体积分数10%时TYF-LIM-L09无生长现象。综合该菌对乙醇的耐受特征,其能耐受的乙醇体积分数可高达8%,具有很好的酒精耐受能力[25]。随着培养基pH值降低,菌体的生长受到不同程度的影响,其中在pH 5.5的培养基中,菌体在培养8 h后才开始生长,生长速率与pH≥6.0的培养基相比生长缓慢。在pH 5.0的培养基中未检测到菌体生长,说明该菌能耐受的pH值为5.5。

图3 在不同温度、乙醇体积分数以及pH培养条件下TYF-LIM-L09的生长特征Fig.3 Growth characteristics of TYF-LIM-L09 under different temperatures,alcohol concentrations and pH values
2.4 TYF-LIM-L09的产气检测分析
在 37 ℃、pH 6.2±0.2、200 r/min的条件下使用MRS液体培养基培养TYF-LIM-L09、大肠杆菌BL21、地衣芽孢杆菌PWD-1,24 h后检测产气量。TYF-LIM-L09产气现象十分突出,经检测产生的气体为CO2,体积分数高达71.43%;而大肠杆菌BL21、地衣芽孢杆菌PWD-1产生的CO2体积分数分别为0.41%和0.50%。
在 pH 6.2±0.2、37 ℃、200 r/min的条件下检测培养基中乙醇体积分数对产生CO2的影响,见图4(a)。结果显示,随着培养基中乙醇体积分数的增加,TYF-LIM-L09的CO2产出量逐渐降低,当乙醇体积分数为8%或更高时,几乎没有CO2产生。图4(b)显示了在37℃、200 r/min条件下,培养基初始pH值对TYF-LIM-L09产生CO2的影响。结果显示,在pH 4.0~5.0条件下,培养物几乎没有CO2产生;pH 5.5~7.5时均有CO2产生并且pH 6.0时的产气量最大。
2.5 TYF-LIM-L09的糖代谢关键酶活性
丙酮酸激酶、丙酮酸脱羧酶和醇脱氢酶是葡萄糖代谢途径中的关键酶,与丙酮酸、CO2、乙酸、乙醇的生成密切相关[26]。由于在培养过程中TYF-LIML09表现出了较强的生产CO2的特性,因此使用粗酶液测定了TYF-LIM-L09的糖代谢关键酶活性,表4中数据从酶学方面验证了该菌群的糖代谢能力。
3 结语
课题组从5个不同批次的腐败醋样中分离获得了来源于8个已知属的44株细菌,2株未知属的菌株及4个稳定菌群。其中,乳酸杆菌属、芽孢杆菌属和葡萄球菌属在相关研究中已经报道过,而鲁梅利杆菌属、短波单胞菌属、肠球菌属、漫游球菌属和类芽孢杆菌属均是在本研究中首次分离获得,说明腐败醋样本数量以及样本的酿造工艺来源对条件致腐微生物的分离和筛选有着重要的影响。

图4 TYF-LIM-L09在不同乙醇体积分数以及不同pH的培养条件下产气量的变化情况Fig.4 Gas production by TYF-LIM-L09 under different alcohol concentrations and pH values
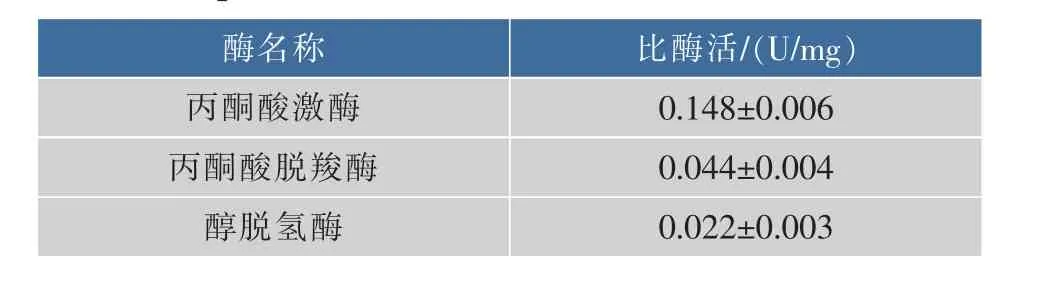
表4 TYF-LIM-L09粗酶液的丙酮酸激酶、丙酮酸脱羧酶和醇脱氢酶活性Table 4 Activities of pyruvate kinase,pyruvate decarboxylase,alcohol dehydrogenase in the cell-free supernatant of TYF-LIM-L09
本研究就强产气菌群TYF-LIM-L09的组成结构和生长特征进行了深入研究,首次发现了导致胀气的关键微生物以稳定的群落形式存在,这也从另一方面解释了前期相关研究中对食醋酿造条件致腐微生物鉴定结果不一致的问题。课题组在TYF-LIM-L09的分离过程中使用了不同的选择性培养基,进行了多轮次划线分离,但单菌落的16S rDNA扩增结果始终为套峰,所以判断其为共生菌群,并对TYF-LIM-L09进行了宏基因组分类测序分析,分析结果也验证了之前的判断。TYF-LIM-L09的宏基因组分类测序分析结果显示,其由乳酸杆菌属、假单胞菌属、短波单胞菌属、鞘氨醇单胞菌属、芽孢杆菌属、金黄色葡萄球菌属等不同种属的微生物组成,这当中就含有前期研究中报道较多的乳酸杆菌属和芽孢杆菌属[27]。分析结果表明,条件致腐微生物的耐高温性质可能与其组成结构有关,同时也很好地解释了前期研究中分离获得的乳酸杆菌与致腐微生物耐高温特性之间的矛盾。
食醋酿造高温腐败现象虽然多发生在醋酸发酵阶段,但在低浓度酒精发酵阶段也偶有发生,且腐败的成品醋多伴随着拉丝、胀气等变质现象。结合食醋高温腐败现象特征,作者对TYF-LIM-L09的温度、乙醇、pH耐受及产气特征做了系统的研究,该菌群表现出了很好的乙醇耐受和产气能力,研究结果很好地支持了TYF-LIM-L09为引起食醋腐败的关键微生物。
随着研究的不断深入,发现引起食醋酿造高温腐败现象的微生物组成较为复杂,这些不同种群来源的微生物在营养代谢方面相互依赖、互为补充,形成了稳定的共生体系。探索研究核心致腐微生物菌群营养代谢特征的有效方法有利于揭示食醋酿造高温条件致腐现象的本质,对解决食醋酿造高温腐败问题也有着重要意义。

