基于WHO新分类的垂体腺瘤诊断及临床病理分析
高 巍 赵莉红 王 玮 王雷明 许素素 隗立峰 滕梁红
(首都医科大学宣武医院病理科,北京 100053)
随着2017版世界卫生组织(World Health Organization, WHO)垂体腺瘤新分类[1]的提出,垂体腺瘤分类从仅依靠分泌激素的类型到结合分化谱系进行分类的新时代,本研究基于垂体腺瘤新分类系统,回顾性分析垂体腺瘤的临床表现、病理组织学形态及免疫表型,探讨新分类系统下垂体腺瘤诊断的临床病理学特点。
1 对象与方法
1.1 标本收集与临床资料
回顾性分析了2017年1月至2018年5月期间首都医科大学宣武医院病理科诊断为垂体腺瘤的134例病例的资料。
1.2 研究方法
所有病例标本均来源于手术切除后送检组织,经过10%(体积分数)中性甲醛固定,石蜡包埋,苏木精-伊红(hematoxylin-eosin,HE)染色。免疫组织化学染色均采用链霉菌抗生物素蛋白-过氧化物酶(streptavidin-perosidase,SP)两步法,所用抗体有促黄体生成素(luteinizing hormone,LH)、卵泡刺激素(follicle stimulating hormone,FSH)、促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)、催乳素(prolactin hormone,PRL)、促甲状腺激素 (thyroid stimulating hormone,TSH)、生长激素(growth hormone,GH)、细胞角蛋白18(Cam5.2,CK18)、雌激素(estrogen receptor,ER)、垂体特异性POU-同源结构域转录因子(pituitary transcription factor 1, Pit-1)、 T-box家族成员TBX19转录因子(T-box transcription factor TBX19, T-pit)、类固醇生成因子1(steroidogenic factor-1, SF-1)、Ki-67。所有抗体除SF-1来自于基因科技公司外,其余均为中杉金桥生物公司产品。过碘酸希夫反应 (periodic acid-Schiff,PAS)特殊染色染液来自于罗氏诊断产品公司,每种抗体均设阳性与阴性对照。
2 结果
2.1 患者一般情况
134例患者中男性74例,女性60例,年龄14~76岁,中位发病年龄51岁。101例(75.4%)患者临床表现无特异性,多为压迫症状,如头晕头痛、耳鸣、听力下降、视力受损等,其余31例患者出现不同程度的激素异常导致的临床症状。所有患者术前影像均显示蝶鞍占位性病变,影像学评估微腺瘤(<1 cm)7例,大腺瘤(1~4 cm)120例,巨大腺瘤(>4 cm)7例。
2.2 依据WHO 2017版垂体腺瘤分类标准[1]重新诊断分类(表1)
1)生长激素细胞腺瘤
本研究中共有17例(12.7%)生长激素细胞腺瘤,其中11例(64.7%)临床表现为肢端肥大,3例血清学检测显示生长激素升高。1例泌乳生长激素细胞腺瘤临床表现为停经,血清学仅显示生长激素升高。2例泌乳生长激素细胞腺瘤患者为复发病例。

表1 134例垂体腺瘤患者的临床特征
Pit-1: pituitary transcription factor 1.
本组中生长激素细胞腺瘤多为大腺瘤(14例),其中致密颗粒型生长激素细胞腺瘤大小均<2 cm,而稀疏颗粒型生长激素腺瘤大小均>2 cm(图1A)。HE染色可见肿瘤细胞中等大小,呈圆形或多角形,胞质丰富、强嗜酸性(图1B)。免疫组织化学染色表达GH及Pit-1(图1C、D),其中3例致密颗粒型生长激素细胞腺瘤GH及CK18表达呈弥漫、浓染,2例稀疏颗粒型生长激素细胞腺瘤GH表达较稀少,CK18呈点状纤维小体阳性(图1E);14例泌乳生长激素细胞腺瘤中同一肿瘤细胞在表达GH的同时也部分表达PRL,1例混合性生长激素和泌乳激素细胞腺瘤显示不同的肿瘤细胞分别表达GH或PRL,且ER部分阳性表达,主要表达于PRL阳性区域。
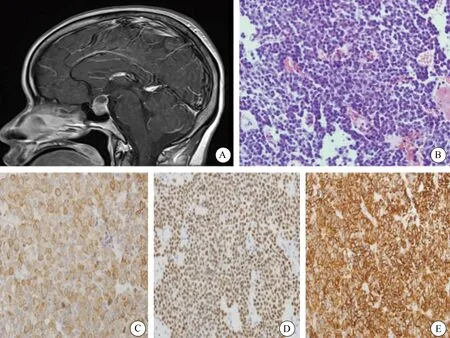
图1 稀疏颗粒型生长激素细胞腺瘤
2)泌乳激素细胞腺瘤
本研究11例(8.2%)泌乳激素细胞腺瘤中仅3例女性患者出现停经、泌乳症状,其中1例伴有血泌乳素升高,且该患者为复发病例。此外,还有1例男性患者表现为泌乳素升高,1例男性患者为复发病例。
泌乳激素细胞腺瘤主要为大腺瘤(9例),1例微腺瘤患者为女性,1例巨大腺瘤患者为男性。HE染色可见肿瘤细胞呈圆形,嫌色性或嗜酸性胞质,细胞轻度异型性。免疫组化染色PRL和Pit-1呈阳性表达,其中4例表达ER。PRL染色呈强阳性,弥漫整个胞质的致密颗粒型泌乳激素细胞腺瘤1例,PRL染色呈核周部分阳性的稀疏颗粒型泌乳激素细胞腺瘤7例。
3)促甲状腺激素细胞腺瘤
本研究中仅1例(0.7%)促甲状腺激素细胞腺瘤,该患者临床表现为甲状腺功能亢进,并伴有血促甲状腺素升高,且该患者为复发病例。影像提示肿瘤为大腺瘤。HE染色可见肿瘤细胞排列呈窦隙状,间质纤维化明显,细胞胞质呈嫌色性。免疫组织化学染色示TSH和Pit-1阳性。
4)静止性Pit-1阳性垂体腺瘤
4例(3.1%)静止性Pit-1阳性垂体腺瘤患者均为女性,临床表现及血激素均无异常,影像学提示肿瘤直径均>3cm,免疫组织化学染色仅表达Pit-1,而没有激素表达。
5)促肾上腺皮质激素细胞腺瘤
25例(16.4%)促肾上腺皮质激素细胞腺瘤患者主要为女性(23例,92%),其中1例患者出现库欣综合征,并伴有血皮质醇升高;4例出现停经或泌乳,其中2例患者伴泌乳素升高,1例患者仅表现为血皮质醇升高。25例患者中6例为复发病例,4例为稀疏颗粒型,3例为静止性促肾上腺皮质激素细胞腺瘤。
本研究中促肾上腺皮质激素细胞腺瘤主要为大腺瘤(22例,88%),其中稀疏颗粒型促肾上腺皮质激素细胞腺瘤均为大腺瘤或巨大腺瘤(图2A)。HE染色可见肿瘤细胞弥漫分布,部分围绕毛细血管排列,细胞呈嗜碱性或嫌色性(图2B)。免疫组织化学染色显示,3例静止性促肾上腺皮质激素细胞腺瘤ACTH为弱阳性或阴性(图2C),而均表达T-Pit(图2D),其中1例为I型(致密颗粒型,PAS染色强阳性),2例II型(稀疏颗粒型,PAS染色弱阳性)(图2E);其余22例ACTH及T-Pit均呈阳性。11例致密颗粒型促肾上腺皮质激素细胞腺瘤ACTH呈强阳性,且特殊染色PAS呈颗粒状强阳性;14例稀疏颗粒型促肾上腺皮质激素细胞腺瘤ACTH呈弱阳性,特殊染色PAS呈颗粒状弱阳性。
6)促性腺激素细胞腺瘤
68例(50.7%)促性腺激素细胞腺瘤患者中男性(53例)明显多于女性(15例),7例患者出现停经、泌乳或性欲下降症状,其中3例患者出现泌乳素升高,1例患者伴有睾酮水平下降。此外,有1例患者仅有血睾酮浓度下降而无相应临床表现。
本研究中68例促性腺激素细胞腺瘤均为大腺瘤或巨大腺瘤(图3A),HE染色可见肿瘤细胞呈实性巢状或梁状排列,部分围绕血管形成假菊形团结构,肿瘤细胞胞质丰富、嗜酸性(图3B)。免疫组织化学染色示39例ER阳性(图3E),51例同时表达LH、FSH和SF-1(图3C、D),其中FSH免疫反应普遍强于LH,13例患者LH和FSH其中一种阳性,同时SF-1阳性表达。4例静止性促性腺激素细胞腺瘤中2例FSH和LH阳性,1例仅LH阳性,1例仅SF-1阳性且该患者10年前曾行垂体腺瘤切除术。
7)零细胞腺瘤
2例零细胞腺瘤患者均无任何激素相关的临床表现及血激素异常,影像提示1例肿瘤为大腺瘤,1例为巨大腺瘤。HE染色可见肿瘤细胞弥漫分布,细胞胞质嗜酸性或嫌色性,激素及转录因子免疫组织化学染色均阴性。
8)多激素细胞腺瘤
3例多激素细胞腺瘤患者均出现血甲状腺素升高,其中2例临床表现为甲状腺功能亢进。HE染色可见肿瘤细胞嫌色性,部分细胞呈梭形,弥漫分布。免疫组织化学染色均显示肿瘤细胞Pit-1弥漫阳性,且存在TSH和PRL的同时表达。
9)双激素细胞腺瘤
3例双激素细胞腺瘤患者均为女性,其中1例患者出现停经症状,3例患者均无血激素异常。HE染色示肿瘤细胞呈巢团状排列,细胞部分嗜酸性,部分嫌色性。免疫组织化学染色可见其中2例部分表达GH、ACTH、Pit-1及T-Pit(其中1例临床表现为停经),1例表达GH、LH、Pit-1及SF-1。
3 讨论
3.1 垂体腺瘤的分类和构成
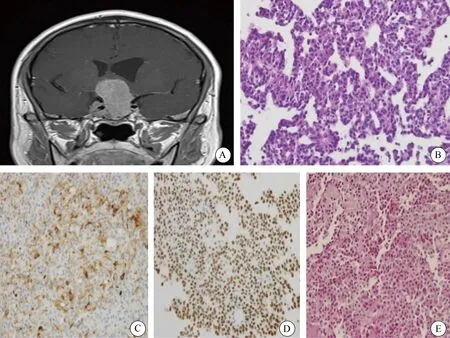
图2 稀疏颗粒型促肾上腺皮质激素细胞腺瘤

图3 促性腺激素细胞腺瘤
垂体腺瘤约占颅内切除肿瘤的25%[2]。自2000年起WHO开始将垂体腺瘤划分在内分泌系统肿瘤中,并依据肿瘤细胞分泌激素类型的不同进行分类[3]。2004版WHO垂体腺瘤的分类[3]中已经提出腺垂体细胞分化方向主要由垂体转录因子决定,包括调控嗜酸性细胞谱系(包括生长激素细胞、泌乳激素细胞及促甲状腺激素细胞);T-box家族成员TBX19转录因子(T-box transcription factor TBX19, T-pit),调控促肾上腺皮质激素细胞谱系;以及类固醇生成因子1(steroidogenic factor-1, SF-1)调控促性腺激素细胞谱系,并由此提出了垂体腺瘤谱系分型,但当时并未完全应用到分类系统中。随后在临床的不断应用及实践中发现一部分激素染色阴性的肿瘤患者存在转录因子的改变,将其归为无功能垂体腺瘤并不合适,且这样分类既不能提示肿瘤发生机制的差别,又不能很好地提示预后[4]。于是在最新的2017版WHO垂体腺瘤分类中明确指出分类必须结合激素表达和分化谱系,即通过免疫组织化学染色的方法对相关激素及转录因子(包括Pit-1、T-pit以及SF-1)进行检测,从而进一步分类。
据统计,泌乳激素细胞腺瘤是最常见的垂体腺瘤类型,约占垂体腺瘤的30%~50%[5-6]。本研究中泌乳激素细胞腺瘤仅占8.2%,与文献[4-5]报道存在差异可能与近年来内科保守治疗效果显著,使得手术比例下降有关。促性腺激素细胞腺瘤约占垂体腺瘤的43%~64%,其好发于60岁以上患者,男性略多于女性[7]。本研究中促性腺激素细胞腺瘤占50.7%,患者中位年龄57岁,其中男性(53例)显著多于女性(15例)。促肾上腺皮质激素细胞腺瘤约占垂体腺瘤的15%,其中致密颗粒型促肾上腺皮质激素细胞腺瘤最为常见,也是库欣综合征最常出现的类型,影像学通常为微腺瘤[8]。本研究中促肾上腺皮质激素细胞腺瘤占18.7%,1例库欣综合征出现在致密颗粒型促肾上腺皮质激素细胞腺瘤患者,且为微腺瘤。然而本研究25例促肾上腺皮质激素细胞腺瘤中稀疏颗粒型较多(14例),这可能与致密颗粒型通常体积小,临床无症状时不易发现有关。生长激素细胞腺瘤约占垂体腺瘤的10%~15%,其中30%~40%的患者会出现肢端肥大[9-10]。本研究中生长激素细胞腺瘤占14.9%(20例),且55%(11例)表现为肢端肥大。促甲状腺激素细胞腺瘤是最少见的垂体腺瘤类型,约占所有垂体腺瘤的0.5%~3%[11]。多数患者(89%~92%)在发现垂体腺瘤前就已出现甲状腺功能亢进的症状[12-13],影像学提示肿瘤多为大腺瘤(75%~79.6%),且35%~40%的病例具有较强的侵袭性[12, 14-15]。本研究中仅有1例促甲状腺激素细胞腺瘤,该患者表现与文献报道基本一致。
3.2 功能性垂体腺瘤、静止性垂体腺瘤和零细胞腺瘤
研究[15]显示,超过65%的垂体腺瘤为功能性垂体腺瘤,即临床存在内分泌功能紊乱,或血清学激素检测异常。其中98%的生长激素细胞腺瘤为功能性垂体腺瘤[16]。本研究中仅27.6%(37例)的病例为功能性垂体腺瘤,其中32.4%(12例)为生长激素细胞腺瘤,占本研究中生长激素细胞腺瘤的70.6%。静止性垂体腺瘤又称无功能性垂体腺瘤,患者临床没有内分泌紊乱的症状,血清学激素检测正常,但肿瘤细胞免疫组织化学染色有激素或者转录因子表达。文献[17]中80%~90%静止性垂体腺瘤为促性腺激素细胞腺瘤[17]。本研究中近一半病例(67例)为促性腺激素细胞腺瘤,而这一亚型肿瘤主要为静止性垂体腺瘤(61/67,91.2%)。泌乳激素细胞腺瘤及促肾上腺皮质激素细胞腺瘤也均以静止性垂体腺瘤为主(分别为63.6%及72.7%),而促甲状腺激素细胞腺瘤、多激素细胞腺瘤、双激素细胞腺瘤主要表现为功能性垂体腺瘤,但由于病例数较少,使得本研究中功能性垂体腺瘤明显少于静止性垂体腺瘤。
2017版WHO垂体腺瘤分类[1]明确指出零细胞腺瘤为临床表现为无功能腺瘤,并且免疫组织化学染色不表达所有激素和转录因子。而按照2004版WHO定义,零细胞腺瘤为没有激素免疫活性的无功能性腺瘤,但允许其免疫组织化学染色表达散在的激素抗体。由此推测,既往诊断的零细胞腺瘤中可能有一部分没有激素抗体的表达,但存在转录因子表达,因此不能归为零细胞腺瘤。Nishioka等[4]研究证实了这种推测,指出95%的免疫组织化学染色激素阴性的病例会有转录因子的表达,其中67 %表达SF-1,27%表达T-Pit,2%表达Pit-1。因此真正的零细胞腺瘤只占无功能垂体腺瘤的不到5%,且通常为大腺瘤,组织学表现可以呈多样性,免疫组织化学染色嗜铬粒蛋白A(chromograinin A)和突触素(Syn)阳性。
3.3 高风险垂体腺瘤
2017版WHO垂体腺瘤分类[1]中提出了高风险垂体腺瘤的概念,即肿瘤具有侵袭性的生物学行为,临床表现出易复发且难以控制的特征,包括稀疏颗粒型生长激素细胞腺瘤、男性泌乳激素细胞大腺瘤、Crooke细胞腺瘤、静止性促肾上腺皮质激素细胞腺瘤及多激素Pit-1阳性腺瘤[1]。
生长激素细胞腺瘤根据GH及CK的表达分为稀疏颗粒型和致密颗粒型,区分这两种亚型主要是研究[16-17]显示稀疏颗粒型垂体腺瘤好发于年轻女性,易复发,常提示预后不良,需要临床医生更加重视肿瘤的治疗及随访。本研究中2例稀疏颗粒型生长激素细胞腺瘤患者中位年龄仅26岁,且均为大腺瘤,提示肿瘤可能存在较活跃的生物学行为。
男性泌乳激素细胞腺瘤患者肿瘤体积通常较大,且预后较差[10, 18]。本研究6例男性泌乳激素细胞腺瘤中5例为大腺瘤,1例为巨大腺瘤,且其中1例大腺瘤为复发病例。
2017版WHO垂体腺瘤分类依据ACTH及PAS的表达方式将促肾上腺皮质激素细胞腺瘤分为致密颗粒型、稀疏颗粒型及Crooke细胞腺瘤。其中稀疏颗粒型和Crooke细胞腺瘤常表现为侵袭性大腺瘤,易复发且预后差,而这两种类型中20%为静止性促肾上腺皮质激素细胞腺瘤,后者多见于女性,常为大腺瘤,患者临床表现为无功能腺瘤,而免疫组织化学染色通常ACTH阴性,T-Pit阳性[19-20]。根据ACTH及PAS的表达将静止性促肾上腺皮质激素细胞腺瘤分为I型(致密颗粒型)和II型(稀疏颗粒型),且后者与稀疏颗粒型促肾上腺皮质激素细胞腺瘤一样通常具有侵袭性,预后差[21]。本研究也显示了类似的结果,稀疏颗粒型均为大腺瘤或巨大腺瘤,2例II型静止性促肾上腺皮质激素细胞腺瘤均为复发病例。
多激素细胞腺瘤指免疫表型表达一种以上的激素,且表达激素来源于同一腺垂体细胞谱系。较常见的为多激素Pit-1阳性垂体腺瘤,曾称为静止性第III亚型腺瘤,该亚型发病年龄较低,且生物学行为具有侵袭性[7]。有研究[22]显示,多激素Pit-1阳性垂体腺瘤并不经常表现为静止性,可以出现肢端肥大、泌乳及甲状腺功能亢进等症状。其激素免疫组织化学染色常表现为局灶性或散在的阳性,这与其他Pit-1阳性垂体腺瘤呈现出弥漫阳性的激素染色不同[23]。本研究中3例多激素细胞腺瘤均为多激素Pit-1阳性垂体腺瘤,患者临床均有激素反应性表现(甲状腺功能亢进或血甲状腺素升高)。
本研究134例垂体腺瘤依据2017版WHO进行分类后,最主要的改变是将既往因多种激素阳性而无法归类的肿瘤,依据转录因子的表达进行了重新分类,使得病理诊断与临床特征更加匹配,不仅体现了不同亚型垂体腺瘤的发生机制,还能更好的提示临床及判断预后。

